
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика измерений и вывод расчетной формулы
Экспериментальное измерение молярных теплоёмкостей при постоянном давлении CP и при постоянном объёме CV затруднительно, проще измерить отношение этих величин g = CP / CV. Одним из самых простых методов определения CP / CV является методика с использованием адиабатического и изотермического процессов.
Таблица 1
Установка состоит из баллона A, соединённого с манометром B и насосом C (рис.3.1). С помощью крана 1 баллон может сообщаться с нагнетающим насосом, а с помощью крана 2 с окружающим воздухом. Если при помощи насоса накачать в баллон некоторое количество воздуха, то давление и температура воздуха внутри баллона повышаются.
Вследствие теплообмена с окружающей средой через некоторое время температура воздуха, находящегося в баллоне, сравнивается температурой внешней среды. Внутри баллона устанавливается давление P 1 = P 0 + r gh 1, (5) где P 0 - атмосферное давление, r gh 1 - добавочное давление, измеряемое разностью уровней жидкостей h 1 в манометре, r - плотность жидкости, g - ускорение свободного падения. Таким образом, состояние воздуха внутри баллона, которое назовём состоянием 1, характеризуется параметрами P 0 + r gh 1, V 1, T 1. Если открыть на некоторое время кран 2, то процесс расширения газа можно считать адиабатическим. Давление в сосуде установится равным атмосферному давлению P 0, температура газа понизится до T 2, а объём занимаемый газом равен V 2 = V 1 + D V, где D V - объём воздуха, вышедшего из баллона.
Следовательно, в конце адиабатического процесса 1 -2 параметры газа в состоянии 2 - P 0, V 2, T 2. Применяя к состояниям 1 и 2 уравнение Пуассона, получим
или (V 2 / V 1) g =(P 0 + r gh 1)/ P 0 . (7) Охладившийся при расширении воздух в баллоне и вне его через некоторое время вследствие теплопроводности нагревается до температуры внешней среды T 1 (процесс 2-3); давление возрастает до величины P 2 = P 0 + r gh,. В состояниях 1 и 3 воздух имеет одну и ту же температуру (точки 1 и 3 лежат на одной изотерме). Поэтому можем применить закон Бойля-Мариотта. (P 0 + r gh 1) × V 1 =(P 0 + r gh 2) V 2. (8) Возведя обе части уравнения (8) в степень g, получим Сравнение уравнений (7) и (9) дает Логарифмируя последнее выражение и решая полученное относительно g, находим: Давления P 0, P 0 + r gh 1, P 0 + r gh 2 мало отличаются друг от друга, поэтому разности логарифмов давлений можно считать пропорциональными разностям давленийи приближённо положить: Таким образом, экспериментальное определение CP / CV сводится к измерению высот h 1 и h 2.
Порядок выполнения работы 1. Закрыть кран 2 и открыть 1. С помощью насоса накачать воздух в баллон до тех пор, пока разность уровней жидкости в манометре не достигнет 20-25 см. 2. Подождать 2-4 минуты до тех пор, пока температура воздуха в баллоне не станет равной температуре окружающей среды. Определить уровни воды в коленах манометра и их разность h 1 занести в табл. 2. 3. Закрыть кран 1, и открыть кран 2 на малый промежуток времени, пока уровни жидкости не пройдут положение равновесия. Определить новые значения уровней воды в манометре и их разность h 2 занести в табл. 2. 4. Повторить все измерения не менее 5 раз. По формуле (12) рассчитать экспериментальные значения
5. Рассчитать случайную погрешность измерений по формуле где 6. Рассчитать относительную погрешность измерения по формуле 7. Записать с учетом округления окончательный результат. 8. Сравнить результат эксперимента с теоретическим значением, определить расхождение в процентах. Таблица 2
Контрольные вопросы 1. Какой процесс называется адиабатным? Запишите уравнение адиабаты идеального газа в различных его видах. 2. Как определяется работа идеального газа при различных процессах? 3. Сформулируйте первый закон термодинамики и примените его к различным изопроцессам в газах. 4. Что такое число степеней свободы молекул? Чему равно число степеней свободы молекул для одноатомного, двухатомного и многоатомного газа? 5. Чему равен показатель адиабаты для одноатомного, двухатомного и многоатомного газа? 6. Как связаны между собой молярные и удельные теплоемкости газа при постоянном давлении и постоянном объеме? Изучение релаксационных
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.202.167 (0.012 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
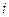



 (6)
(6) . (9)
. (9) . (10)
. (10)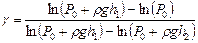 . (11)
. (11) (12)
(12) ,
,  - средняя квадратичная ошибка среднего арифметического для
- средняя квадратичная ошибка среднего арифметического для 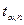 - коэффициент Стьюдента,
- коэффициент Стьюдента,  - число измерений.
- число измерений.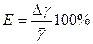 .
. мм
мм
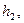 мм
мм





