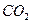Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Часть А. Дайте полное решение заданий. Укажите номер правильного ответа:
Укажите номер правильного ответа: 1. Электронная формула 1)
2. Пространственная конфигурация угловая соответствует частицам (два варианта ответа): 1)
3. Окисление аммиака протекает по уравнению: 4NH3 + 3О2 → 2N2 + 6H2О ∆Н = – 1528 КДж г г г ∆Н0обр. КДж/Моль 0 0 −285,84
Теплота образования аммиака (∆Н0 обр. NH 3) равна: 1) − 92,15 КДж/Моль 3) − 46,76 КДж/Моль 2) 92,15 КДж/Моль 4) + 46,76 КДж/Моль
4. Если энтальпия образования СO2 равна (− 393,5 КДж/моль), то количество теплоты, выделяемое при сгорании 24 г углерода, равно ___ КДж 1) 196,8 2) 305,3 3) 600,2 4) 787,0 5. При проведении обратимой реакции 2NО(г) + О2 (г) ↔ 2NО2 (г) начальные концентрации NО и О2 были соответственно равны 1,2 и 0,8 моль/л, а в состоянии равновесия концентрация NО2 составила 0,4 моль/л, тогда константа равновесия равна _____________________________________ 1) 0,42 2) 0,84 3) 4 4) 8
Часть В. Выполните тестовые задания
Дополните: 1. Атом – это ______________________________________________________ 2. Спиновое квантовое число обозначается буквой _____________, принимает значения _________________________, характеризует ___________________ 3. В группах (главных подгруппах А) сверху вниз радиус атома ___________, энергия ионизации ______, ОЭО _________, увеличиваются свойства ______
4. Энергия связи – это _______________________________________________ 5. Число 6. Первый закон термодинамики имеет математическое выражение ________ 7. Критерием самопроизвольного протекания реакций (для реальных систем) является величина, называемая _____, рассчитывается по формуле _________ 8. Правило Вант Гоффа формулируется ______________. Его математическое выражение имеет вид _______________________________________________
9. Математическое выражение Кр для реакции: 2SO2 (г) + О2 (г) ↔ 2SO3 (г) имеет вид: _________________________________________________________
Укажите номер правильного ответа:
10. Две свободные 1)
11. Электронная формула иона 1) 12. Атому 1) 2)
13. Низшая степень окисления для элемента с электронной формулой 1)
14. Вещества с ковалентной неполярной связью это: 1) водород 3) фтороводород 2) алюминий 4) вода 15. 1)
16. Более устойчивый оксид: 1) ½ О2 + Mg → MgО, ∆H= – 600 КДж/Моль 2) ½ О2 + Zn → ZnО, ∆H= – 357 КДж/Моль 3) ½ О2 + Cu → CuО, ∆H= – 155 КДж/Моль 4) ½ О2 + Hg → HgO, ∆H= – 88,2 КДж/Моль 17. Кислотные свойства преобладают в большей степени у оксида (подтвердите расчётами): 1) Al2O3 + CaO → Ca(AlO2)2 ∆G0 КДж/Моль – 1582 – 604,2 – 2210 2) В2O3 + CaO → Ca(ВO2)2 ∆G0 КДж/Моль – 1184 – 604,2 – 1924 18. Если температурный коэффициент скорости химической реакции равен 3, то при повышении температуры от 20оС до 60оС скорость реакции _________ 1) увеличивается в 81 раз 3) увеличивается в 27 раз 2) уменьшается в 12 раз 4) уменьшается в 9 раз
19. Для смещения равновесия в системе СаСО3 (к) ↔ СаО(к) + СО2 (г) ∆Н > 0 в сторону продуктов реакции необходимо ______________________________ 1) понизить температуру 3) ввести катализатор 2) повысить концентрацию СО2 4) повысить температуру
20. При повышении давления в 3 раза скорость реакции 2NO(г)+Cl2(г)→2NOCl(г) увеличивается 1) в 81 раз 3) в 9 раз 2) в 27 раз 4) в 3 разa ВАРИАНТ № 3
|
|||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 130; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.25.74 (0.011 с.) |
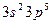 соответствует атому:
соответствует атому: 2)
2) 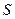 3)
3) 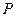 4)
4) 
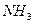 2)
2) 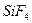 3)
3) 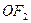 4)
4) 
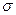 – связей в молекуле
– связей в молекуле 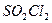 равно ___________________________
равно ___________________________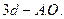 имеет атом:
имеет атом: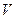 2)
2) 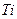 3)
3) 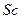 4)
4) 
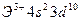 соответствует атому:
соответствует атому: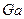 2)
2) 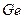 3)
3) 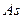 4)
4) 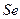
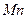 в возбужденном состоянии соответствует формула
в возбужденном состоянии соответствует формула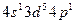 3)
3) 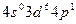
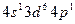 4)
4) 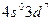
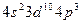 равна:
равна: 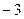 2)
2) 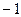 3)
3) 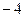 4)
4) 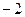
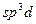 − гибридизация в следующей частице:
− гибридизация в следующей частице: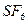 2)
2) 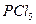 3)
3) 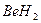 4)
4)