
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика элементов I группыСодержание книги
Поиск на нашем сайте
К I группе элементов относятся щелочные металлы: литий, натрий калий, рубидий, цезий и франций (главная подгруппа), а также медь, серебро и золото (побочная подгруппа). Свое название щелочные металлы получили от названия их гидроксидов, которые из-за хорошей растворимости издавна называли щелочами. Как и щелочноземельные металлы, щелочные относятся к s-элементам. В их атомах на внешнем электронном уровне находится один s-электрон, который они легко отдают, образуя ионы с зарядом +1. Других валентных состояний щелочные металлы не имеют. В элементах побочной подгруппы на внешнем уровне также находится один s-электрон, но этот уровень располагается после только что застроенного d-уровня. Поэтому в образовании соединений элементами подгруппы меди принимает участие кроме s-электрона один или два d-электрона, поэтому в соединениях эти элементы проявляют не только степень окисления +1. Для меди наиболее стабильны соединения со степенью окисления +2, для серебра +1, а для золота +3. Щелочные металлы очень реакционноспособны. Они вытесняют водород из воды и кислот. Наиболее активным металлом является франций. Высокая химическая активность щелочных металлов объясняется малой величиной энергии, необходимой для отрыва единственного валентного электрона от атома. Так, цезий теряет электрон уже при освещении. Литий был открыт А. Арфведсоном в 1817 г., а в свободном состоянии получен Р. В. Бунзеном и О. Маттисеном в 1865 г. Содержание ею в земной коре составляет 3,2∙10-3%. По свойствам он несколько отличается от остальных щелочных металлов. Если почти все соли щелочных металлов хорошо растворяются в воде, то некоторые соли лития (фосфат, карбонат, фторид) растворяются довольно трудно. Как бериллий повторяет некоторые свойства алюминия, так и литий повторяет некоторые свойства магния (наблюдается сходство свойств элементов, расположенных в периодической системе по диагонали). Литий применяют при изготовлении различных свинцовых сплавов и склерона — сплава алюминия, цинка, меди, марганца, железа, кремния и лития, который но свойствам напоминает дюралюминий и применяется в самолетостроении. Добавка лития к сплавам увеличивает их твердость. Кроме того, литий применяется в качестве раскислителя при получении меди и при рафинировании серосодержащего никеля. Цезий был открыт Р. В. Бунзеном и Г. Р. Кирхгофом в 1860 г., а рубидий в 1861 г. Содержание рубидия и цезия в земной коре составляет соответственно 0,015, 3,7∙10-4%. Применение их весьма ограниченно. Их используют для изготовления фотоэлементов, так как легко теряют электроны под действием света. Франции был открыт в 1939 г. М. Переем, он радиоактивен. Встречается в продуктах радиоактивного распада актиния. В отличие от щелочных металлов активность элементов подгруппы меди с повышением атомной массы понижается. Так, медь может вытеснять из соединений серебро и золото, а серебро вытесняет золото. Все эти металлы известны человеку с глубокой древности. Издавна золото применяется для изготовления украшений. Содержание его в земной коре составляет 4,3∙10-7% Чистое золото очень мягкое, поэтому его сплавляют с серебром и медью. Содержание золота в сплаве (проба) оценивается количеством частей золота на 1000 частей сплава. Золото применяется для золочения (покрытия тонким слоен поверхности) менее благородных металлов, получения некоторых сортов цветного стекла, где оно находится в коллоидном состоянии. Из металлического золота изготовляют химическую аппаратуру, посуду, электроды. Натрий и калий Эти металлы были открыты и впервые выделены в свободном состоянии в 1807 г. английским химиком Г. Дэви. Нахождение в природе. Натрий и калий — наиболее распространенные и широко применяемые щелочные металлы. Содержание каждого из них в земной коре составляет около 2,5%. В свободном состоянии калий и натрий не встречаются. Натрий входит в состав многих минералов. Самым важным является соединение натрия с хлором NaCl (каменная, или поваренная, соль). Распространены сульфат натрия Na2SO4∙10H2O (глауберова соль), карбонат натрия Na2CO3 (сода) и нитрат натрия NaNO3 (чилийская селитра). Толщина пласта хлорида натрия в некоторые месторождениях достигает нескольких сотен метров. Калий входит в состав сильвинита KCl∙NaCl, карналлита KCl∙MgCl2∙6Н2О, каинита KCl∙MgSO4∙6Н2О, а также присутствует в золе некоторых растений в виде карбоната (поташ). Калий входит в состав почти всех растений. Физические свойства. Щелочные металлы — серебристые с характерным блеском на свежесрезанной поверхности. Все они очень легкие и легкоплавкие. Плотность натрия 0,97 г/см3, температура плавления 97,8 °С, температура кипения 900 °С Плотность калия 0,86 г/см3, температура плавления 62,3 °С, температура кипения 760 °С. Щелочные металлы хорошо растворяются в ртути, образуя амальгамы. Будучи внесены в пламя горелки, натрий и калий (а также их соединения) окрашивают пламя в характерный цвет: натрий — в желтый, калий — в розово-фиолетовый. Химические свойства. Щелочные металлы — очень активны. Они очень легко отдают электроны и являются очень сильными восстановителями. Натрий и калий настолько активно соединяются с кислородом, образуя пероксиды Na2O2 и КО2 (или К2О4). При нагревании этих металлов в атмосфере водорода образуются гидриды NaH и КН. Калий и натрий хорошо взаимодействуют со всеми неметаллами и со многими сложными веществами, такими, как вода, различные оксиды и соли, восстанавливая окисленный элемент до свободного состояния: 2 К + Н2 = 2 КН (гидрид калия), 2 Na + О2 = Na2O2 (пероксид натрия), 2 К + 2 О2 = К2О4 (пероксид калия), 2 Na + Cl2 = 2 NaCl (хлорид натрия), 2 Na + S = Na2S (сульфид натрия), 6 Na + N2 = 2 Na3N (нитрид натрия), 3 K + Р = К3Р (фосфид калия), 2 Na + 2 Н2О = 2 NaOH + Н2, 10 Na + Nb2О5 = 5 Nа2O + 2 Nb, 5 К + K2TaF7 = Та + 7 KF. Хранят щелочные металлы под слоем керосина. Получение. Щелочные металлы получают электролизом расплавленных хлоридов или гидроксидов. Так как хлориды имеют более высокую, чем щелочи, температуру плавления (600-650 °С), чаще подвергают электролизу расплавы щелочей с добавкой соды или поташа (до 12%). При электролизе расплавленных хлоридов на катоде выделяется расплавленный щелочной металл, а на аноде — хлор: 2 NaCl K+: Na+ + е- = Na A-: 2 Cl- - 2 e- = Сl2. При электролизе щелочей на катоде также выделяется расплавленный щелочной металл, а на аноде — кислород: 4 NaOH K+: Na+ + е- = Na A-: 4 OН- - 4е- = 2 Н2О + О2 Вода из расплава быстро испаряется. Чтобы щелочной металл не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся щелочной металл в расплавленном виде собирается в цилиндре. Анод изготовляют также в форме цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов). Применение. Натрий и калий применяют для получения их пероксидов и амидов (NaNH2, KNH2), сплав натрия и калия — в качестве теплоносителя в ядерных реакторах. Натрий как более дешевый применяется чаще, чем калий. Он широко используется в органическом синтезе, для получения различных металлорганических соединений (например, тетраэтилсвинца), высушивания эфиров, а также в металлургической промышленности как добавка к алюмокремниевым сплавам с целью улучшения их свойств и как восстановитель при получении некоторых редких металлов из их солей. Оксиды и пероксиды щелочных металлов. При взаимодействии щелочных металлов с кислородом воздуха образуются не оксиды, а пероксиды: 2 Na + О2 = Na2O2, 2 К + 2 О2 = K2O4. Оксид натрия (калия) может быть получен при нагревании металла до температуры не выше 180 °С в среде, содержащей незначительное количество кислорода, или при нагревании смеси пероксида натрия (калия) с металлическим натрием (калием): Na2O2 + 2 Na = 2 Na2O, К2О4 + 6 К = 4 К2О. Оксиды калия и натрия обладают ярко выраженными основными свойствами: они бурно реагируют с водой, кислотами и кислотными оксидами, практического значения не имеют. Пероксиды представляют собой желтовато-белые порошки, хорошо растворимые в воде с образованием едких щелочей и пероксида водорода: Na2O2 + Н2О = 2 NaOH + Н2О2. При нагревании пероксид водорода разлагается с выделением кислорода. Взаимодействуя с кислотами, пероксид натрия образует соли и пероксид водорода. Практическое значение имеет реакция пероксидов с углекислым газом: 2 Na2О2 + 2 СО2 = 2 Na2CO3 + О2, 2 К2О4 + 2 СО2 = 2 К2СО3 + 3 О2. Свойство обменивать углекислый газ на кислород используется в противогазах, в замкнутых объемах. В качестве поглотителя используют эквимолярную смесь пероксидов калия и натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится газа больше, чем выделится (при поглощении двух объемов СО2 выделяется один объем O2), и давление в замкнутом пространстве упадет, а в случае избытка пероксида калия (при поглощении двух объемов СО2 выделяется три объема О2) газа выделится больше, чем поглотится, а давление повысится. При использовании эквимолярной смеси (Na2O2: К2О4 = 1: 1) объемы поглощаемого и выделяемого газов будут равными (при поглощении четырех объемов СО2 выделяется четыре объема О2). Пероксиды применяют в текстильной промышленности для отбеливания тканей. Получают пероксиды прокаливанием металлов на воздухе, освобожденном от углекислого газа. Гидроксиды. Твердые, белые, непрозрачные, очень гигроскопичные вещества, плавящиеся при 328 °С (NaOH) и 360 °С (КОН). Они имеют названия: гидроксид натрия — едкий натр, каустик, каустическая сода; гидроксид калия — едкое кали. Они хорошо растворяются в воде с выделением большого количества тепла. Растворимость едкого натра при 20 °С в 100 г воды составляет 109 г, а едкого кали — 112 г. Хранят гидроксиды калия и натрия в герметически закрытых сосудах. На поверхности их гидроксидов всегда образуется слой соды или поташа. Толщина его зависит от времени контакта щелочей с воздухом и концентрации в воздухе углекислого газа. Это необходимо учитывать при приготовлении растворов из сухих гидроксидов. Получение и применение. В лабораторных условиях едкий натр и едкое кали можно получить, растворяя в воде металлы (малыми порциями и с большой осторожностью), а также их оксиды и пероксиды. В промышленности едкие щелочи получают химическими и электрохимическим методами. К химическим относятся известковый и ферритный методы, а электрохимический — это электролиз водных растворов хлоридов щелочных металлов. При получении едкого натра известковым методом (каустификация соды) водный раствор соды с известью нагревают, постоянно его перемешивая: Na2CO3 + CaO + Н2О = 2 NaOH + CaCO3¯, или Na2CO3 + Ca(ОН)2 = 2 NaOH + СаСО3¯. Нерастворимый карбонат кальция отфильтровывают, а водный раствор каустика (отсюда происходит название процесса) упаривают для получения сухого продукта. По ферритному методу смесь соды и оксида железа(III) спекают при 1000-1100 °С. Оксид железа(III) обладает слабо выраженными амфотерными свойствами и как кислотный оксид реагирует только при высоких температурах, образуя феррит натрия: Na2CO3 + Fe2О3 = 2 NaFeO2 + СО2. Горячий сплав обрабатывают водой: 2 NaFeO2 + Н2О = Fе2O3¯ + 2 NaOH. В водном растворе щелочи оксид железа(III) не растворяется, его отфильтровывают, а водный раствор упаривают для получения твердой щелочи. Аналогично можно получить едкое кали.
Рис. 7.1. Схема электролитической ванны с фильтрующей диафрагмой: 1 — железный катод; 2 — асбестовая диафрагма; 3 — катодное пространство; 4 — графитовый анод; 5 — анодное пространство. Электрохимический способ получения щелочей осуществляется в специальных электролизерах. Анод изготовляют из графита, катод — из железа или ртути. В качестве электролита используют водные растворы хлоридов, которые диссоциируют на ионы металла и хлора: NaCl При пропускании электрического тока через водный раствор ионы натрия и водорода движутся к катоду, а хлора и гидроксила — к аноду. Так как натрий стоит в ряду напряжений значительно левее водорода, прежде всего восстанавливаются ионы водорода. На аноде в первую очередь происходит окисление хлорид-ионов. Если катодное и анодное пространства разделены полупроницаемой перегородкой (диафрагмой), чтобы хлор не попадал в катодное пространство, то на катоде разряжаются ионы Н+ и выделяется свободный водород 2 Н++ 2е- = Н2 а на аноде — хлор: 2 Cl- - 2е- = Сl2 2 NaCl + 2 H2O В катодном пространстве концентрируются гидроксильные ионы и образуется едкий натр. Анодом в этом процессе служат графитовые стержни, катодом — дырчатая или сетчатая железная перегородка, на которую нанесен слой асбеста, выполняющего функцию полупроницаемой диафрагмы (рис. 7.1). В анодное пространство непрерывно подается насыщенный раствор хлорида натрия, растворимость хлора в котором из-за высокой концентрации хлорид-ионов незначительна, а из катодного пространства выводится раствор едкого натра с хлоридом натрия, который подают на упаривание. Так как растворимость хлорида натрия значительно меньше растворимости едкого натра, то при упаривании хлорид натрия выкристаллизовывается, что позволяет отделить едкий натр от примеси хлорида натрия. При использовании ртутного катода, на нем разряжаются ионы натрия, а не водорода. Так как на ртутном катоде водород оказывается более электроотрицательным, чем натрий. Восстановленный натрий растворяется в ртути, образуя амальгаму. Амальгаму натрия выпускают из электролизера в другую ванну, где она взаимодействует с водой, образуя едкий натр и водород. Для ускорения реакции разложения амальгамы к ванне подключают источник напряжения так, чтобы амальгама, стала анодом. Этот метод значительно дороже прочих, но зато полученный по нему едкий натр или едкое кали отличается высокой чистотой. Едкий натр применяется в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, при производстве мыла и искусственных волокон, для изготовления полупроводников. Едкий кали значительно дороже, поэтому его применяют редко, например при производстве жидкого мыла. Соли натрия и калия широко применяются в промышленности. Важнейшими солями натрия являются поваренная соль, сода, сульфат натрия. Калий имеет большое значение для нормального питания растений. При его недостатке в почве растения развиваются очень плохо, уменьшается урожай. На производство калийных удобрений используется около 90% добываемых солей калия. Медь Медь — d-элемент, находящийся в IB-группе четвертого периода периодической системы. Электронная конфигурация атома 3d104s1. Медь в соединениях существует преимущественно в степенях окисления +1 и +2. Медь была известна человечеству еще в глубокой древности. Нахождение в природе. Содержание меди в земной коре составляет 4,7∙10-3%. Она встречается главным образом в виде сульфидных соединений. Наиболее важные минералы — медный блеск CuS, медный колчедан (халькопирит) CuFeS2 и борнит Cu3FeS3 — входят в состав так называемых полиметаллических сульфидных руд. Реже встречаются кислородсодержащие соединения: малахит (основной карбонат меди) СuСО3∙Cu(ОН)2, азурит 2СuСО3∙Cu(ОН)2 и куприт Сu2О. Физические свойства. Медь — металл красного цвета, плавится при температуре 1085 °С, кипит при 2540 °С, плотность 8,92 г/см3. Чистая медь довольно мягка, легко поддается прокатке и вытягиванию. Примеси увеличивают ее твердость. Медь отличается очень высокой электро- и теплопроводностью. Примеси мышьяка и сурьмы значительно уменьшают электропроводность меди. Она образует различные сплавы. Химические свойства. Медь относится к числу малоактивных металлов На холоду она очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой оксида, которая препятствует дальнейшему окислению металла. При нагревании медь окисляется полностью: 2 Cu + О2 = 2 CuO С сухим хлором на холоду медь не взаимодействует, но в присутствии влаги реакция проходит довольно энергично: Cu + Сl2 = CuCl2. При нагревании медь энергично взаимодействует с серой: Cu + S = CuS. Она растворяется только в кислотах-окислителях: в концентрированной серной — только при нагревании, а в азотной — и на холоду: Cu + 2 H2SO4 = CuSO4 + SO2 + Н2O 3 Cu + 8 HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O Cu + 4 HNO3(конц.) = Cu(NО3)2 + 2 NO2 + 2 Н2О Медь медленно окисляется кислородом воздуха в солянокислом растворе: 2 Cu + 4 HCl + O2 Помимо кислот, медь окисляется некоторыми оксидами неметаллов, например: 4 Cu + SO2 4 Cu + 2 NO2 Обе реакции протекают при повышенной температуре. Получение. Процесс получения меди состоит из нескольких стадий. Сначала сульфидную руду обжигают при этом часть меди превращается в оксид: 4 CuFeS2 + 13 O2 = 4 CuO + 2 Fe2O3 + 8 SO2. Затем проводят плавку на штейн и получают сульфид меди(I). При этом к огарку прибавляют кокс и песок для образования шлака: 2 CuO + FeS + С + SiO2 = Cu2S + FeSiO3 + СО,
CuO + FeO + CuS + С + SiO2 = Cu2S + FeSiO3 + CO. Далее штейн подвергают конвертерной плавке: 2 Cu2S + 3 О2 = 2 Сu2О + 2 SO2, 2 Cu2O + Cu2S = 6 Cu + SO2. Получаемая медь называется черновой. Очищают медь электролитическим рафинированием. Электролитом служит раствор сульфата меди, анодом — медные болванки черновой меди, а катодом — пластинка чистой меди. При пропускании электрического тока через электролит медь анода растворяется, а на катоде выделяется чистая медь. Применение. Большое количество меди применяется для изготовления электропроводов. Сплавы меди применяют для изготовления различной аппаратуры, деталей машин и инструментов, а также художественно-промышленных изделий. Монооксид меди CuO. Вещество черного цвета, нерастворимое в воде. Обладает основными свойствами. Взаимодействует с кислотами и кислотными оксидами: CuO + 2 HCl = CuCl2 + Н2О, CuO + SO3 = CuSO4. При его нагревании в присутствии восстановителя довольно легко выделяется медь: CuO + Н2 = Cu + Н2О, CuO + СО = Cu + СО2. Оксид меди получают окислением меди при нагревании или прокаливанием гидроксида меди: 2 Cu + О2 = 2 CuO, Cu(ОН)2 = CuO + Н2О. Он встречается в природе в продуктах выветривания некоторых медных руд и используется в производстве стекла (медно-рубиновое стекло) и эмалей как зеленый и синий красители, как окислитель в органическом анализе и в медицине. Гидроксид меди Cu(OH)2. Выпадает в виде осадка голубого цвета при действии на растворы солей меди(II) растворов щелочей (но не аммиака): CuСl2 + 2 КОН = 2 KCl + Cu(OH)2. Гидроксид меди(II) — термически неустойчивое соединение и полностью разлагается на оксид и воду при 200 °С. При действии аммиака на соли меди(II) в осадок сначала выпадает гидроксид меди, который очень легко растворяется в избытке аммиака с образованием аммиаката меди: Cu(OH)2 + 4 NH4ОH = [Cu(NН3)4](ОН)2 + 4 Н2О, Cu(OH)2 + 4 NH3 = [Cu(NH3)4](OH)2. Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов меди(II) в растворе. Гидроксид меди обладает очень слабо выраженными амфотерными свойствами. В кислотах он растворяется легко, в концентрированных растворах щелочей — с большим трудом. В первом случае образуются соли меди(II), во втором — гидроксокупраты: Cu(ОН)2 + Н2SO4 = CuSO4 + 2 Н2О, Cu(OH)2 + 2 КОН = K2[Cu(OH)4]. При сплавлении с оксидами щелочных металлов монооксида меди образуются куприты, например: CuO + Na2O Для образования комплексной соли Na2[Cu(OH)4] требуются очень концентрированные растворы (более 40%). Многие соединения меди окрашены: CuO и сульфиды — черные, Cu2O — красный; Cu(OH)2 — голубого цвета; почти все безводные соли белые, а кристаллогидраты солей меди(II) имеют голубой или зеленый цвет. Многие соли меди(II) хорошо растворимы в воде, но подвержены гидролизу, поэтому в растворе всегда должен быть небольшой избыток кислоты. Нерастворимыми солями меди(II) являются сульфид CuS, карбонат (основной карбонат) СuСО3∙Cu(ОН)2∙0,5Н2О, оксалат СuС2О4 и фосфат Cu3(PO4)2. Соединения меди(II) могут восстанавливаться по полу-реакциям: а) Сu2+ + е– 2 CuSO4 + 4 KI CuCl2 + Cu 2 CuCl2 + SO2 + 4 NaOH 2 CuS + H2 б) Cu2+ + 2e– Fe + CuSO4 Гидроксид меди может восстанавливаться до гемиоксида меди при нагревании с альдегидами, сахарами, гидразином, гидроксиламином и другими не очень сильными восстановителями: 2 Cu(ОН)2 + R-CHO Соединения меди(II) являются более распространенными по сравнению с соединениями Cu(I). Под действием восстановителей соли меди(II) в кислом растворе могут восстанавливаться до солей меди(I): 2 CuSO4 + 4 KI = 2 К2SО4 + 2 CuI¯ + I2 Гемиоксид меди, Cu2O, обладает только основными свойствами. Часть солей меди(I) хорошо растворима, но довольно неустойчива и легко окисляется кислородом воздуха: 4 CuCl + О2 + 4 HCl = 4 СuСl2 + 2 Н2О Устойчивыми соединениями меди(I) являются, как правило, либо нерастворимые (Cu2S, Cu2O, CuI), либо комплексные ([Cu(NН3)2]+ и др.). Гемиоксид меди применяется для изготовления купоросных выпрямителей переменного тока. При растворении гемиоксида меди в кислородсодержащих кислотах, например серной, образуются соли меди(II) и медь: Сu2О + H2SO4 = CuSO4 + Cu + Н2O. а при растворении в галогеноводородных кислотах — соли меди(I): Cu2O + 2 HCl = 2 CuCl + Н2O. Аммиачные растворы солей меди(I) могут взаимодействовать с ацетиленом, образуя ацетиленид меди: НСºСН + 2 [Cu(NН3)2]Cl = Cu2C2 + 2 HCl + 4 NH3. Для соединений меди(I) характерны следующие окислительно-восстановительные реакции: а) восстановление (Cu+ + е– Cu2O + СО б) окисление (Cu+ – е– CuCl + 3 HNO3 в) диспропорционирование (2 Cu+ Cu2SO4 Последняя реакция показывает, что в водном растворе ионы Cu+ практически не существуют. Серебро Серебро известно человеку с давних времен. Нахождение в природе. Самородное серебро встречается очень редко. Основная масса серебра находится либо в виде сульфида Ag2S, либо в виде тиосолей, таких, как тиоантимонит(III) Ag3SbS3, тиоарсенит(III) Ag3AsS3 и др. Эти соединения содержатся в виде примесей в различных сульфидных рудах. Общее содержание серебра в земной коре составляет 7∙10-6% по массе. Физические свойства. Серебро — белый металл с характерным блеском. Оно плавится при температуре 960,8 °С и кипит при 2163 °С. Плотность серебра 10,5 г/см3. Серебро обладает наибольшей среди всех металлов электро- и теплопроводностью. Оно образует сплавы со многими металлами. Химические свойства. Серебро относится к благородным металлам и непосредственно с кислородом не взаимодействует. Оно обладает очень большим сродством к сере и, несмотря на то что в ряду напряжений стоит за водородом, реагирует с сероводородом с образованием сульфида серебра Ag2S (серебряные предметы, находящиеся длительное время на воздухе, в котором есть следы сероводорода, темнеют). Серебро вытесняет водород из иодоводородной кислоты, образуя труднорастворимый иодид серебра: 2 Ag + 2 HI = 2 AgI + Н2. При высокой температуре серебро может взаимодействовать с хлороводородом: 2 Ag + 2 HCl = 2 AgCl + Н2. В отличие от золота серебро растворяется в кислотах-окислителях: Ag + 2 НNО3(конц.) = AgNO3 + NO2 + H2O, 2 Ag + 2 H2SO4(конц.) = Ag2SO4 + SO2 + 2 Н2O. При контакте серебра с водой, содержащей кислород, оно в очень незначительных количествах переходит в раствор. Ионы серебра убивают микроорганизмы. Поэтому вода, выдержанная некоторое время в серебряных сосудах, является стерильной. Получение. Серебро, содержащееся в сульфидах цинковых рудах, выделяют в виде интерметаллических соединений с цинком, которые всплывают на поверхность расплавленного свинца или цинка. Полученное соединение цинка с серебром нагревают и цинк отгоняется. Остаток серебра сплавляют со свинцом. Полученный свинцовый сплав нагревают в магнезитовых тиглях. При этом свинец окисляется и поглощается пористой поверхностью тигля, а серебро (королек) остается в тигле. Этот процесс называется купелированием. Серебро, содержащееся в медных рудах, переходит в черновую медь, а при рафинировании (аффинаже) последней выделяется вместе с другими благородными металлами в виде электролитического анодного шлама. Применение. Серебро служит для изготовления монет, домашней утвари, украшений, химической посуды, медицинских инструментов и электрических контактов. Соединения серебра применяются в фотографии и при изготовлении зеркал. Серебро используют для изготовления сплавов, а также в гальванопластике. Оксид серебра Ag2O. Очень мало растворим в воде, однако придает ей слабощелочную реакцию. Если к воде прибавить соль галогена, с которой серебро образует нерастворимую соль, то количество щелочи в воде увеличится: Ag2O + Н2О Ag2O + Н2О + 2 KCl Оксид серебра очень хорошо растворяется в растворе аммиака, образуя аммиакат серебра: Ag2O + 4 NH4OH = 2 [Ag(NH3)2]OH + 3 Н2О. Соли серебра. Хорошо растворимыми солями серебра являются фторид AgF, нитрат AgNO3, хлорат AgClO3 и перхлорат AgClO4. Менее растворимы сульфат Ag2SO4, ацетат CH3COOAg и нитрит AgNO2. Остальные соли серебра практически нерастворимы. Галогениды AgCl и AgBr растворяются в растворе аммиака или тиосульфата: AgCl + 2 NH4OH = [Ag(NH3)2]Cl + 2 Н2О, AgBr + 2 Na2S2O3 = Nа3[Ag(S2О3)2] + NaBr. Иодид и сульфид серебра растворяются в растворах цианидов: Ag2S + 4 KCN = 2 K[Ag(CN)2] + K2S. Соли серебра находят широкое применение. Смесь нитрата серебра (AgNO3) и нитрата калия (KNO3) в соотношении 1:2— ляпис — применяется в медицине и при производстве зеркал. В связи с тем, что оксид серебра термически нестоек нитрат разлагается по следующей схеме: 2 AgNO3 Галогениды серебра светочувствительны: под действием света они разлагаются на серебро и галоген. На этом свойстве основано фотографирование. На подложку (фотопластинку, фотопленку, фотобумагу) наносят тонкий слой эмульсии, содержащей галогенид серебра (обычно AgBr). При кратковременном действии света (экспозиции) происходит частичное разложение бромида серебра на серебро и бром. Если экспонированный фотоматериал обработать проявителем (раствором, содержащим восстановитель), то быстрее всего серебро восстанавливается в подвергшихся освещению местах, т. е. там, где уже произошло частичное его восстановление. Появляется изображение. Чтобы избежать полного разложения бромида серебра, пластинку обрабатывают закрепителем — раствором тиосульфата, который растворяет избыток бромида серебра. Аммиачные растворы солей серебра взаимодействуют с ацетиленом, образуя нерастворимый ацетиленид: НСºСН + 2 AgNO3 = Ag2C2 + 2 HNO3. ГЛАВА 8. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
|
||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 105; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.219.213 (0.009 с.) |

 2 Na + Cl2,
2 Na + Cl2,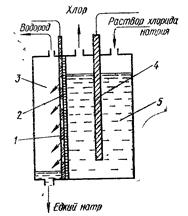
 Na+ + Cl-.
Na+ + Cl-. 2 CuCl2 + 2 H2O.
2 CuCl2 + 2 H2O. Cu2O + R-COOH + 2 H2O.
Cu2O + R-COOH + 2 H2O. Cu + CuSO4.
Cu + CuSO4. 2 Ag + 2 NO2 + O2.
2 Ag + 2 NO2 + O2.


