
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Водородные связи. Аномалии водыСодержание книги
Поиск на нашем сайте
Водородные связи. Положительно поляризованные атомы водорода могут внедряться в электронную оболочку отрицательно поляризованного атома кислорода. Таким образом, каждая молекула воды может образовывать четыре Н-связи — с участием двух несвязывающих (неподеленных) электронных пар атома кислорода и двух поляризованных атомов водорода. Благодаря Н-связям молекулы воды располагаются в жидком и твердом состояниях не произвольно, а образуя определенную структуру. Так как энергия водородной связи значительно меньше (8-40 кДж/моль) по сравнению с энергией ковалентной связи между атомами водорода и кислорода (457,7 кДж/моль), при изменении температуры и давления возможно разрушение существующих и образование новых водородных связей. Аномальные свойства воды. Вода — самое аномальное соединение на Земном шаре. Она обладает физико-химическими свойствами, которые резко отличают её от других веществ. Многие физические константы воды приняты в качестве эталонов. Так, температура таяния льда при давлении 101325 Па (760 мм рт. ст. или 1 атм.) принята за нулевую точку, а температура кипения воды при этом же давлении — за 100 °С. Вещества подобных состава и структуры имеют тем меньшую температуру плавления и кипения, чем меньше их молекулярная масса. Эта закономерность хорошо соблюдается для теллуроводорода, селеноводорода и сероводорода. По мере уменьшения молекулярной массы от H2Te до H2S температуры кипения и плавления веществ закономерно понижаются. В нарушение закономерности температура кипения и плавления воды, которая имеет наименьшую молекулярную массу среди приведенных соединений, очень резко возрастает. Вода имеет почти в 2 раза меньшую молекулярную массу, чем сероводород, а температура кипения воды на 161 °С, и температура плавления ¾ на 82 °С выше, чем сероводорода. Даже по сравнению с самым тяжелым теллуроводородом, молекулярная масса которого в 8 раз больше молекулярной массы воды, температура кипения воды выше на 104 °С, а плавления ¾ на 51 °С. Свойства водородных соединений элементов VI группы главной подгруппы
Определение плотности водяного пара при температуре кипения воды даёт для молекулярного веса значение 18,64, что соответствует наличию в паре около 3,5% удвоенных молекул. Существование в виде подобных молекул (Н2О)2 довольно характерно для воды, растворённой в некоторых органических жидкостях (например, хлороформе). Скорость распространения звука в воде (около 1400 м/с при 4 °С) примерно в 4 раза больше, чем в воздухе. По мере нагревания воды до 80 °С она несколько возрастает, а затем начинает уменьшаться. Так как молекулы воды сильно притягиваются друг к другу, они характеризуется большой величиной поверхностного натяжения. Расположенная внутри жидкости молекула находится под действием притяжения соседних частиц одинаково со всех сторон. Напротив, лежащая на поверхности молекула испытывает притяжение только с нижней стороны и тем самым втягивается внутрь жидкости. Поэтому и вся поверхность находится в состоянии известного натяжения. Под воздействием поверхностного натяжения небольшие количества воды стремятся принять шарообразную форму, соответствующую наименьшей возможной величине поверхности для данного количества вещества. Приближение к форме шара достигается тем большее, чем слабее сказывается сила тяжести, т. е. чем меньше вес капли. Таким образом, форма очень маленькой капельки воды близка к точно шарообразной. Поверхностное натяжение воды очень чувствительно даже к следам примесей. При соприкосновении жидкости с каким-либо нерастворимым в ней твёрдым веществом, например стеклом, могут быть два случая. Если притяжение молекул жидкости к молекулам твёрдого вещества сильнее, чем друг к другу, мениск (т. е. поверхность раздела с воздухом) находящейся в стеклянной трубке жидкости будет вогнутым, в противном случае — выпуклым. Первое наблюдается, например, у воды, второе — у ртути. Обычно говорят, что вода «смачивает» стекло, а ртуть «не смачивает». Если внутреннюю поверхность стеклянной трубки покрыть парафином, то вода не будет её смачивать, и форма мениска станет выпуклой. Теплоёмкость воды превышает теплоёмкость всех других жидких и твердых веществ. Теплоёмкость воды принята за единицу. Теплоёмкость спирта равна 0,3, песка — 0,2, железа — 0,1, а платины — 0,03 теплоёмкости воды. Таким образом, если нагревать равные массы этих веществ, то вода поглощает теплоты в 5 раз больше по сравнению с песком, в 10 и 33 раза больше по сравнению с железом и платиной и во столько же раз дольше удерживает это тепло. Вода обладает исключительно большой скрытой теплотой испарения, значительной теплотой плавления, огромным поверхностным натяжением, высокой диэлектрической проницаемостью и другими аномальными свойствами. Аномально изменяется плотность воды при охлаждении. Большинство известных веществ при переходе из жидкого состояния в твердое уменьшаются в объеме, при этом увеличивается их плотность. Вода — исключение, ее плотность при переходе из жидкого состояния в твердое уменьшается. Плотность льда составляет 0,92 г/см3 (имеются разновидности льда с плотностью больше единицы, но они получаются в специальных условиях). Наибольшую плотность, равную 1 г/см3, вода имеет при температуре 3,98 °С. Аномальное изменение плотности воды имеет решающее значение для поддержания жизни в водоемах при температуре ниже 0 °С: лед находится на поверхности и защищает водоемы от полного вымерзания. Повышение давления смещает максимальную плотность воды в сторону более низких температур. Так, при 50 атм. максимальная плотность наблюдается около 0 °С выше 2000 атм. аномалия плотности воды исчезает. Как и плотность, теплоемкость воды меняется с температурой аномально. В противоположность обычно наблюдающемуся последовательному увеличению теплоемкости, для воды она сначала падает, а лишь затем вновь начинает возрастать. Теплоемкость воды значительно больше, чем у других жидкостей (кроме металлов), и изменяется тоже аномально: до 150 °С возрастает, и лишь затем начитает уменьшаться. Электропроводность воды очень мала, но заметно возрастает при повышении и температуры, и давления. Критическая температура воды равна 374 °С, критическое давление 218 атм. Быстро уменьшается при нагревании вязкость воды. Поэтому горячие растворы фильтруются значительно быстрее холодных. Интересно, что при сравнительно низких температурах (примерно до 20 °С) зависимость вязкости воды от давления около 1000 атм. проходит через минимум, который при более высоких температурах не наблюдается. Растворимые соли, как правило, повышают вязкость воды. Показатель преломления воды на протяжении видимого спектра почти не изменяется (1,33 для красных лучей и 1,34 для фиолетовых при 20 °С). С повышением температуры он несколько уменьшается, а с повышением давления возрастает. Инфракрасные лучи поглощаются водой очень сильно, тогда как для ультрафиолетовых она довольно прозрачна. Атом кислорода каждой молекулы воды в твердом состоянии образует четыре связи — две валентные при участии двух неспаренных электронов и две водородные за счет двух неподеленных пар электронов:
Кроме того, каждая молекула воды образует две водородные связи при участии двух атомов водорода. Эта структура обычного легкого льда может изменяться в зависимости от давления и температуры. В настоящее время известно семь разновидностей льда. Получен лед, который тонет в воде, с плотностью больше 1, в том числе 2,32 г/см3, и “горячий” лед с температурой плавления 76 °С. При плавлении обычного льда часть водородных связей разрывается. При этом заполняются пустоты в части льдоподобной рыхлой структуры ассоциатов воды, что вызывает увеличение плотности воды при повышении температуры до 4 °С. Выше этой температуры с увеличением теплового движения ослабляются и разрываются водородные связи, плотность воды уменьшается. Химическая активность. С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и неметаллов, энергично взаимодействует с наиболее активными металлами и вступает в различные другие реакции самого разнообразного характера. Поэтому с проявлениями химических свойств воды придётся в дальнейшем встречаться довольно часто. При образовании рациональных названий химических соединений молекулы воды применяется термин “аква” или “гидрат” (в конце названия). Вода — очень сильный полярный растворитель, силы притяжения между противоположными зарядами в воде в 81 раз меньше, чем в вакууме. Вода — основная биологическая жидкость и довольно инертный растворитель многих органических и неорганических веществ. Это ее свойство очень важно для всех живых организмов, которые получают питательные вещества в мало измененном виде. Все существующие в природе тела содержат растворенную или адсорбированную воду, даже если в их составе нет химически связанной воды. Даже в ничтожно малых количествах вода обладает каталитической активностью. В отсутствие влаги, водород не реагирует с хлором, серная кислота — даже со щелочными металлами, гремучий газ не взрывается даже при высокой температуре. Все не содержащие воду органические и неорганические жидкости имеют более высокую температуру плавления и другие константы. Например, температура кипения безводного бензола выше на 26 °С, этилового спирта — на 60, ртути — почти на 100 °С. Тяжелая вода. Лед Тяжелая вода. В обычной воде 0,02% примесей составляет тяжелая вода D2O. Вследствие большой разницы между атомной массой дейтерия и протия константы тяжелой и обычной воды различны. Температура плавления тяжелой воды 3,8 °С, температура кипения 101,4 °С, температура максимальной плотности 11,6 °С. Термическая диссоциация водяного пара протекает по двум параллельным реакциям: 2 Н2О + 485 кДж = 2 Н2 + О2 и 2 Н2О + 564 кДж = Н2 + 2 ОН. Первоначально преобладает первая из них, и лишь при очень высоких температурах начинает преобладать вторая. Образующиеся в результате протекания этой реакции гидроксильные радикалы термически весьма устойчивы. Так, было установлено наличие их в атмосфере Солнца. Из-за большой величины внутреннего давления сжимаемость воды мала. В то время как обычно сжимаемость жидкостей при повышении температуры возрастает, у воды она изменяется аномально, проходя около 50 °С через минимум, положение которого практически не зависит от давления. Растворённые соли существенно снижают сжимаемость воды. Несмотря на свою небольшую величину, сжимаемость воды важна для жизни природы, т. к. снижает уровень мирового океана. Было подсчитано, что при отсутствии сжимаемости этот уровень стоял бы приблизительно на 30 метров выше современного (что привело бы к затоплению около 4% всей площади суши). Если очень чистую воду охлаждать, предохраняя от сотрясений, то её можно переохладить, т. е. достигнуть температур ниже нуля без образования льда. Однако такая переохлаждённая вода малоустойчива — при внесении в неё кристаллика льда она затвердевает. Особенно легко переохлаждаются отдельные капли воды, причём их самопроизвольное замерзание наступает тем труднее, чем они меньше. Так, при диаметрах от одного мм до одного мк температуры быстрого самопроизвольного замерзания водяных капель лежат в пределах от -24 до -38 °С. Поэтому облака даже при низких температурах состоят обычно не из частиц льда, а из капелек воды. Каждый см3 дождевого облака содержит от десятков до сотен капелек с диаметрами от 1 мк до 1 мм. Некоторые растворённые в воде примеси существенно влияют на её способность к переохлаждению. Например, при небольшой добавке ацетона удавалось переохлаждать водяные капли до -72 °С. Подобные примеси имеются, вероятно, в крови холоднокровных животных, благодаря чему их организмы способны без вреда для себя переносить замораживание и последующее оттаивание. Напротив, у теплокровных животных способность крови к переохлаждению очень невелика. Происходящая при её замораживании кристаллизация воды вызывает разрывы тканей с их последующим омертвением. При обычных условиях состояние жидкой воды является устойчивым. Напротив, переохлаждённая или перегретая вода находится в так называемом метастабильном состоянии. Последнее характеризуется тем, что само по себе оно более или менее устойчиво, но устойчивость эта легко нарушается под влиянием тех или иных воздействий. Если представить себе конус со слегка срезанной параллельно основанию вершиной, то устойчивое состояние вещества будет соответствовать такому конусу, стоящему на своём основании, а метастабильное — стоящему на вершине. Возможность более или менее длительного существования метастабильных состояний обусловлено затруднённостью возникновения при данных условиях зародышевых образований стабильной фазы рассматриваемого вещества.
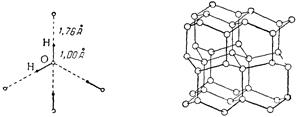
Рис. 6.4 Схема распределения Рис. 6.5. Структурная схема льда. связей в кристалле льда. Малая плотность льда связана с наличием значительных пустот в его кристаллической структуре. Последняя образована молекулами воды, соединёнными друг с другом Н-связями. Каждый атом кислорода связан с двумя “своими” атомами водорода [на расстоянии d(HO) = 100 пм] и двумя “чужими” [d(НО) = 176 пм]. Таким образом на каждую молекулу воды приходится четыре водородные связи (рис. 6.4), которые обеспечивают устойчивость структуры льда. Схема расположения кислородных атомов в этой структуре показана на рис. 6.5, а атомы водорода располагаются вдоль соединительных линий. Подобно воде, испаряться может и лёд. Давление водяного пара надо льдом при низких температурах весьма мало:
Испарение льда отнюдь не является исключением. Некоторое (обычно ничтожное и не поддающееся непосредственному измерению) давление пара имеется над любым твёрдым веществом. Иногда оно настолько велико, что становится заметным. Примером может служить нафталин, применяемый для предохранения одежды от моли. Так как в равновесной системе вода При плавлении льда температура не поднимается выше 0 °С, потому что всё избыточно сообщаемое извне тепло тратится на плавление (теплота плавления): Н2О(т) + 6 кДж = Н2О(ж). При замерзании воды это же количество тепла выделяется. Теплоёмкость льда гораздо меньше (примерно вдвое), а теплопроводность несколько больше, чем у жидкой воды. Из изложенного выше вытекает, что при плавлении льда (или снега) без подведения тепла извне температура должна понижаться. В правильности этого вывода можно убедиться, облив небольшое количество снега спиртом: вследствие образования раствора происходит быстрое таяние снега, сопровождающееся сильным охлаждением жидкости. Так как при смешивании со спиртом жидкой воды происходит заметное разогревание смеси, наблюдающееся при растворении снега охлаждение обусловлено именно его плавлением. В современной науке преобладает мнение, согласно которому плавление льда сопровождается не полным, а лишь частичным разрушением его кристаллической структуры, отдельные пустоты которой заполняются отдельными молекулами воды. С этой точки зрения, основная масса жидкой воды слагается при обычных условиях из менее или более разрыхлённой и искажённой кристаллической сетки льда, находящейся в состоянии непрерывной перестройки.В свете этих данных плотностную аномалию воды можно истолковать следующим образом: от 0 до 4 °С основное значение имеет повышение среднего числа окружающих каждую молекулу Н2О ближайших соседей, а при дальнейшем нагревании — увеличение среднего расстояния между ними. По другим представлениям, жидкая вода содержит образованные водородными связями более или менее обширные псевдокристаллические группировки молекул Н2О. Такие постоянно разрушающиеся и вновь формирующиеся молекулярные агрегаты (“кластеры”) как бы плавают в моногидрольной воде (относительное количество которой может быть и небольшим). Нагревание способствует разрушению кластеров и смещению равновесия в пользу гидролей. Выдержанная при высокой температуре (под давлением) и затем охлаждённая вода по некоторым свойствам отклоняется от обычной, причём время её возвращения к “норме” составляет несколько суток. Положение тройной точки на диаграмме состояния определяет типичный для данного вещества характер изменения агрегатных состояний при обычных условиях давления. Если точка эта лежит ниже 101325 Па, то последовательное нагревание твёрдого вещества переводит его сперва в жидкость и лишь затем в газ (пар). Напротив, если тройная точка лежит выше 101325 Па, то рассматриваемое вещество переходит из твёрдого состояния прямо в газообразное, т. е. при нагревании возгоняется. Из изложенного следует, что для получения возгоняющегося вещества в жидком состоянии нужно производить его нагревание под достаточно высоким давлением. Международным соглашением (1954 г.) температура тройной точки на диаграмме состояния воды принята за основу абсолютной температурной шкалы с точным значением 273,16 К. Температура эта может быть экспериментально воспроизведена с точностью до 10-4 К. Количество тепла, которое необходимо затратить для возгонки (сублимации) вещества, носит название его теплоты возгонки. Например для иода имеем I2(т) + 63 кДж = I2(г). Под температурой возгонки (т. возг.) понимается температура, при которой давление пара возгоняющегося вещества достигает 101325 Па. Практически возгонка довольно часто наблюдается при обычном давлении и у веществ, тройная точка которых лежит ниже 760 мм рт. ст. Происходит это тогда, когда пару нагретого вещества обеспечен свободный уход из системы. Например, при нагревании достаточного количества твёрдого иода в колбе пары его вытесняют воздух и, находясь под давлением пара I2 в 101325 Па, иод плавится. Напротив, при нагревании в открытой чашке пары I2 не накапливаются, и твёрдый иод испаряется, т. е. происходит его возгонка. Из изложенного следует, что то или иное поведение твёрдого вещества при нагревании определяется не общим внешним давлением, а создающимся в системе парциальным давлением его пара по отношению к задаваемому тройной точкой. Роль воды в природе Распространение в природе. Вода — самое распространённое на Земном шаре вещество. Её объём превышает 1,4 млрд. км3. Она покрывает около 71% земной поверхности. Если бы выровнять все горы и долины и собрать всю воду на поверхности Земли, то получился бы слой толщиной около 4 км. Около 98% природной воды содержит много солей, что делает её непригодной для питья, орошения и многих технических целей. Пресная вода, необходимая для жизни, промышленности и сельского хозяйства, составляет лишь немногим более 2% общего её количества. Основная часть которой сконцентрировано во льдах, покрывающих Арктику, Гренландию, Антарктиду, в ледовых глыбах, плавающих в полярных морях. В настоящее время эта вода практически недоступна для человечества. Количество же доступной пресной воды — всего 0,007%, которая распространена на земной поверхности неравномерно. Вода — вечный минерал. Общее количество её на Земном шаре не изменяется, но за несколько последних десятилетий значительно уменьшилось количество чистой пресной воды, в результате хозяйственной деятельности человека. Люди долгое время не задумывались над тем, что развитие промышленности и сельского хозяйства приводит к загрязнению природных, особенно поверхностных, вод. В настоящее время благодаря активным действиям правительств многих стран мира сброс загрязнений в водоёмы уменьшается. В промышленности внедряются замкнутые циклы водоснабжения, в которых предусмотрена очистка сточных вод. Затем очищенная вода используется повторно, а загрязнения очищаются, разделяются и доводятся до товарных продуктов. Чистая вода из водоёмов используется в таких циклах только для подпитки. Благодаря переводу предприятий на такой режим забор воды из водоёмов будет уменьшаться. В сельском хозяйстве с увеличением площади орошаемых земель расход воды возрастает. Здесь с успехом могут быть использованы (и уже используются) биологически очищенные городские сточные воды. Природные воды всегда содержат примеси. Одни из них находятся во взвешенном состоянии, другие — в растворённом. От большей части взвешенных частиц вода может быть освобождена отстаиванием или, быстрее, фильтрованием сквозь толстые слои песка и т. п. В лаборатории для этой цели применяется фильтровальная (непроклеенная) бумага. От растворённых веществ воду обычно очищают перегонкой. Такая перегнанная вода называется дистиллированной. Обычно применяемая в городском хозяйстве схема очистки речной воды состоит из нескольких стадий: первой операцией является добавка к воде небольшого количества сульфата алюминия, который выделяет объёмный осадок гидроксида алюминия, захватывающий различные взвешенные в воде частицы и тем способствующий их последующему осаждению в отстойнике. Отстоявшаяся вода фильтруется сквозь толстый слой песка, затем обеззараживается хлорированием и лишь после этого поступает в водопроводную сеть (для Москвы 40 млн. м3 ежедневно). Большие преимущества перед хлорированием во многих случаях имеет стерилизация воды путём её озонирования. Технически этот процесс вполне освоен, но обходится он в несколько раз дороже, что и затрудняет его широкое внедрение. Перегнанная вода свободна только от нелетучих примесей. От летучих её стараются освободить, добавляя перед перегонкой вещества, реагирующие с этими примесями и дающие с ними нелетучие продукты реакции. Всё же и тогда первые порции перегоняемой воды содержат растворённые газы воздуха. В тех случаях, когда их присутствие вредит, эти порции не собирают. Из пресных вод земной поверхности основная доля (около 24 млн. км3) падает на ледяные массивы Антарктики (90%) и других континентов. Таяние всех льдов повысило бы уровень мирового океана на 56 м. Реки и озёра составляют вместе около 2 млн. км3. Атмосфера содержит около 14 тыс. км3 воды в виде пара. На протяжении ряда геологических периодов количество свободной воды сохранялось приблизительно постоянным. Хотя и в настоящее время действуют некоторые процессы, при которых она вступает в прочные соединения, однако проходят и обратные процессы, уравновешивающие эту потерю. В результате протекающих при высоких температурах и давлениях химических реакций между веществами глубинных слоёв земли образуются «ювенильные» воды (по приближённой оценке — 3∙108 т ежегодно), которые затем выносятся на поверхность в виде водяного пара, горячих или холодных ключей. И те, и другие могут образоваться также за счёт обычных подпочвенных вод. Они часто содержат растворённые соли и газы. Тогда такие ключи называются минеральными источниками и частично используются для лечебных целей. Большая теплоёмкость морской воды (в 33000 раз превышающая теплоёмкость равного объёма воздуха) определяет климатическую роль океанов. Мощные тёплые и холодные течения обуславливают климат омываемых ими частей суши. Например, климат Европы тесно связан с Гольфстримом, который гигантской струёй (25 млн. т нагретой до 26 °С воды в с) вытекает из Мексиканского залива, пересекает Атлантический океан, омывает берега Англии и Норвегии и теряется в Северном Полярном море. Конец его захватывает Кольский полуостров. Благодаря этому Мурманск является незамерзающей гаванью, Тогда как, расположенный значительно южнее Санкт-Петербургский порт зимой замерзает. Мягкость климата Западной Европы обусловлена именно влиянием Гольфстрима, в течение круглого года проносящего у её берегов большие массы нагретой воды, которая смягчает резкость температурных колебаний, есть данные, что в настоящее время он замедляется. В противоположность “морскому”, “континентальный” климат удалённых от океана стран характеризуется резкой сменой температур по временам года. Вследствие той же причины — большей теплоёмкости воды — разница температур дня и ночи, очень резкая для стран с континентальным климатом, почти не заметна на островах океана. Океан таит в себе огромные запасы энергии. Строго периодические приливы и отливы сопровождаются более или менее резкими изменениями уровня воды, доходящими на некоторых участков океанского побережья до 10 и даже 18 метров. Ориентировочно подсчитано, что общая мировая мощность приливной волны составляет 8000 млрд. кВт. В настоящее время ведётся проектирование и строительство ряда приливных гидроэлектростанций (ПЭС), а одна из них — на реке Ранс во Франции мощностью 240 тыс. кВт уже работает, давая ежегодно более 500 млн. кВт∙ч. Растворяя газы атмосферы и перенеся их течениями на большие расстояния, океан, наряду с ветрами, выступает в роли регулятора состава воздуха. Особенно важна его роль для углекислого газа, которого океан содержит приблизительно в 40 раз больше, чем атмосфера. Путём испарения громадные количества воды постоянно переходят в атмосферу. Помимо прямого парообразования на свободной поверхности океана, рек и других водоёмов, большое значение имеет для этого процесса жизнедеятельность растений. Например, взрослая берёза извлекает корнями из почвы и испаряет с поверхности листьев до 700 л воды в сутки. Подобным же образом, за вегетационный период пшеница переводит из почвы в воздух около 2000 т воды с гектара. Подсчитано, что по всему земному шару ежегодно испаряется около 520 тыс. км3 воды (причём на это затрачивается около 20% всей получаемой Землёй солнечной энергии). Зависимость средней влажности воздуха над океаном (в % водяного пара по объёму) от северной географической широты и времени года видна из таблицы:
Содержащийся в воздухе водяной пар (наряду с углекислым газом) играет громадную роль в тепловом балансе земной поверхности: он пропускает бóльшую часть солнечных лучей, но в значительной степени задерживает обратное тепловое излучение Земли и таким образом способствует сохранению ею тепла. Осадки. Жесткость воды Попадая в верхние холодные слои воздуха, водяные пары сгущаются в мелкие капельки, которые образуют облака. Последние, перемещаясь вместе с воздушными течениями, уносят воду далеко от места первоначального испарения и в конце концов возвращают её Земле в виде осадков (дождя и снега). Осадки эти, помимо самой воды, обычно содержат небольшие количества растворённых солей. Так, осадки на территории России, характеризуются следующим средним содержанием солевых ионов:
Общее количество выпадающих ежегодно осадков соответствует покрывающему весь земной шар слою воды толщиной 1 м (тогда как конденсация всей единовременно содержащийся в атмосфере влаги дала бы только слой в 24 мм). Распределение осадков по земной поверхности весьма неравномерно. Так, в Черрапунджи (Индия) среднегодовое количество осадков превышает 10 м, а в Каире оно близко к нулю. Неравномерно и обычное для той или иной местности распределение осадков по месяцам года. Именно воды дождей дают возможность развитию жизни почти на всей твёрдой земной поверхности. В отдельных засушливых областях их роль берут на себя воды рек (ежегодный мировой сток которых составляет около 38 тыс. км3). Пользуясь водой рек и применяя искусственное орошение, можно оживить громадные области пустынь, что и делается, например, в Средней Азии, где с помощью орошения могут быть получены огромные урожаи. Общая учтённая энергетическая мощность рек России превышает 150 млн. кВт в секунду. Падая на горные массивы, воды дождей частично задерживаются в их трещинах. Зимой, при замерзании воды, образующийся лёд расширяет эти трещины, раскалывает горные породы и постепенно превращает утёсы в груду обломков. Находясь под постоянным воздействием воды, воздуха и смены температур, эти обломки всё более раздробляются. Воды дождей извлекают из них растворимые составные части и вместе с захватываемыми в виде взвесей нерастворимыми частицами (главным образом песка и глины) уносят в реки. Здесь взвешенные частицы сортируются по массе: сначала отлагается песок, дальше, в местах с более медленным течением, оседает глина. В течение веков вдоль русла реки образуются мощные залежи песка и глины, вследствие чего дно поднимается и сама река перемещается, прокладывая себе путь по новому направлению. На обнажившимся старом русле начинает образовываться почва и развиваться наземная растительность. Если в разрушаемой горной породе кроме песка и глины содержались какие-либо другие нерастворимые составные части, они также сортируются водой по их удельному весу. Так возникают залежи некоторых полезных ископаемых, например золота: его тяжёлые частички оседают вместе с более крупными зёрнами песка сравнительно близко к местам разрушения горных пород, образуя золотоносные россыпи. Взвешенные в воде рек мельчайшие частицы (так называемый ил) иногда состоят из веществ, необходимых для питания растений. В таких случаях особенно большое значение имеют весенние разливы рек, так как при них часть ила оседает на почве окружающих равнин и увеличивает их плодородие. Хорошо известна в этом отношении, например, роль разливов Нила. Этим же отчасти обусловлен повышенный урожай трав на заливных лугах. Около 15 км3 осадков выносятся ежегодно реками всего мира в океан. По пути к нему воды рек поглощают из воздуха значительное количество углекислого газа, способствующего (благодаря химическим реакциям) растворению минеральных пород по которым проходит русло реки. Поэтому по мере приближения к морю содержание растворённых веществ увеличивается. Насколько различно оно может быть в отдельных реках, показывают следующие примерные данные (мг/л):
Из данных видно, что содержание солей в речных водах России составляет немногим более 0,01%. Примерно таковы же данные и по другим рекам земного шара. Несмотря на относительно малое содержание растворённых солей, их ежегодно выносится реками в океан более двух миллиардов тонн. Вычислено, например, что Волга ежегодно выносит в Каспийское море около 50 млн. т растворённых солей. Содержание солей в морской воде несравненно больше, чем в речной. Для океана оно составляет в среднем 3,5%, а у более или менее замкнутых морей колеблется в зависимости от многоводности впадающих рек и климатического пояса, в котором расположено море. Так, солёность Средиземного моря доходит до 3,9%, тогда как солёность Балтийского составляет в среднем лишь 0,5%. Чёрное море содержит 1,8% растворённых солей. Общее содержание солей мирового океана оценивается в 5∙1016 т (из которых около 3/4 приходится на долю хлорида натрия). Среднее содержание важнейших ионов океанической воды (в процентах от их весовой суммы) таково:
Следовательно среди солей океана значительно преобладают хлористые и сернокислые соединения натрия и магния. Основное количество входящих в состав солей океана неметаллов (Cl, S, Br и др.) выделялось некогда вместе с парами самой воды из горячих недр Земли, тогда как основное количество металлов (Na, Mg, Ca и др.) накапливалось в результате разрушения твёрдых горных пород земной поверхности. Наименее растворимые составные части морской воды непрерывно оседают на дно океана. Вычислено, что ежегодно таким образом отлагаются около 2300 млн. т солей, из которых главная часть приходится на СаСО3. В результате образуются мощные залежи известняка и мела, которые представляют собой скопление останков микроскопических раковин морских инфузорий, строивших свои жилища из растворённого в воде углекислого кальция. Эти залежи могут накапливаться лишь в сравнительно неглубоких местах океана, т. к. на больших глубинах, вследствие увеличения содержания растворённого углекислого газа, оседающий СаСО3 вновь растворяется. В глубоких местах дно океана покрыто особой красной глиной, образовавшейся за счёт тепла вулканических извержений и космической пыли. В результате сдвига земной коры, моря на протяжении истории земли не раз меняли свои места. Например, ещё в сравнительно недавнюю геологическую эпоху южная половина СНГ представляла собой сплошное море, которое затем вошло в свои теперешние берега. Подобным же образом была в своё время покрыта водой Западная Сибирь. На поверхности поднявшегося морского дна оставались залежи известняка, мела и т. п. и ряд соляных озёр, частью уже высохших, частью же существующих до нашего времени (Каспийское и Аральское моря, озёра Эльтон, Баскунчак и др.). Высохшее морское дно в течение веков покрылось слоем почвы более или менее глубоко скрывшей под собой отложение некогда бывшего здесь моря. Процесс усыхания замкнутых соляных озёр протекает и в настоящее время. Особенно интересный пример представляет залив Кара-Богаз-Гол на Каспийском море. С громадной поверхностью этого залива (18 тыс. км2) вода испаряется очень интенсивно, что вызывает постоянное поступление в него через узкий и мелкий пролив всё новых количеств морской воды. В результате этого протекающего тысячелетия процесса солёность Кара-Богаз-Гола во много раз превысила солёность самого Каспийского моря (в сре
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.136 (0.022 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

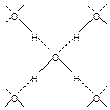
 лёд объём льда больше объёма того же количества воды, можно ожидать, что при увеличении давления равновесие сместится влево. Практически это значит, что при высоких давлениях лёд будет плавиться ниже 0 °С. Действительно, опыт показывает, что каждая атмосфера избыточного давления понижает температуру плавления льда приблизительно на 0,008 град. Таким образом, смещение точки плавления весьма незначительно. Обусловлено это тем, что объём льда лишь немногим больше объёма того же количества воды.
лёд объём льда больше объёма того же количества воды, можно ожидать, что при увеличении давления равновесие сместится влево. Практически это значит, что при высоких давлениях лёд будет плавиться ниже 0 °С. Действительно, опыт показывает, что каждая атмосфера избыточного давления понижает температуру плавления льда приблизительно на 0,008 град. Таким образом, смещение точки плавления весьма незначительно. Обусловлено это тем, что объём льда лишь немногим больше объёма того же количества воды.


