Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические и химические свойства водорода
Водород (т. пл. -259, т. кип. -253 °С) — бесцветный газ, не имеющий запаха. В воде он растворяется незначительно — 2:100 по объёму. Для него характерна растворимость в некоторых металлах. В отличие от прочих газов (кроме гелия), водород самопроизвольно расширяется при обычных температурах не с охлаждением, а с разогреванием. Он начинает вести себя “нормально” лишь ниже -80 °С. Жидкий водород имеет плотность около 0,07 г/см3, твёрдый — около 0,08 г/см3. Критическая температура водорода -240 °С, а критическое давление 13 атм. Распад молекулы водорода на атомы требует большой затраты энергии — 436 кДж/моль при 25 °С. Молекула водорода может подвергаться ионизации. Процесс идёт с образованием положительно заряженного “молекулярного иона”: Н2 + 1492 кДж = Н2+ + е-. В ионе Н2+ (d(H–H) = 106 пм) между обоими частицами осуществляется одноэлектронная связь. Последняя значительно менее прочна (энергия разрыва 259 кДж/моль), чем обычная двухэлектронная связь в нейтральной молекуле Н2. Хорошо растворяют водород, в частности, Ni, Pt и Pd, причём один объём палладия может поглотить несколько сотен объёмов водорода. Наоборот, некоторые другие металлы (например, Ag) его практически не растворяют. С растворением водорода в меди и железе приходится считаться при отливке из них изделий, так как взаимодействие этого газа с присутствующими в металле следами оксидов ведёт к образованию водяного пара, который вызывает возникновение в литье трещин и пустот. Вместе с тем способность водорода проходить сквозь нагретые металлические части аппаратуры создаёт большие технические трудности работы с ним при высоких температурах и давлениях. Так как водород является самым легким из газов, молекулы его движутся быстрее остальных. Поэтому водород характеризуется наибольшей скоростью диффузии, т. е. скорее других газов распространяется в пространстве, проходит сквозь различные мелкие поры и т. д. Этим же обусловлена и его высокая теплопроводность. Так, при прочих равных условиях нагретый предмет охлаждается водородом в семь раз быстрее, чем воздухом. Химическая роль водорода весьма многообразна, и его производные известны для многих элементов. Атом водорода может либо отдавать свой единственный электрон с образованием положительного иона (представляющего собой голый протон), либо присоединять один электрон, переходя в отрицательный ион (H- — гидрид-ион), имеющий гелиевую электронную конфигурацию.
Полный отрыв электрона от атома водорода требует затраты очень большой энергии ионизации: H + 1400 кДж = H+ + е- Вследствие этого при взаимодействии водорода с неметаллами возникают не ионные, а лишь полярные связи. Тенденция того или иного нейтрального атома к присоединению избыточного электрона характеризуется значением его сродства к электрону. У водорода оно выражено довольно слабо: Н + е- = Н- + 79 кДж Несмотря на это, ионные структуры, содержащие в своём составе Н- известны. Соединения такого типа образуются прямым взаимодействием наиболее активных металлов (Na, Ca и др.) с водородом при нагревании. По своему характеру они являются типичными солями, похожими на соответствующие производные фтора и хлора. Однако из-за их неустойчивости по отношению к воде и воздуху иметь с ними дело приходится сравнительно редко. По типу более или менее полярной связи водород соединяется со многими неметаллами: кислородом, хлором, серой, азотом и др. Водород не поддерживает горение обычных горючих веществ (являющихся соединениями углерода). Так, зажжённая свеча гаснет в нём. Однако, например, кислород горит в атмосфере водорода. Отсюда видна относительность понятия “поддерживает” или “не поддерживает” горения. Обычно его относят именно к горению соединений углерода. Сам водород горит и в чистом кислороде, и на воздухе, причём продуктом сгорания является вода. Смесь двух объемов водорода и одного объема кислорода называется «гремучим газом», их взаимодействие при поджигании протекает со взрывом. Если вместо поджигания привести эту смесь в соприкосновение с очень малым количеством мелко раздробленной платины (играющей роль катализатора), то реакция протекает быстро, но спокойно. Реакция образования воды из водорода и кислорода сильно экзотермична: 2 Н2 + О2 = 2 Н2О + 573 кДж Из-за малого заряда ядра атом водорода сравнительно слабо притягивает электроны и может присоединять их только в том случае, когда другой элемент легко их отдает. Такими элементами являются щелочные и щелочноземельные металлы, которые при нагревании в атмосфере водорода образуют солеобразные соединения — гидриды:
2 К + Н2 = 2 КН (гидрид калия), Ca + Н2 = CaH2 (гидрид кальция). Для водорода более характерны соединения, в которых он проявляет положительную степень окисления. Он взаимодействует со многими неметаллами. В зависимости от активности неметаллов реакция может протекать с различной скоростью. Так, со фтором водород взаимодействует всегда со взрывом: Н2 + F2 = 2 HF (фтороводород). Хлор взаимодействует с водородом значительно спокойнее: в темноте и без нагревания реакция протекает довольно медленно, на свету — значительно быстрее, а при наличии инициатора (искра, нагревание)— моментально и со взрывом. Поэтому смесь хлора и водорода является гремучей и требует чрезвычайной осторожности в обращении. Водород хорошо горит в атмосфере хлора. Во всех случаях реакция водорода с хлором, протекает по уравнению Н2 + Сl2 = 2 HCl (хлороводород). С бромом и иодом водород реагирует очень медленно. С другими неметаллами водород реагирует либо при высокой температуре, либо при высоких температуре и давлении. Например, с серой водород реагирует только при нагревании, а с азотом — при нагревании и высоком давлении: Н2 + S = H2S (сероводород), 3 Н2 + N2 = 2 NH3 (аммиак). Водород может отнимать кислород или галогены от многих металлов и неметаллов. В этом случае он выступает как восстановитель: CuO + Н2 = Cu + Н2О, CuCl2 + Н2 = Cu + 2 HCl. Эти реакции используются в металлургии для получения свободных металлов. Они, как правило, протекают при высоких температурах. Чем активнее металл, тем более высокая температура требуется для его восстановления. Атомарный водород Опыт показывает, что химическая активность водорода иногда сильно повышается. Это наблюдается тогда, когда реагирующие с ним вещества находятся в непосредственном контакте с выделяющимся водородом. Повышенную активность такого водорода «в момент выделения» («in statu nascendi») объясняется тем, что реагируют не молекулы Н2, а атомы. Действительно, при реакциях получения водорода (например, действием цинка на кислоту) первоначально выделяются именно отдельные атомы. Если же у места их выделения имеется вещество, способное с ними реагировать, то такая реакция может происходить без предварительного образования молекул Н2. Это представление было косвенно подтверждено, когда удалось получить атомарный водород в газообразном состоянии и изучить его реакционную способность. Оказалось, что он значительно активнее молекулярного. Атомарный водород при обычных условиях соединяется с серой, фосфором, мышьяком и т. д., восстанавливает оксиды многих металлов, вытесняет некоторые металлы (Cu, Pb, Ag и др.) из их солей и вступает в другие химические реакции, на которые при тех же условиях не способен обычный молекулярный водород. При химических взаимодействиях с участием обычного водорода молекула его должна распадаться на атомы. Но сама реакция такого распада (диссоциация на атомы) сильно эндотермична: Н2 + 435 кДж = Н + Н. Очевидно, что затрачиваемая на эту реакцию энергия (энергия диссоциации) должна быть восполнена энергией, выделяющейся при взаимодействии атомов водорода с введённым в реакцию веществом. Следовательно, можно ожидать, что реакции водорода, при которых выделяется менее 435 кДж/моль, не будет протекать самопроизвольно. В случае взаимодействия веществ с атомарным водородом такой затраты энергии на диссоциацию молекул уже не требуется. Поэтому здесь и возможен значительно более широкий круг реакций.
Атомарный водород удобно получать действием на обычный водород тихого электрического разряда. При этом часть молекул распадается на атомы, которые под уменьшенным давлением соединяются в молекулы не моментально, благодаря чему и могут быть изучены химические свойства атомарного водорода. Большое количество энергии, выделяющейся при образовании молекулы водорода, объясняет её устойчивость при обычных условиях. Вместе с тем оно же наводит на мысль о возможности термической диссоциации (разложения при нагревании) молекулы Н2, если сообщить ей достаточное количество тепла. Опыт показывает, что заметная термическая диссоциация водорода начинается примерно с 2000 °С и происходит тем в большей степени, чем выше температура. Наоборот, при понижении температуры отдельные атомы вновь соединяются в молекулы. Термическая диссоциация водорода (под обычным давлением) характеризуется следующими данными:
Переход водорода в атомарное состояние может вызываться также электромагнитным излучением с длинами волн менее 85 нм. Этим и обусловлено преобладание атомарного водорода над молекулярным в космическом пространстве. Соединение атомов водорода в молекулы протекает значительно быстрее на поверхности металлов, чем в самом газе. При этом металл поглощает ту энергию, которая выделяется при образовании молекул и нагревании до очень высоких температур. Последнее создаёт возможность технического использования атомарного водорода для атомно-водородной сварки металлов: между двумя вольфрамовыми стержнями создаётся электрическая дуга, сквозь которую по облегающим стержни трубкам пропускается ток водорода. При этом часть молекул Н2 распадается на атомы, которые затем вновь соединяются на металлической поверхности, помещенной недалеко от дуги. Таким путём металл может быть нагрет выше 3500 °С. В этих условиях происходит быстрая и прочная сварка отдельных его кусков. Большим достоинством атомно-водородной сварки является равномерность нагрева, позволяющая сваривать даже тонкие металлические детали.
Соединение атомов водорода осуществляется гораздо легче на твёрдой поверхности. При реакции по схеме Н + Н = Н2 молекула водорода заключает в себе и кинетическую энергию обоих соединяющихся атомов, и энергию их взаимодействия. В сумме это даёт запас энергии, с избытком превышающий энергию диссоциации молекулы Н2 на атомы. Такая диссоциация не происходит только в том случае, если молекула быстро освобождается от избытка энергии, передавая ее какой-либо другой частице. В самом газе это может осуществляться лишь путём тройного столкновения по схеме Н + Н + Х Если в колбу электрической лампы ввести водород (вместо аргона), то около раскалённой вольфрамовой нити будет происходить частичная диссоциация молекул Н2 на атомы. Энергия рекомбинации последних на покрытой специальным составом (люминофором) внутренней поверхности колбы вызывает её интенсивное свечение. Было показано, что от таких ламп при равной мощности можно получить значительно больше света, чем от обычных. Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в пищевой — для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород является одним из наиболее эффективных реактивных топлив. Ежегодное мировое потребление водорода превышает 1 млн. т. Эффективность жидкого водорода как реактивного топлива гораздо выше, чем спирта или керосина. Так, в комбинации с кислородом он может дать удельный импульс 390 с. Вода Состав воды. Вода — очень стойкое соединение. При нагревании она закипает, превращаясь в пар, который заметно не разлагается даже при температуре 1000 °С. При охлаждении пар конденсируется и вновь превращается в воду. При снижении температуры вода вновь переходит в лёд, который при таянии снова дает воду. Воду очень долго считали простым веществом. В 1784 г. Генри Кавендиш получил воду сжиганием смеси водорода и кислорода: 2 Н2 + О2 = 2 Н2О. В значительных количествах входит вода в состав тела живых существ. Организм человека, например, содержит примерно 70% воды, причем в крови её — около 80, в мускулах — 35, в костях — 25%. Организм рыб состоит из воды на 80%, земноводных — на 60%. Ни одно существо не может жить без воды. Если организм человека теряет в виде воды 12% массы тела, наступает смерть.
Физические свойства. Чистаявода—прозрачная жидкость без вкуса и запаха. В тонких слоях она бесцветна, а в толстых имеет голубоватый цвет. Вода — единственное соединение на планете, которое в земных условиях может находиться одновременно в трёх агрегатных состояниях: в виде льда, жидкости и пара. Вследствие испарения воды воздух всегда содержит некоторое количество её паров, зависящее от многих факторов. Ниже приведена зависимость давления паров воды от температуры:
Это давление водяных паров соответствует их парциальному давлению (давлению, которое создавал бы водяной пар, если бы занимал весь объём, газовой смеси) в воздухе или другом газе, находящемся в закрытом пространстве над водой. Количество паров воды, соответствующее этому давлению при указанной температуре, является максимальным, т. е. воздух при данных условиях насыщен водяными парами. Обычно содержание паров воды в воздухе составляет 30-90% максимально возможного. Абсолютное содержание водяного пара в насыщенном им воздухе изменяется с температурой следующим образом:
Под относительной влажностью воздуха понимается выраженное в процентах отношение действительного содержания водяных паров к отвечающему состоянию насыщения при данной температуре. Наиболее благоприятные для человеческого организма условия относительной влажности применительно к обычным комнатным температурам (t) хорошо передаются формулой 50 - 3∙(t - 20). Как видно из последней, чем выше температура, тем меньше должна быть относительная влажность. Относительная влажность воздуха зависит от географического положения местности (и многих других факторов). Например, для Москвы её усреднённые значения — минимальное (август), максимальное (февраль) и среднегодовое — равны соответственно 57, 85 и 72%. Для поддержания определённой влажности воздуха в закрытых помещениях иногда используются насыщенные растворы соответственно подобранных солей. Например, относительная влажность около 50% при 20 °С может быть поддерживаема с помощью Ca(NO3)2 или NaHSO4. При охлаждении ненасыщенного водяным паром воздуха постепенно достигается состояние насыщения, после чего избыточный водяной пар начинает выделяться в виде тумана или — при резком охлаждении — в виде дождя. Если весь процесс проходит при более низких температурах, получается соответственно иней и снег. Когда давление пара в жидкости становится равным внешнему давлению, она закипает. Для воды под нормальным атмосферным давлением (101325 Па) температура кипения равна 100 °С. Очевидно, что при уменьшении давления эта температура будет понижаться, при увеличении — повышаться. Некоторые данные для близких к нормальному и высоких давлений сопоставлены ниже:
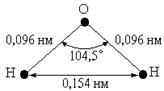
Приведённые данные показывают, что по мере роста давления температура кипения воды повышается очень быстро. Если воду тщательно освободить от взвешенных частиц и растворённых газов, и затем равномерно нагревать, предохраняя от встряхивания, то может быть достигнута температура значительно выше 100 °С, прежде чем вода бурно вскипит. При перемешивании такой перегретой воды вскипание обычно происходит тотчас же. Практически удавалось доводить перегрев воды почти до 270 °С. Последняя температура является предельной для возможного перегрева воды под обычным давлением. Со сравнительно небольшим перегревом часто приходится встречаться при кипячении жидкости, которые в этом случае кипят «толчками». Для устранения перегрева и связанных с ним явлений в жидкость иногда вводят запаянные с одного конца очень тонкие («капиллярные») стеклянные трубки, так как задерживающийся в них воздух способствует равномерности кипения. Для перевода веществ из жидкого в газообразное состояние необходимо затратить работу на преодоление взаимного притяжения молекул и внешнего давления. Величина этой работы, выраженная в Джоулях, называется теплотой испарения данного вещества. Последняя зависит от температуры, при которой происходит испарение, причём уменьшается по мере её повышения и при критической температуре становится равной нулю. Для воды при 100 °С имеем: Н2О(ж) + 41 кДж = Н2О(г). При переходе пара в жидкость это же количество тепла выделяется. Кипящая вода не может быть под атмосферным давлением нагрета выше 100 °С, т. к. всё избыточно подводимое тепло тратится на испарение. Из всех жидкостей вода характеризуется наибольшим значением теплоты испарения на единицу массы. Структура молекул воды. В состав молекулы воды (Н2О) входят 2 атома водорода и 1 атом кислорода. Этой формуле с учетом известных изотопов водорода и кислорода могут отвечать 36 разновидностей воды, из которых 9 включают стабильные изотопы водорода и кислорода, встречающиеся в природе: протий (1Н1); дейтерий (2Н1, D); 16O8; 17O8; 18O8. Химически чистая вода в основном (на 99,7 %) состоит из молекул, включающих протий и кислород 16O8. Молекулярная масса жидкой воды должна быть равной 18 а. е. м. На практике оказалось, что только в парообразном состоянии она такова. Молекулярная масса жидкой воды больше, что указывает на наличие в воде сложных молекулярных агрегатов: димерных, тримерных, тетрамерных и более сложных молекул. Для воды справедливо равновесие: х Н2О Ассоциация молекул воды происходит вследствие образования между молекулами воды водородных связей (Н-связей), их образование обусловлено структурой молекул воды, т. е. электронной структурой и размерами атомов кислорода и водорода. Кислород находится в VI группе Периодической системы. Его порядковый номер равен восьми. На внешнем энергетическом уровне атома кислорода имеется шесть электронов, четыре из которых спарены: 168O 1s22s22p4 Два неспаренных электрона двух 2р-орбиталей атома кислорода образуют с двумя электронами 1s-орбиталей атомов водорода две полярные ковалентные s-связи. Ковалентная связь обладает направленностью в пространстве и всегда возникает в направлении, обеспечивающем максимальное перекрывание электронных облаков. Так как p-орбитали направлены вдоль осей координат взаимно перпендикулярно, молекула Н2О, как и молекулы Н2S, Н2Sе, H2Тe, имеет угловое строение. Ядра атомов водорода и кислорода в молекуле Н2О образуют равнобедренный треугольник, в вершине которого находится ядро атома кислорода, а в основании маленькие ядра водорода:
Рис. 6.2. Структура молекулы воды Угол между связями НОН близок к тетраэдрическому (рис. 6.2) и равен 104,5° в отличие от угла 90° между связями в угловых молекулах Н2S, Н2Sе и Н2Те. Схематически перекрывание атомных орбиталей в молекуле воды представлено на рис. 6.3.
Рис. 6.3. Структура электронного облака молекулы воды. Электронное облако двух атомов водорода смещено к более элекроотрицательному атому кислорода, поэтому атомы водорода приобретают эффективные положительные заряды, а атом кислорода — отрицательный заряд. Молекула воды вследствие этого имеет два положительно и два отрицательно заряженных полюса.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 233; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.144.40 (0.032 с.) |
 Н2 + Х*, где Х — частица, принимающая избыток энергии. Но вероятность тройного столкновения несравненно меньше вероятности двойного, и поэтому в газе рекомбинация (обратное соединение) атомов Н идёт сравнительно медленно. Напротив, у твёрдой поверхности к образованию молекулы может вести каждое двойное столкновение атомов Н, так как воспринимающая избыток энергии частица (в виде атома или молекулы вещества самой поверхности) всегда имеется.
Н2 + Х*, где Х — частица, принимающая избыток энергии. Но вероятность тройного столкновения несравненно меньше вероятности двойного, и поэтому в газе рекомбинация (обратное соединение) атомов Н идёт сравнительно медленно. Напротив, у твёрдой поверхности к образованию молекулы может вести каждое двойное столкновение атомов Н, так как воспринимающая избыток энергии частица (в виде атома или молекулы вещества самой поверхности) всегда имеется. (Н2О)х
(Н2О)х