Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Динамика структур молекул жидкой воды.
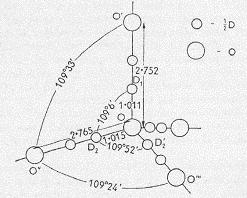
Считается, что аномальные свойства воды – повышенные температуры плавления и кипения, большая диэлектрическая проницаемость, способность к образованию ассоциатов, и др. – обусловлены наличием т.н. водородных связей между молекулами воды [П5,З1,Э3]. Но что такое водородная связь? Полагают, что атом водорода в молекуле воды, оставаясь химически присоединён к своему атому кислорода, способен образовать слабую связь с атомом кислорода другой молекулы воды. Схематически, такой водородный мостик обозначают О – Н ××× О, где штрих означает химическую связь, а троеточие – слабую. Структура льда [П5,З1,Э3], как полагают, построена на таких водородных мостиках. В обычном гексагональном льду (лёд I, при атмосферном давлении) элементарная кристаллическая ячейка имеет тетрагональную симметрию: центральная молекула воды окружена четырьмя соседними молекулами, которые находятся в вершинах тетраэдра. Об этом говорят, например, результаты зондирования монокристалла тяжёлого льда нейтронами [П7]. Структура элементарной ячейки выглядит так, как будто на центральную молекулу приходится четыре водородные связи, две из которых порождаются двумя «своими» атомами дейтерия, а две других – двумя «чужими» (рисунок из [П7] мы воспроизводим на Рис.8.8.1):
Рис.8.8.1
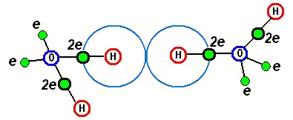
Исследования [П7] продемонстрировали поразительную особенность: на каждой линии действия водородной связи, соединяющей атом кислорода с четырьмя соседями, находятся два атома дейтерия. Такая конфигурация, будучи статической, давала бы для тяжёлой воды химическую формулу D4 O, а для обычной воды, соответственно – H4 O (понимая несуразность этого вывода, авторы [П7] на своём рисунке обозначили малыми кружками «полу-атомы» (!) дейтерия). Разумное объяснение того, каким образом водородная связь действует через цепочку «протон-протон», не предложено до сих пор – а это наводит на подозрения о том, что задача о водородной связи является некорректно поставленной. Обратим внимание на то, что нейтронно-структурный анализ позволяет судить лишь о взаимном расположении рассеивающих центров – в данном случае, ядер атомов – но не о силах, благодаря которым поддерживается такое взаимное расположение. Может быть, характерная «длина водородной связи», в 2.76 Ангстрем [П5], между ядрами атомов кислорода, обусловлена совсем не тем, что эти пары атомов как-то связаны? Заметим, что расстояние между ядром кислорода и ядром водорода в молекуле воды составляет 0.96 Ангстрем [П5] – что примерно втрое меньше «длины водородной связи». Эта кратность размеров и подсказала нам разгадку, проиллюстрированную на Рис.8.8.2. Здесь схематически изображены две молекулы воды, находящиеся на «длине водородной связи» друг от друга. Значками 2 e обозначены пары валентных электронов и, соответственно, действующие химические связи «кислород-водород» (у кислорода показаны только по четыре внешних электрона). Вспомним о феномене сфер непроницаемости в атомах (6.5) – у атомов водорода, «участвующих в водородной связи», сферы непроницаемости изображены голубым цветом. Как можно видеть, расстояние между парой молекул воды, равное «длине водородной связи», означает всего лишь их максимальное сближение – дальнейшему сближению препятствуют сферы непроницаемости атомов водорода. Пребывание этих молекул на расстоянии максимального сближения – никакой связью между ними не обеспечивается. Выходит, что водородная связь является иллюзией.
Рис.8.8.2
Однако, остаётся проблема: если, согласно результатам [П7], атом кислорода в воде имеет четырёх соседей, к каждому из которых ведёт цепочка О–Н…Н–О, то в воде не хватит атомов водорода, чтобы обеспечить такую конфигурацию. Исходя из того, что атом кислорода двухвалентен и на каждый текущий момент может химически связать не более двух атомов водорода, мы делаем вывод: для обеспечения тетрагональной структуры (Рис.8.8.1) – получаемой при усреднении на достаточных временах – атомы кислорода должны задействовать все электроны из четвёрки самых внешних для поочерёдного присоединения двух атомов водорода. Для этого атомы кислорода в воде должны циклически переключать свои валентные конфигурации – всегда оставляя валентными только какие-то два электрона из внешней четвёрки. О том, какими программными манипуляциями могут осуществляться переключения статусов валентности у атомарных электронов, мы говорили в 7.5.
Каковы оказываются результаты этих переключений? Если кислородная связка «протон-электрон», к которой химически присоединён атом водорода, перестаёт быть валентной, то химическая связь в этой группе ОН немедленно «отключается», что делает возможным отсоединение атома водорода без каких-либо энергозатрат. В условиях близкого соседства молекул воды, этот атом будет изъят и присоединён к одному из соседних атомов кислорода – через одну из его свободных связок «протон-электрон», которая вновь стала валентной. Этот процесс перехода атома водорода в состав соседней молекулы воды должен происходить за характерное «химическое» время, т.е. за ~10-12-10-11 с. Таким образом, вода в конденсированном состоянии предстаёт перед нами не в виде механического конгломерата молекул, имеющих неизменный атомный состав, как это обычно представляют – а в виде бурлящей на молекулярном уровне среды, в которой каждая молекула регулярно обменивается атомами водорода с соседями. Но эта картина – далеко не полна. Вот считается, что малая часть молекул жидкой воды диссоциирована на ионы гидроксила ОН- и водорода Н+. Измерения константы диссоциации дают, что в чистой воде при 0оС концентрация тех и других ионов составляет 3.38×10-8 от концентрации молекул воды, а при 100оС – 7.7×10-7 [Ф3]. Каков механизм этой диссоциации на ионы ОН- и Н+? Уточним, что речь ведут о полноценных ионах: молекула воды, якобы, диссоциирует таким образом, что атом водорода оставляет свой электрон в группе ОН. Могут ли ионы ОН- и Н+ в воде быть результатом тепловой диссоциации? Энергия диссоциации молекулы воды на нейтральные радикалы ОН и Н составляет 116 ккал/моль [К4], или 5.0 эВ. Энергию диссоциации на ионы ОН- и Н+ мы не нашли в литературе – но она, очевидно, больше энергии диссоциации на нейтральные радикалы. Тогда, тепловая диссоциация могла бы дать отношение концентраций ионов и нейтральных молекул, которое, по Больцману, заведомо меньше, чем exp {-5.0эВ/ kT } – что при комнатной температуре составляет e -192»4.1×10-84. Запредельная малость этой величины говорит о том, что механизм диссоциации молекул воды на ионы ОН- и Н+ не является тепловым. Не является он и радиационным – о чём свидетельствует температурная зависимость концентраций этих ионов. Но тогда каков же этот механизм? Не говорить же всерьёз о том, что вода является настолько универсальным растворителем, что немного растворяет даже саму себя! А разгадка, на наш взгляд, в следующем. Выше мы говорили о тотальном характере диссоциаций-рекомбинаций молекул жидкой воды – через переключения направленных валентностей в атомах кислорода. Мы полагаем, что эти переключения производятся в такие моменты времени, когда в связке «протон-электрон», валентность которой «отключается», в тепловом бытии (7.5) находится электрон – в результате эта связка на некоторое время «зависает» в состоянии, имитирующем наличие нескомпенсированного отрицательного элементарного заряда. Атом водорода, без каких-либо энергозатрат, отделяется от кислородной связки «протон-электрон», потерявшей статус валентной. Но эта связка имитирует отрицательный элементарный заряд – поэтому сразу после того, как электрон водорода покинет область удержания электрона кислорода, атом водорода проиндуцирует противоположный, т.е. положительный зарядовый разбаланс. В этом состоянии – с «зависшим» в тепловом бытии протоном – атом водорода будет проявлять себя как протон (такое «зависание» блокирует возможность колебаний зарядового разбаланса, т.е. блокирует возможность возбуждения атома (7.2). Этим можно объяснить, почему у воды, кишащей атомарным водородом, отсутствуют водородные спектральные линии поглощения-излучения – в частности, вода прозрачна в видимом диапазоне). Обрисованная картина означает, что вода буквально бурлит электричеством: постоянно происходит тотальная диссоциация-рекомбинация молекул, причём они диссоциируют на частицы, несущие противоположные электрические заряды. Благодаря этому и возможен электролиз воды, причём даже при напряжениях между электродами в единицы вольт. Для сравнения: «электролиз», например, бензина возможен лишь при достижении пробивного напряжения. Воду можно рассматривать как жидкую плазму, только электрические заряды в этой плазме обусловлены статическими зарядовыми разбалансами, и времена жизни этих электрических зарядов невелики, будучи сопоставимы с характерными химическими временами (~10-12-10-11 с). На наш взгляд, именно наличие этих зарядов в воде обусловливает аномально высокую (»80) диэлектрическую проницаемость воды в постоянном поле (в переменном поле эта величина уменьшается при увеличении частоты и обвально падает на частотах, соответствующих этим самым химическим временам).
Малость времён жизни этих зарядов объясняет, почему традиционными методами исследования не обнаруживается тотальная диссоциация молекул воды на радикалы Н[+] и OH[-], где квадратные скобки означают, что заряд проимитирован через статический зарядовый разбаланс. Так, при исследованиях электропроводности воды, успевают проявить себя лишь радикалы Н[+] и OH[-], находящиеся в тончайших приэлектродных слоях, что и порождает иллюзию ничтожности концентраций ионов ОН- и Н+ в воде – ведь эти ионы считаются долгоживущими. Именно радикалами Н[+] и OH[-], которыми кишит жидкая вода, мы объясняем её химическую агрессивность. Вот, например: как происходит водная коррозия чёрных металлов? Странным образом, в учебниках по физической химии [Ф3,Б2] эта коррозия трактуется как электрохимическая – через образование гальванической пары металлов и растворение того из них, который имеет более положительный потенциал. Но даже дети знают, что, при контакте с водой, железо обычно не растворяется, а превращается в ржавчину. В школе детям объясняют, что ржавчина – это гидроокись железа, т.е. результат химической реакции. А откуда берётся кислород при образовании этой гидроокиси? «Из воздуха, конечно», - отвечают теоретики. Но известно, что «при неравномерной аэрации сильнее всего корродируют участки, куда доступ кислорода затруднён, например подводные части металлических сооружений…» [Б2]. Не означает ли это, что для водной коррозии железа не требуется дополнительный кислород – кроме того, который входит в химический состав воды?
В самом деле, рассмотрим, что происходит при контакте двух сред, имеющих динамические структуры: металла, атомы которого испытывают циклические переключения направленных валентностей (8.5), и воды, кишащей радикалами ОН[-] и Н[+], которые имеют свободные валентности. Химическая активность чистых непассивированных поверхностей металлов обусловлена тем, что у поверхностных атомов временно валентными периодически оказываются связки «протон-электрон», направленные наружу (8.5) – эти связки легко образуют химические связи с радикалами внешней среды, также имеющими свободные валентные связки. Поэтому радикалы ОН[-] и Н[+] должны легко «садиться» на валентные связки атомов металла, замыкая их всех на себя и постепенно исключая атомы металла из состава динамической кристаллической решётки – и, таким образом, формировать конгломерат гидроокиси. Теперь мы можем пояснить, почему эффективен метод защиты от коррозии посредством отрицательного потенциала на защищаемом изделии – либо через создание гальванической пары с «жертвенным анодом», либо через подключение к «минусу» источника постоянного напряжения. Отрицательный потенциал позволяет взаимодействовать с изделием радикалам Н[+], но не ОН[-] – поэтому возможность образования гидроокиси исключается. Наконец, что говорит наша модель насчёт хорошей электропроводности водных растворов электролитов (солей, кислот, щелочей)? Считается твёрдо установленным, что электрический ток через раствор электролита обусловлен движением ионов противоположного знака, на которые диссоциировано растворённое вещество. Каждый такой ион считается окружённым гидратной оболочкой, которая уменьшает его подвижность, но бесспорным считается факт, что в центре этой гидратной оболочки находится полноценный ион – например, в растворе поваренной соли это либо ион Na+, с одним потерянным электроном, либо ион Cl-, с одним добавленным электроном. Корректность этих представлений, как полагают, надёжно подтверждена тем фактом, что, например, продукты растворения соли, т.е. металл и остаток, при прохождении постоянного тока движутся к противоположным электродам: металл осаждается на катоде, а остаток выделяется на аноде. Причём, строго выполняется закон Фарадея: количества выделившихся на электродах веществ определяются только количеством электричества, прошедшего через раствор электролита.
Однако, эти традиционные представления обходят молчанием вопрос о том, как растворяемое вещество разрывается не на нейтральные радикалы, а именно на ионы. Так, чтобы выполнялся закон Фарадея для растворов солей алюминия, атомы алюминия там должны быть трижды ионизированы. Энергии связей трёх внешних электронов алюминия есть 5.98, 18.82 и 28.44 эВ [Т2], что в сумме составляет 53.24 эВ. Это чудовищная, по химическим меркам, величина. Тройная ионизация алюминия не может быть обеспечена растаскиванием молекулы соли дипольными молекулами воды. На это теоретики говорят, что алюминий трижды ионизирован уже в молекуле соли, а молекулы воды растаскивают «готовые» ионы. А почему же эти «готовые» ионы не воссоединяются в растворе? Теоретики отвечают, что ионам мешают воссоединяться их гидратные оболочки. Очень смешно. Напряжённость электрического поля иона, ослабленная гидратной оболочкой в 80 раз (это значение диэлектрической проницаемости воды) даже на расстоянии 0.1 m от иона составляет десятки киловольт на метр, а ток в электролитической ванне начинает течь при разности потенциалов между электродами в единицы вольт, т.е. при напряжённостях поля менее одного вольта на метр. Выходит, что гидратные оболочки сводят на нет сильное кулоновское притяжение ионов друг к другу, но отнюдь не сводят на нет их гораздо более слабое притяжение к электродам. Что-то «не так» в представлениях о том, что продукты диссоциации электролитов являются полноценными ионами! А мы полагаем, что молекулы электролитов не содержат «готовых ионов», и что продукты их электролитической диссоциации имеют в своих составах одинаковые количества носителей отрицательного и положительного элементарных зарядов. Эффективные же заряды в растворах электролитов появляются в результате взаимодействия продуктов их диссоциации с химически агрессивной средой, кишащей радикалами ОН[-] и Н[+]. Так, соли металлов химически неустойчивы (и гигроскопичны), на наш взгляд, из-за циклических переключений направленных валентностей у атомов металла (8.5). Пусть у поверхностного атома металла Ме направленная наружу свободная связка «протон-электрон» становится валентной, и в ней начинаются тепловые колебания зарядового разбаланса (7.5). Когда в этой связке доминирует отрицательный заряд, он притягивает радикалы Н[+] – которые разворачиваются к атому металла своими протонами, но не электронами, и поэтому образование химического соединения МеН маловероятно. Когда же в той связке доминирует положительный заряд, он притягивает радикалы ОН[-] – которые разворачиваются к атому металла своими свободными электронами, и образование химического соединения МеОН весьма вероятно. При образовании этого соединения, статический зарядовый разбаланс у радикала ОН[-] пропадает; и на временах усреднения, больших по сравнению с периодом тепловых колебаний, соединение МеОН ведёт себя как электрически нейтральное. Но заметим, что вблизи МеОН остаётся радикал Н[+], заряд которого оказывается нескомпенсирован. Мы рассмотрели случай одновалентного металла; если же металл, скажем, трёхвалентен, то рядом с соединением Ме(ОН)3 должны находиться три радикала Н[+]. Каждая связь Ме–ОН существует недолго, до потери статуса валентной у задействованной связки «протон-электрон» атома металла – поэтому металло-гидроксильное соединение должно иметь динамическую структуру. Но, в результате, будет формироваться динамический гидратный комплекс с эффективным зарядом, порождаемым радикалами Н[+] – в количестве, равном валентности металла. Этими гидратными комплексами, на наш взгляд, и обеспечивается хорошая электропроводность водных растворов солей металлов. Если в воде растворяют кислоту или щёлочь, то в первом случае в растворе оказывается избыточное количество радикалов Н[+], а во втором – радикалов ОН[-]. Благодаря этим сдвигам электрического равновесия, хорошую электропроводность имеют водные растворы кислот и щелочей. Растворы же спиртов и сахаров, молекулы которых содержат радикалы ОН и Н и отлично растворяются в воде – плохо проводят электрический ток. Дело в том, что при растворении спиртов и сахаров образуются одинаковые количества радикалов ОН[-] и Н[+] – что эквивалентно добавлению чистой воды. Конечно, сказанное выше о токах в растворах электролитов справедливо для токов постоянных или низкочастотных переменных. Уже при частотах в пару десятков кГц, гидратные комплексы, практически, «стоят на месте». Вот почему для человеческого тела, состоящего на 70% из растворов электролитов, те напряжения, которые опасны на малых частотах, безвредны на больших частотах. Никола Тесла уверял даже, что они полезны!
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 75; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.31.73 (0.012 с.) |