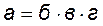Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Міністерство освіти і науки україниСтр 1 из 10Следующая ⇒
Міністерство освіти і науки україни національний Університет харчових технологій
МІКРОБІОЛОГІЯ ГАЛУЗІ
ЛАБОРАТОРНИЙ ПРАКТИКУМ для студентів напряму підготовки 6.051701 "Харчові технології та інженерія" професійного спрямування «Технології зберігання, консервування та переробки плодів і овочів» денної та заочної форм навчання
Київ НУХТ 2013 Мікробіологія галузі. Лабораторний практикум для студ. напряму підготовки 6.051701 "Харчові технології та інженерія" професійного спрямування «Технології зберігання, консервування та переробки плодів і овочів» ден. та заоч. форм навчання / Уклад.: С.М. Тетеріна,Н.М.Грегірчак, В.О.Красінько. – К.: НУХТ, 2013. – 48 с.
Рецензент: Волошина І.М. канд. техн. наук, доц.
Укладачі: С.М. Тетеріна канд. техн. наук Н.М.Грегірчак, канд. техн. наук В.О.Красінько,канд. техн. наук
Відповідальний за випуск Т.П. Пирог,д-р біол. наук, проф.
ЗАХОДИ БЕЗПЕКИ Заходи безпеки під час виконання лабораторних робіт з дисципліни “Мікробіологія галузі” збігаються з загальними положеннями “Інструкції з техніки безпеки під час роботи в лабораторних приміщеннях кафедри біотехнології мікробного синтезу”, узгодженої з начальником відділу охорони праці і техніки безпеки НУХТ та затвердженої ректором НУХТ. Особливу увагу під час виконання лабораторних робіт треба приділяти розділу 3 названого видання, де визначаються правила безпеки під час роботи з електроприладами, а також із легкозаймистими та горючими рідинами.
ЛАБОРАТОРНА РОБОТА 1
Санітарно-мікробіологічний аналіз об’єктів, що контактують з плодово-овочевою сировиною
Мета роботи: полягає у засвоєнні правил роботи у мікробіологічній лабораторії, опануванні методів санітарно-мікробіологічного аналізу об’єктів, що контактують з плодово-овочевою. Матеріали та обладнання: мікроскопи; предметні та покривні скельця; крапельниці з дистильованою водою; набір барвників. Крім того, на кожну бригаду: 1 чашка Петрі з МПА, 1 чашка Петрі з середовищем Ендо, стерильні ступка і товкачик, 1 стерильна піпетка; шпатель Дригальського, колба з 90 см3 стерильної водопровідної води; 3 пробірки з 9 см3 стерильної водопровідної води.
Загальні відомості Джерела мікробної контамінації сировини консервного виробництва Внутрішні тканини цілих здорових рослин, плодів і овочів стерильні, а на їх поверхні розвивається численна і різноманітна мікрофлора. Її джерелами можуть бути ґрунт (особливо на бульбо- і коренеплодах), органічні добрива, технічна вода, атмосферні опади, повітря, комахи, птахи, гризуни, тварини, люди, тара, спецодяг, інвентар, транспортні засоби.
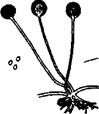
Мікрофлора ґрунту Мікробіологічні методи дослідження ґрунту. Численні популяції, що населяють ґрунт, і групи популяцій різноманітних організмів, що розрізняються за екологічними функціями і таксономічним положенням, поєднуються загальним поняттям «ґрунтова біота». Ґрунт є середовищем поширення великої кількості різноманітних мікроорганізмів: у 1 г ґрунту міститься від 1 до 10 млрд. клітин мікроорганізмів. У ґрунті активно ходять процеси розкладання органічних природних речовин за участі широкої розмаїтості сапрофітних мікроорганізмів. Для виявлення, вивчення й обліку кількості ґрунтових мікроорганізмів використовують прямі методи мікроскопування і методи посіву з розведенням ґрунтової суспензії на щільні й рідкі середовища. Для прямого мікроскопічного вивчення ґрунту застосовують метод Виноградського в різних модифікаціях. Суть його полягає в тому, що ґрунтову суспензію, нанесену на предметне скло, фіксують і зафарбовують карболовим еритрозином. Забарвлені клітини підраховують під мікроскопом. Незважаючи на те, що прямі мікроскопічні методи дають змогу виявити і підрахувати значно більшу кількість мікроорганізмів (кількість бактерій, що її обчислюють прямими методами, у 1000 разів перевищує ту, що враховують методом посіву), метод посіву залишається одним з поширених у практиці дослідження ґрунтових мікроорганізмів завдяки тому, що дає змогу враховувати не тільки кількість, а і груповий (а часто і видовий) склад мікрофлори, а також дозволяє з ізольованих колоній, що виросли на чашках, виділяти мікроорганізми в чисті культури для подальшого дослідження та ідентифікації.
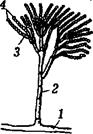
Відбір і підготовка ґрунтового зразка для мікробіологічного аналізу. При доборі зразків ґрунту враховують як надзвичайну макро-, мезо- і мікрогетерогенність мікробіологічних показників ґрунту, так і інших його властивостей. З дослідної площадки відбирають 3 – 10 зразків і аналізують їх окремо. Це дає можливість одержати статистично достовірні результати щодо середньої кількості мікроорганізмів, а також статистично опрацювати отримані дані. Зразки ґрунтів для проведення мікробіологічних досліджень відбирають у стерильні пергаментні або поліетиленові пакети чи скляний посуд з ватяними пробками тощо. За відсутності можливості аналізування зразків безпосередньо після збору, їх протягом кількох годин висушують на повітрі, оберігаючи від прямих сонячних променів. Готуючи ґрунт до мікробіологічного аналізу, слід провести такі операції: зруйнувати ґрунтові агрегати; десорбувати мікроорганізми з поверхні ґрунтових частинок та з органомінерального гелю і провести дезагрегацію мікроколоній мікроорганізмів. Для руйнування ґрунтових агрегатів найчастіше використовують метод розтирання ґрунту, зволоженого до пастоподібного стану впродовж 5 хв у стерильній фарфоровій чашці гумовим товкачиком або пальцем у гумовій рукавичці. Використовують також метод оброблення ґрунтової суспензії на електричній мішалці чи на ультразвуковій установці. Перед посівом вологий чи сухий ґрунт висипають на годинникове скло, протерте спиртом, і звільняють від сторонніх включень. Техніка посіву. Наважку підготовленого ґрунту в 1 г переносять у колбу з 100 см3 стерильної водопровідної води. Готують розведення ґрунтової суспензії, для чого 1 см3 суспензії з колби послідовно переносять у ряд пробірок з 10 см3 стерильної водопровідної води (рис. 1).
Рис. 1. Схема розведення ґрунту для проведення мікробіологічного аналізу
Посів на щільні середовища проводять з різних розведень. Розведення для висіву підбирають таким чином, щоб на чашці розвивалося 50 – 200 колоній. З кожного зразка беруть не менше трьох повторних наважок і кожну висівають не менше ніж на 3 чашках. На поверхню застиглого і підсушеного середовища наносять краплю ґрунтової суспензії певного розведення і за допомогою скляного шпателя розподіляють її по всій поверхні. Засіяні чашки перевертають догори дном і ставлять у термостат. Терміни обліку мікроорганізмів залежать від складу поживного середовища і групи мікроорганізмів, що обліковуються. На м’ясо-пептонному агарі на другу – третю добу інкубації враховують спорові й неспорові форми бактерій. На середовищі Чапека на п’яту – сьому добу враховують колонії актиноміцетів, на сусло-агарі на п’яту – сьому добу – колонії грибів і дріжджів. Кількості колоній на чашці вираховують звичайно з дна чашки, на просвіт. На місці підрахованої колонії маркером ставиться крапка. Обчисливши кількість колоній на всіх паралельних чашках, підраховують їх середнє число на одній чашці і потім перераховують для визначення вмісту мікроорганізмів у 1 г ґрунту за формулою
де а – кількість клітин у 1 г ґрунту; б – середня кількість колоній на чашці; в – кратність розведення, з якого зроблений посів; г – кількість крапель у 1 см3 суспензії. Результати опрацьовують статистично, розраховують: помилку середнього арифметичного, середнє квадратичне відхилення, коефіцієнт варіації. Завдання на виконання 1. Визначити загальну кількість число мезофільних аеробних та факультативно анаеробних мікроорганізмів (МАФАМ) та індекс бактерій групи кишкової палички (БГКП) у воді (теоретично). 2. Провести аналіз мікрофлори повітря седиментаційним методом на МПА та сусло-агар (теоретично). 3. Провести аналіз мікрофлори ґрунту, визначити число МАФАМ та індекс БГКП шляхом висіву розведень ґрунтової суспензії на чашки із м’ясо-пептонним агаром (МПА) та середовищем Ендо методом Коха. 4. Провести експрес-аналіз якісного складу мікрофлори ґрунту за методом Виноградського. ЛАБОРАТОРНА РОБОТА 2 Оцінка результатів санітарно-мікробіологічного контролю об’єктів, які контактують з плодово-овочевою сировиною. Практичне значення і методи визначення чутливості мікроорганізмів до антимікробних речовин Мета роботи: провести оцінювання результатів санітарно-мікробіологічного контролю об’єктів, які контактують з плодово-овочевою сировиною; опанувати методи визначення чутливості мікроорганізмів до антимікробних речовин. Матеріали та обладнання: мікроскопи; предметні та покривні скельця; крапельниці з дистильованою водою; набір барвників, змиті з пробірок тест-культури мікроорганізмів: Sarcina flava, Escherichia coli, Bacillus subtilis, Bacillus mesentericus, Erwinia aroidea, Candida valida, Rhodotorula glutinis, Rhizopus nigricans, Aspergillus niger, Penicillium chryzogenum, Fusarium culmorum (по 1 пробірці), зубок часнику, невелика цибулина, набір скляних циліндрів у розчині спирту. Крім цього, на кожну бригаду: 2 чашки Петрі з МПА та сусло-агаром, стерильні ступка і товкачик, 2 стерильні піпетки, пінцет, шпатель Дригальського, набір антибіотиків, нанесених на паперові диски, робочі розчини дезінфікуючих речовин. Загальні відомості Антисептики Хімічні речовини, що згубно діють на мікроорганізми, називаються антисептиками. Дія антисептиків на мікроорганізми залежить від хімічної структури речовини, його концентрації, тривалості контакту з клітиною (експозиції), а також від чутливості мікроорганізмів до даної речовини. У значній мірі активність антисептиків визначається і складом середовища, у якій знаходяться мікроорганізми.
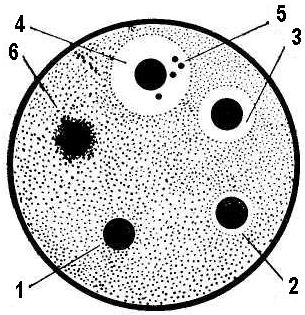
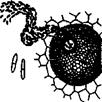
Більшість антисептиків належить до групи загальноцитоплазматичних отрут, тобто отрут, що діють не тільки на мікроби, але і на будь-яку тваринну і рослинну клітину. Тому їхнє застосування для консервування харчових продуктів вкрай обмежено, а речовини, що дозволяється використовувати як консерванти, використовуються в малих дозах (від тисячних до десятих часток відсотка) і тільки для деяких видів продуктів. Антибіотики Багато мікроорганізмів у процесі життєдіяльності виробляють біологічно активні речовини, що згубні для мікробів-антагоністів. Ці речовини одержали назву антибіотиків. Від інших антимікробних речовин вони відрізняються вибірковістю дії, тобто пригнічують життєдіяльність і знищують певні антагоністичні види мікроорганізмів. Завдання на виконання 1. Дослідження антибактеріальної дії антибіотиків. Чашку Петрі з застиглим МПА перевернути нагору дном і позначити на ньому номери дисків з антибіотиками (за кількістю виданих зразків). У лабораторний зошит занести назви антибіотиків і відповідні їм номери. Потім покласти чашку на стіл кришкою нагору. Дотримуючись правил стерильності, нанести піпеткою на поверхню пластинки агару краплю суспензії бактерій (мікрококи, сарцини чи інші види сапрофітів) ретельно розтерти її по всій поверхні середовища за допомогою стерильного шпателя. Обпаленим пінцетом нанести на поверхню агару диски, просочені антибіотиком (пеніциліном, стрептоміцином, левоміцетином, біоміцином тощо). Диски розташувати по окружності чашки так, як показано на рис. 2. Чашки помістити у термостат при температурі 37°С.
Рис. 4. Визначення антимікробної дії антибіотиків методом паперових дисків: 1 – культура стійка до дії антибіотика на даному диску; 2, 3, 4 – культура чутлива до антибіотика; 5 – колонії стійких особин даного штаму; 6 – колонії антибіотикозалежних клітин 2. Визначення впливу фітонцидів цибулі та часнику на плісняві гриби (або бактерії). У стерильній фарфоровій ступці розтовкти стерильним товкачиком невелику ріпчасту цибулину або зубчик часнику після зняття з них сухих лушпайок. На поверхню застиглого сусло-агара (СА) чашки Петрі зробити суцільний посів спор досліджуваного гриба. Для цього відібрати стерильною піпеткою 0,2 см3 суспензії спор гриба, нанести її на поверхню агару, розподілити ретельно й рівномірно по всій поверхні СА стерильним шпателем Дригальського. Після цього у чашку в центр засіяної пластинки СА помістити невелику кількість (біля 1 г) подрібнених у ступці цибулі або часнику. При проведенні визначення впливу фітонцидів цибулі або часнику на бактерії дослід проводиться так само, але береться інше поживне середовище – МПА. Чашки помістити в термостат з температурою 25 °С. 3. Дослідження ефективності дезінфікуючої дії антимікробних засобів.
Чашку Петрі з застиглим МПА чи СА перевернути нагору дном і позначити на ньому номери дезінфікуючих засобів (за кількістю виданих розчинів). У лабораторний зошит занести назви дезінфікуючих засобів і відповідні їм номери. Потім покласти чашку на стіл кришкою нагору. Дотримуючись правил стерильності, нанести піпеткою на поверхню агару краплю суспензії бактерій, у разі використання МПА чи дріжджів при використанні СА, ретельно розподілити її по всій поверхні середовища за допомогою стерильного шпателя, потім за допомогою пінцета встановити на поверхню пластинки агару циліндри (перед встановленням циліндрів спалюють рештки спирту в якому вони зберігаються), далі піпеткою вносять краплю робочого розчину відповідного деззасобу в кожен з циліндрів. Циліндри розташовують по окружності чашки Петрі за ти самим принципом, що і паперові диски (рис. 2). Чашки помістити у термостат при температурі 37°С. Чашки з посівами при виконанні завдань даної лабораторної роботи вміщуючи в термостат не потрібно перевертати. Послідовність проведення досліду записати.
ЛАБОРАТОРНА РОБОТА 3
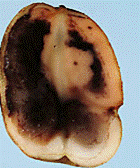
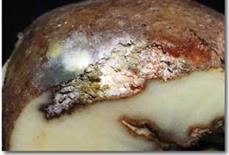
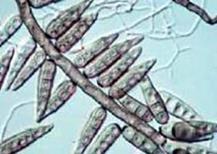
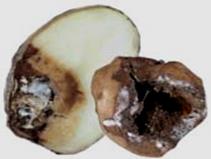
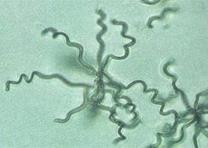
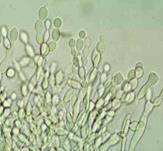
Загальні відомості Свіжі плоди й овочі відіграють дуже важливу роль у харчуванні людини, вони містять різноманітні корисні речовини: легкозасвоювані цукри, органічні кислоти, мінеральні солі, вітаміни й багато інших, що сприяють кращому засвоєнню їжі. В усіх випадках споживання плодів, ягід, овочів і картоплі для харчових цілей, а також при відгодівлі овочами тварин або використанні плодів і овочів як сировини для промисловості варто пам’ятати про їх мікрофлору. Від її складу і чисельності істотно залежать процеси переробки і збереження продукції. Мікроорганізми можуть бути причиною псування продукту або, навпаки, сприяти його тривалому збереженню. Свіжа рослинна сировина до миття містить у 1 г, у середньому, від 100 до 500 тисяч мікроорганізмів. Лежала погана сировина містить у 1 г десятки мільйонів мікроорганізмів, причому, надзвичайно зростає число гнилісних бактерій. Миття сировини у ваннах лише у 2 – 5 разів зменшує кількість мікроорганізмів. Таке ж миття, але з послідуючим ополіскуванням під сильним душем, зменшує кількість мікроорганізмів більше, як у 10 разів. Для встановлення кращого режиму миття потрібно на початку сезону переробки провести мікробіологічні дослідження по ступенях забрудненості партій сировини до і після миття. Протягом сезону переробки контроль миття сировини проводиться 2 – 3 рази на місяць. Режим миття повинен різнитися залежно від ступеня забрудненості сировини. Забруднену сировину слід більш ретельно мити. Відбір та підготовка проб сировини для мікробіологічного дослідження проводиться таким чином: проби огірків, моркви, буряка беруть з різних місць партії по декілька штук стерильним пінцетом та складають у закриту стерильну банку. Проби капусти вирізають стерильним свердлом для пробок або скальпелем з таким розрахунком, щоб було захоплене зовнішнє й внутрішнє листя. Проби відбирають безпосередньо перед миттям та зразу ж після нього, дослідження їх проводиться шляхом висіву матеріалу на поживні середовища для обліку різних груп мікроорганізмів. Плоди та овочі піддаються багатьом мікробним захворюванням, які виникають під час їх дозрівання (їх вивчає фітопатологія) і які можуть виявитися в різні періоди зберігання. При зберіганні плодоовочевої сировини для запобігання значного ураження фітопатогенними збудниками проводять періодично сортування, огляд (для виявлення уражених одиниць), фітопатологічне обстеження. Першим етапом фітопатологічного обстеження плодів та овочів є візуальний огляд зовнішніх поверхонь. Найпоширеніші зовнішні ознаки захворювань – плямистість, гнилизна, наліт, нарости, утворення виразок. Плямистість – відмирання окремих ділянок тканин. Вони розрізняються за формою, забарвленням й консистенціїєю (чорна плямистість моркви, фітофтороз картоплі, фомоз капусти). Сух а й мокра гнилизна – один з основних типів уражень картоплі й овочів грибами й бактеріями. Наприклад, суха гнилизна в картоплі виражається в тому, що бульба зберігає форму, але підсихає, зморщується й часто покривається подушечками грибниці різних відтінків. Мокру гнилизну картоплі спричинюють бактерії. При цьому бульби розм'якшуються, ослизнюються, перетворюються на мокру масу, що пахне. Нальоти розвиваються на поверхні уражених плодів і овочів і складаються із грибниці й спор грибів, що розрізняються за забарвленням: білі, бурі, сірі, жовті, чорні, червоні й ін. Нальоти можуть бути пишними й щільними. Наприклад, біла гнилизна моркви має пишний ватоподібний наліт. Нарости – це розростання плодів і овочів за рахунок збільшення об’єму або числа уражених клітин. Типовий приклад – рак картоплі. Виразки. На поверхні плодів і овочів утворюються поглиблення або скоринки з нерівними краями, іноді утримуючі органи спороносіння грибів. Хвороби з виразками на поверхні тканин називають паршою. Наприклад, звичайна або горбкувата парша картоплі. Другим етапом фітопатологічного обстеження є огляд поздовжнього зрізу обстежуваної сировини. При зрізі плодів і овочів у поздовжньому напрямку теж можна спостерігати характерні ознаки захворювань. Наприклад, на зрізі бульби картоплі при враженні фітофторою утворюються побурілі ділянки тканини, що згнила, у вигляді зубчиків на границі із здоровою тканиною. При ураженні картоплі корінебактеріями утворюється судинне кільце, на зрізі воно має темне забарвлення. Третім етапом фітопатологічного обстеження є визначення збудника захворювання. Бактерії виявляють на фіксованих і пофарбованих препаратах. Для цього готують препарати: а) препарат-відбиток на предметне скло з ураженої ділянки плода; далі його висушують, фіксують і забарвлюють; б) бактеріальною петлею переносять матеріал з ураженої ділянки в краплю води на предметному склі, розмазують по склу, сушать, фіксують і зафарбовують фуксином. Розглядають обидва препарати з імерсійною олією з об'єктивом 90. Замалювати. Гриби визначають за органами спороносіння в препараті "роздавлена крапля". Для цього препарувальною голкою частину грибниці переносять на предметне скло в краплю суміші спирту із гліцерином. Накривають покривним склом і розглядають із об'єктивом 40. Замалювати. Щоб точніше визначити рід гриба за органами спороносіння, роблять посів з метою одержання фіксованих препаратів. Картопля На поверхні бульби сухі плями: а) плями нерівні, сірі, втиснені з поглибленнями; уражена тканина на розрізі бура, тверда, поширюється від поверхні в глибину "язиками". Фітофтора (Phytophtora infestans) – рис.6; б) плями сухі, втиснені, зі складчастістю; на поверхні світлі подушечки із спороносіння гриба (білі, темні, рожеві); спори серповидні з 1–5 перегородками. Фузаріозна суха гнилизна (Fusarium solani) – рис. 7; в) плями спочатку малопомітні світло-коричневі в основному біля вічок. Руйнується тільки верхній шар, набуваючи сріблястого кольору. Захворювання проявляється в лютому – березні (Helminthosporium solani) – рис. 8; На поверхні бульби мокрі плями: а) плями круглі, великі, окремі або зливаються; тканини, що розклалися, бурі, при натисканні виділяється бурувата рідина; у сухих умовах тканина зсихається, у тканинах хламідоспори гриба. Мокра грибна гнилизна (Fusarium оxysporum) – рис. 9; б) плями мокрі, охоплюють всі тканини бульби, мають вигляд кашкоподібної маси з неприємним запахом; на межі хворої й здорової тканини – темна облямівка. Мокра бактеріальна гнилизна (Pseudomonas xanthochlora); в) уражена тканина розріджується й перетворюється на сіру кашкоподібну масу (Erwinia carotovora) рис. 17.
а б в г Рис. 6. Phytophtora infestans (а-мікрофотографія, б-розріз ураженої картоплини, в і г - уражені відповідно томати та баклажани)
а б Рис. 6. Fusarium solani (а-мікрофотографія, б-уражена картопля)
а б Рис. 8. Helminthosporium solani (а-мікрофотографія, б-уражена картоплина, вигляд зовні)
а б Рис. 9. Fusarium оxysporum (а-мікрофотографія, б-розріз ураженої картоплини) На поверхні бульби струпи: а) струпи плоскі, опуклі або ввігнуті, спочатку жовтуваті, потім – темно-коричневі. Звичайна парша (Streptomyces scabiens) – рис. 10; б) на шкірці білі або чорні горбки у вигляді шматочків ґрунту, легко зішкрібуються й складаються з міцелію гриба. Чорна парша (Rhizoctonia solani) без конідій – рис. 11. Поверхня бульби не ушкоджена, але відзначається кільцевий прояв: а) на розрізі бульби, у кільці судинних пучків – переривчасте або суцільне, широке, сухе руйнування бурого кольру; спори серпоподібно вигнуті з 3 – 4 перегородками. Грибна кільцева гнилизна (Fusarium oxysporum) – рис. 9; б) на розрізі бульби судинні пучки розм'якшені, у них міститься жовтувато-білуватого кольору рідина, що при натисненні виступає краплями. Бактеріальна кільцева гнилизна (Corynebacterium sepedonicum).
а б Puc. 10. Streptomyces scabiens (а-мікрофотографія, б-розріз ураженої картоплини)
а б в Puc. 11. Rhizoctonia solani (а-мікрофотографія, б-уражена капустина, в- уражена картоплина, зовні) Морква Суха гнилизна: а) на поверхні коренеплоду видно сірі, втиснені плями, тканина під ними бура, суха, порохнява, часто з порожнечами, які вистелені білим нальотом міцелію; наприкінці зберігання утворюються темні плями. Фомоз (Phoma rostrup) – рис. 12; б) плями темні втиснені, з нальотом; захворювання проявляється у верхній і боковій частинах коренеплоду; уражена тканина чорна, відділена від здорової; у нальоті темнозабарвлені конідії з поперечними й поздовжніми перегородками. Чорна суха гнилизна (Alternaria radacina) – рис. 13.
а б Puc. 12. Phoma rostrup (а-мікрофотографія ураженої тканини, б-уражена морквина, зовнішній вигляд)
а б в Puc. 13. Alternaria radacina (а-мікрофотографія, б-уражені коренеплоди моркви, в-уражений апельсин, зовнішній вигляд)
Гнилизна мокра з нальотом: а) наліт білий, пластівчастий з міцелію гриба (без спороносіння); великі білі або чорні склероції, м'якоть мокра без зміни забарвлення. Біла гнилизна (Sclerotinia sclerotiorum) без конідій – рис. 14; б) наліт сірий пухнатий, із дрібними чорними склероціями; уражена тканина мокра, буруватого кольору; наліт містить довгі розгалужені конідієносці з овальними, безбарвними конідіями. Сіра гнилизна (Botrytis cinеrеa) – рис. 15; в) наліт темно-сірий, пухнатий із чорними голівками, уражена тканина не змінює кольору, мокра, спори овальні, безбарвні. Сіра цвіль (Rhizopus nigricans) – рис. 16.
г)на ураженій тканині нальоту немає; тканина має вигляд слизової маси, що містить бактерії. Мокра бактеріальна гнилизна (Erwinia carotovora) – рис.17.
а б в Рис. 14. Біла гнилизна моркви (а), полуниці (б) та капусти (в)– ураження грибом Sclerotinia sclerotiorum
а б в Рис. 15 Botrytis cinеrеa (а-мікрофотографія, б та в-уражені ягоди відповідно суниці та винограду зовнішній вигляд)
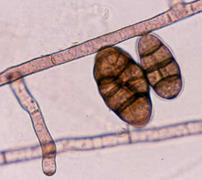
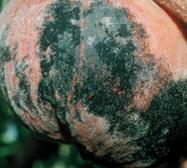
а б в г Рис. 16. Rhizopus nigricans (а-мікрофотографія, уражені б-персик, в-суниця, г-сливи )
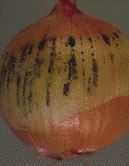
а б в г Рис. 17. Erwinia carotovora (а-мікрофотографія, уражені б-цибуля, в-перець, г-капуста )
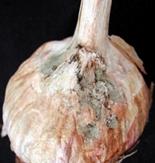
Цибуля й часник
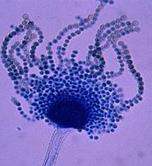
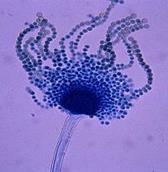
Гнилизна денця, уражена поверхня з нальотом: а) на дінці біла грибниця, коріння цибулини згнивають, на розрізі тканини водянисті, м'які, наліт складається з міцелію й серпоподібних спор з перегородками. Гнилизна денця (Fusarium oxysporum) – рис. 9; б) наліт сірий, пухнатий, частіше на внутрішніх лусочках і боковій частині цибулини; тканини шийки розм'якшуються, на розрізі вони жовтувато-рожеві, водянисті, наліт складається з безбарвних овальних спор, зібраних у голівки на розгалужених конідієносцях. Шийкова (сіра) гнилизна (Botrytis allii). в) наліт чорний, цвілеподібний, плями погано виражені; конідії чорні, округлі, бородавчасті; при зберіганні вся цибулина перетворюється на чорну порошисту масу. Чорна цвіль (Aspergillus niger) – рис. 18; г) наліт зелений, цвілеподібний; конідієносці з розгалуженими верхівками, що несуть ланцюжки округлих, дрібних, безбарвних конідій. Зелена цвіль (Penicillium) – рис. 19. уражена тканина без нальоту: а) ослизнення на лусочках цибулини – жовтувата або рожева гнилизна, цибулина неприємно пахне. Мокра бактеріальна гнилизна (Erwinia carotovora) – рис.17. б) мокрі плями, уражені всі тканини, мають вигляд кашкоподібної маси з неприємним запахом; на межі хворої й здорової тканини – темна облямівка. Мокра бактеріальна гнилизна (Pseudomonas xanthochlora) рис.20
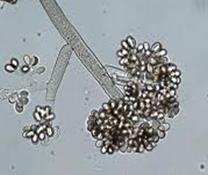
а б в г Рис.19. Зелена цвіль (а-мікрофотографія, уражені Penicillium б-часник, в-лимон,г-яблуко)
а б в г Puc. 18. Aspergillus niger (а-мікрофотографія, уражені б-цибулина, в-суниця, г-яблуко )
а б в Рис.20. Мокра гнилизна Pseudomonas xanthochlora, уражені картопля (а), часник (б) та томат.
Капуста На гниючих качанах наліт грибниці: а) наліт сірий, пухнатий зі спор і міцелію, склероції дрібні (0,1 – 0,7 см), чорні; на розгалужених конідієносцях дрібні овальні конідії. Сіра гнилизна (Botrytis cinerea) – рис. 15; б) наліт темно-сірий з темними голівками (спорангії), спори На гниючих кінчиках нальоту немає, качан ослизняється, неприємно пахне; в ураженій тканині маса бактерій. Слизовий бактеріоз (Erwinia carotovora) – рис.17. Уражений качан або хвороба починається з нього: суха гнилизна качана, уражена тканина порохнява, іноді качани порожні, на поверхні листів бурі або сіруваті плями з пікнидами у вигляді чорних крапок, спори виходять із пікнид вузькою стрічкою. Фомоз (Phoma) – рис. 12. Огірки та перці На плодах плями: а) плями різної величини, втиснені, із чорно-маслиновим бархатистим нальотом; спори яйцеподібні, темнозабарвлені або двоклітинні. Маслинова плямистість (Cladosporium cucumerinum) – рис. 21;
а б Puc.21. Cladosporium cucumerinum (а-мікрофотографія, б-уражені огірки)
а б в Puc. 22. Colletotrichum lagenarium (а-мікрофотографія, б і в-уражені відповідно гарбуз та огірок)
б) плями жовті, подовжені, втиснені з рожево-жовтими подушечками, спори яйцеподібні, одноклітинні, безбарвні. Антракноз (Colletotrichum lagenarium) – рис. 22; в) на ураженій тканині білий пластівчастий наліт з міцелію, спороносіння відсутнє; на міцелії - чорні великі склероції. Біла гнилизна (Sclerotinia sclerotiorum) – рис. 14; г) наліт сірий, пухнатий, із чорними дрібними склероціями, спори овальні, одноклітинні, безбарвні. Сіра гнилизна (Botrytis cinеrеa) – рис. 15. Помідори На плодах плями: а) плями розпливчасті, бурі, з білим нальотом гриба, спори округлі, безбарвні. Фітофтороз (Phytophtora infestans) – рис. 6;
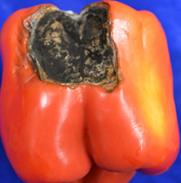
б) плями округлі, втиснені, із чорним нальотом, спори темні з довгим придатком, поперечними й поздовжніми перегородками. Макроспоріоз (Alternaria solani) – рис. 23; в) ураження починається в місцях прикріплення плода до плодоніжки. Поступово поверхня плода стає чорною. Чорна гнилизна, або диплодінос (Diplodina destructive) – рис. 24.
а б в Puc. 23. Alternaria solani (а-мікрофотографія, б-ураженй плід перцю, в-уражена гілка томатів)
а б в Pис. 24. Diplodina destructive (а-мікрофотографія, б-розвиток міцелію, в-ураженй уражений кущ перцю)
Яблука й груші На поверхні плодів: а) бурі плями концентричними колами. М'якоть бурувато-коричнева (Monilia fructigena) – рис. 25; б) бурі плями із дрібними чорними горбками, розташовані колами (Sphaеropsis malorum) – рис. 26;
а б в г Puc. 25. Monilia fructigena (а-мікрофотографія, б-уражені ягоди черешні, в,г-уражені груша та яблука)
а б в
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 175; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.246.203 (0.167 с.) |