
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розподіл Больцмана. Барометрична формула
Это распределение по энергиям частиц (атомов, молекул) идеального газа в условиях термодинамического равновесия Барометрическая формула — зависимость давления или плотности газа от высоты в поле силы тяжести. Для идеального газа, имеющего постоянную температуру
где
где
55.Дифузія у газах. Процес стаціонарної дифузії. Коефіцієнт дифузії. Закони Фіка.
Дифузією називається явище взаємопроникнення двох або кількох речовин, які дотикаються одна до одної. Дифузія виникає в газі, якщо газ неоднорідний за складом, тобто якщо він складається з двох або кількох різних компонент, концентрація яких змінюється від точки до точки. Процес дифузії полягає у тому, що кожна з компонент суміші переходить із тих частин об’єму газу, де його концентрація більша, туди, де вона менша, тобто в напрямі падіння концентрації.
Стаціонарна дифузія відбувається у газовій системі, коли якимось штучним шляхом різниця концентрацій компонент суміші підтримується незмінною. Для цього потрібно, наприклад, в одну частину посудини неперервно добавляти таку компоненту, а з другої частини посудини відбирати її в такій самій кількості. Найчастіше доводиться мати справу з нестаціонарною дифузією.
Перший закон Фіка В системі з градієнтом концентрації речовини dC/dx в напрямку х дифузійний потік J визначається першим законом Фіка:
де D — коефіцієнт дифузії (знак «-» вказує на напрямок потоку від більших концентрацій до менших).
У разі градієнту концентрації не лише в напрямку х, треба використовувати загальнішу формулу:
де Другий закон Фіка В системі з градієнтом концентрацій речовини dC/dx в напрямку х швидкість зміни концентрації речовини в даній точці, зумовлена дифузією, визначається другим законом Фіка:
де t — час.
56.Процес стаціонарної теплопровідності. Коефіцієнт теплопровідності. Закон Фур’є.
Зако́н Фур'є́ — напівемпіричний закон теплопровідності, який стверджує, що тепловий потік пропорційний градієнту температури
де Коефіцієнт пропорційності
57.Процес нестаціонарної теплопровідності. Коефіцієнт температуропровідності.
Реальні гази Між молекулами реального газу, на відміну від ідеального, існує взаємодія. Тиск реального газу менший за тиск ідеального. Молекули реального газу мають розмір, тому його об’єм більший за об’єм ідеального. PідVід=RT Pp=Pід-∆P Vр=Vід+∆V’ (Pр+∆P)(V-∆V’)=RT Атоми або молекули реального газу можуть наблизитися на відстань 2r або d, де r – радіус молекули, d – її діаметр. Заборонений об’єм навколо атома або молекули: Vз= 4/3•π(2r)3=4/3•πr3=8Vмолекули Vз 1молекули=4Vмолекули b – заборонений об’єм b=4NАVмолекули (P+a/V2М)(VМ-b)=RT – рівняння стану ідеального газу одного моля речовини (P+ν2a/V2М)(VМ-νb)=νRT – рівняння стану довільної кількості ідеального газу
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 87; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.38.117 (0.017 с.) |
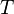 и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения
и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения 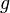 одинаково), барометрическая формула имеет следующий вид:
одинаково), барометрическая формула имеет следующий вид: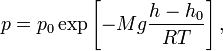
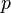 — давление газа в слое, расположенном на высоте
— давление газа в слое, расположенном на высоте 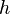 ,
,  — давление на нулевом уровне (
— давление на нулевом уровне (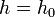 ),
), 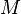 — молярная масса газа,
— молярная масса газа, 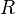 — универсальная газовая постоянная,
— универсальная газовая постоянная, 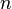 (или плотность газа) убывает с высотой по тому же закону:
(или плотность газа) убывает с высотой по тому же закону: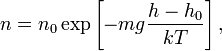
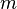 — масса молекулы газа,
— масса молекулы газа, 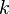 — постоянная Больцмана
— постоянная Больцмана - барометрична формула.
- барометрична формула. 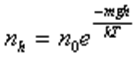 - розподіл Больцмана.
- розподіл Больцмана. ,
,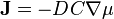 ,
,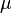 — хімічний потенціал.
— хімічний потенціал.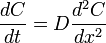 ,
,
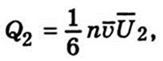




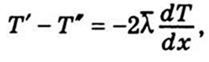


 ,
, — тепловий потік, T — температура,
— тепловий потік, T — температура,  — оператор Гамільтона.
— оператор Гамільтона.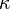 називається коефіцієнтом теплопровідності. Він вважається незалежним від температури принаймні для малих градієнтів.
називається коефіцієнтом теплопровідності. Він вважається незалежним від температури принаймні для малих градієнтів.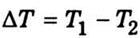
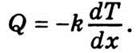
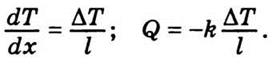



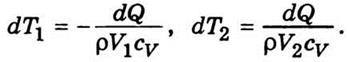
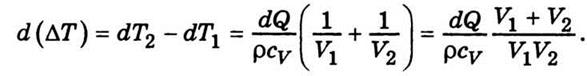
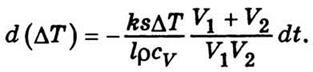
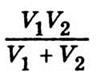
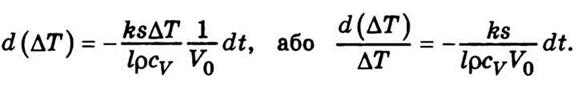

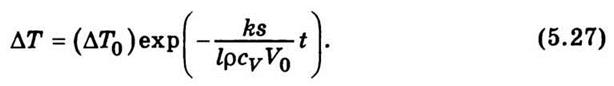


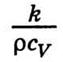
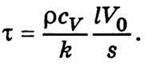 - Температуропрові́дність (коефіціє́нт температуропрові́дності) — фізична величина, що характеризує швидкість зміни (вирівнювання) температури речовини у нерівноважних теплових процесах. Чисельно дорівнює частці від ділення коефіцієнта теплопровідності тіла на добуток його питомої теплоємності та густини, в системі СІ вимірюється в м²/с.
- Температуропрові́дність (коефіціє́нт температуропрові́дності) — фізична величина, що характеризує швидкість зміни (вирівнювання) температури речовини у нерівноважних теплових процесах. Чисельно дорівнює частці від ділення коефіцієнта теплопровідності тіла на добуток його питомої теплоємності та густини, в системі СІ вимірюється в м²/с. 58. Сила внутрішнього тертя в рідині або газі може бути визначена, так само як і в механіці, на рівняння Ньютона
58. Сила внутрішнього тертя в рідині або газі може бути визначена, так само як і в механіці, на рівняння Ньютона
 який сприяє прискоренню нового «місця проживання» молекули. Якщо ж молекула з шару з характерною швидкістю v2 потрапляє в шар зі швидкістю v1, то відбувається гальмування шару. Природно, що одна молекула, що снують з шару в шар, значного внеску у розподілі швидкості між шарами не зробить, але з урахуванням величезного числа одночасно беруть участь у процесі молекул, описувані ефекти можуть бути зафіксовані на макрорівні.
який сприяє прискоренню нового «місця проживання» молекули. Якщо ж молекула з шару з характерною швидкістю v2 потрапляє в шар зі швидкістю v1, то відбувається гальмування шару. Природно, що одна молекула, що снують з шару в шар, значного внеску у розподілі швидкості між шарами не зробить, але з урахуванням величезного числа одночасно беруть участь у процесі молекул, описувані ефекти можуть бути зафіксовані на макрорівні. де
де 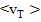 - середнє значення швидкості теплового руху молекул. Перенесення імпульсу зліва направо, в позитивному напрямку осі, представиться аналогічно
- середнє значення швидкості теплового руху молекул. Перенесення імпульсу зліва направо, в позитивному напрямку осі, представиться аналогічно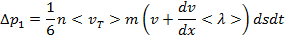 Сумарна зміна імпульсу визначиться у вигляді різниці
Сумарна зміна імпульсу визначиться у вигляді різниці Для з'ясування молекулярного сенсу коефіцієнта внутрішнього тертя, порівняємо рівняння (3.49) з законом Ньютона (3.45)після очевидних скорочень, отримаємо
Для з'ясування молекулярного сенсу коефіцієнта внутрішнього тертя, порівняємо рівняння (3.49) з законом Ньютона (3.45)після очевидних скорочень, отримаємо Підставами значення довжини вільного пробігу молекул з рівняння (3.31)
Підставами значення довжини вільного пробігу молекул з рівняння (3.31)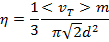 Слід звернути увагу, що коефіцієнт внутрішнього тертя не залежить від концентрації молекул в даному обсязі, тобто величина η не залежить від тиску і щільності газу. Однак це твердження втрачає сенс для сильно розріджених газів, тому що для них характерно перевищення довжини вільного пробігу розмірів посудини.
Слід звернути увагу, що коефіцієнт внутрішнього тертя не залежить від концентрації молекул в даному обсязі, тобто величина η не залежить від тиску і щільності газу. Однак це твердження втрачає сенс для сильно розріджених газів, тому що для них характерно перевищення довжини вільного пробігу розмірів посудини.


