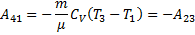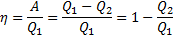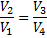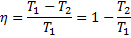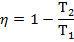Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Якщо на т іло не діють зовнішні сили то імпульс системи зберігається.Стр 1 из 6Следующая ⇒
Миттєва швидкість:
Вектор миттєвої швидкості спрямований по дотичній до траєкторії. 3. Кутова швидкість та кутове прискорення
Кутова швидкість - відношення зміни кута при обертанні до відрізку часу, за який ця зміна відбулася.
Кутове прискорення — похідна від кутової швидкості по часу
4. Криволінійний рух Криволінійний рух - це рух, траєкторія якого представляє собою криву лінію (коло, еліпс, гіперболу, параболу). Швидкість при криволінійному русі змінюється за величиною і за напрямком. Криволінійний рух матеріальної точки вважається рівномірним рухом якщо модуль швидкості постійний (наприклад, рівномірний рух по колу), і рівноприскореним, якщо модуль і напрям швидкості змінюється (наприклад, рух тіла, кинутого під кутом до горизонту). Траєкторія і вектор переміщення при криволінійному русі Криволінійний рух - це завжди прискорений рух. Тобто прискорення при криволінійному русі присутній завжди, навіть якщо модуль швидкості не змінюється, а змінюється тільки напрям швидкості. Зміна величини швидкості за одиницю часу - це Тангенціальне прискорення:
Нормальне прискорення - це зміна швидкості у напрямку за одиницю часу:
Доцентрове прискорення - це нормальне прискорення при рівномірному русі по колу. Повний прискорення при рівнозмінному криволінійному русі тіла дорівнює:
або:
5. Тангенціальне та нормальне прискорення Напрямок прискорення не завжди збігається із напрямком швидкості. Тангенціальне прискорення – складова вектора прискорення, направлена паралельно до вектора швидкості, вздовж дотичної до траєкторії.
6. Принцип інерції Галілея. Перетворення Галілея дозволяють описати фізичне явище в інерційній системі відліку якщо відомо як виглядає дане фізичне явище в іншій інерційній системі відліку.
Перетворення швидкості
Перетворення прискорення
7. Перший закон Ньютона Перший закон Ньютона (закон інерції) формулюється так: будь-яке тіло зберігає свій початковий стан відносного спокою або прямолінійного рівномірного руху, доки зовнішні тіла не виведуть його з цього стану. інерціальної системи відліку — системи, тіло відліку якої знаходиться у спокої або рухається з 8. Другий закон У інерціальних системах відліку прискорення, що купується матеріальною точкою, прямо пропорційно викликає його силі, збігається з нею по напрямку і обернено пропорційно масі матеріальної точки. Зазвичай цей закон записується у вигляді формули:
де Або, в іншому вигляді:
Формулювання другого закону Ньютона з використанням поняття імпульсу: У інерціальних системах відліку похідна імпульсу матеріальної точки по часу дорівнює діючої на неї силі
де При такому формулюванні, як і раніше, вважають, що маса матеріальної точки незмінна в часі.
Рівняння, відповідні даному законом, називаються рівняннями руху матеріальної точки. При незалежному виборі одиниць маси, сили і прискорення вираз другого закону потрібно писати у вигляді
де
9. Третій закон Сили, що виникають при взаємодії двох тіл, є рівними за модулем і протилежними за напрямом. Математично це записується так де 10. Закон всесвітнього тяжіння. Сила тяжіння та вага тіла.
1) Закон всесвітнього тяжіння. Закон всесвітнього тяжіння — фізичний закон, що описує гравітаційну взаємодію в рамках Ньютонівської механіки. У математичній формі закон всесвітнього тяжіння записується для матеріальних точок у вигляді:
де Для абсолютної величини сили:
Ця сила біля поверхні Землі надає тілу прискорення, яке є прискоренням вільного падіння G і дорівнює:
g=9,8 м/с2 F=mg 3) Вага тіла – це сила, з якою тіло внаслідок притягання до Землі, діє на опору або натягує підвіс. Сила тяжіння дорівнює вазі тіла тільки в тому випадку, коли прискорення тіла відносно Землі дорівнює нулю:
У загальному випадку вага тіла, що рухається з прискоренням відносно Землі дорівнює:
Якщо тіло вільно рухається в полі сили тяжіння, то і вага дорівнює нулю, тобто тіло буде невагомим. Невагомість – це стан тіла, при якому тіло рухається тільки під дією сили тяжіння.
11. Закон збереження механічної енергії. Закон збереження механічної енергії: Якщо в замкнутій системі діють тільки сили тяжіння й пружності, то повна механічна енергія системи залишається сталою.
Eк=
h mg v
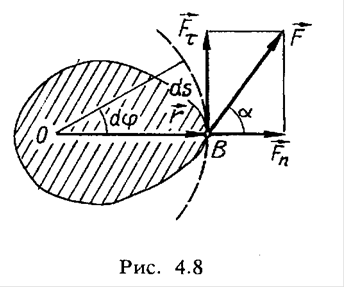
12.Робота сили Робота – це фізична величина, що визначає енергетичні затрати при переміщенні фізичного тіла, чи його деформації.
α
∆Si
13Середня та миттєва потужність. Потужність - робота за одиницю шляху. Nсер= N= N= N=
14.Робота і кінетична енергія. Основна теорема механіки. A=
15Центральні сили. Консервативні сили та потенціальна енергія. Якщо вектор сили в будь-якій точці простору спрямований до однієї і тої ж точки, яка називається силовим центром або центром сили, а модуль сили визначається тільки відстанню до силового центру, такі сили називаються центральними силами. 1)A=
2) A=
3) A=
Якщо сили взаємодії між тілами залежить тільки від координат взаємодіючих сил, а робота по переміщенню тіла з довільної початкової точки в довільну кінцеву точку не залежить від шляху за яким відбувається переміщення, а визначається тільки початковим та кінцевим положенням тіл відносно силового центра, то такі сили називаються консервативними силами. Для системи на яку діють консервативні сили вводиться поняття потенціальна енергія. Потенціальна енергія системи визначається як робота по переведенню системи з будь-якого стану в нульовий стан.
17 Закон збереження імпульсу m, v, p=mv
Нехай система що складаеться з N відносних тіл, mi тіла з vi. В системі діють сили взаємодії. Fi,j=-Fj,I, F dp/dt=
Теорема Гюйгенса-Штейнера Момент інерції твердого тіла відносно довільної осі залежить не тільки від маси, форми і розмірів тіла, але також від положення тіла відносно цієї осі. Згідно з теоремою Штейнера (теоремою Гюйгенса-Штейнера), момент інерції тіла
№24 Кінетична енергія твердого тіла, що обертається. Кінетичну енергію тіла, що обертається легко розрахувати із таких міркувань.Швидкість i-й частинки тіла
25 Робота зовнішніх сил при обертанні твердого тіла. 26 Сили інерції. ІІ закон Ньютона в неінерціальній системі відліку. 27 Постулати Ейнштейна. 25)
26) Сили інерції - сили, які виникають не в результаті взаємодії тіл, а внаслідок прискореного руху системи відліку.
Робота ідеального газу.
У розріджених газів молекули практично не взаємодіють між собою. Вони лише іноді стикаються один з одним. Однак ці зіткнення відбуваються настільки рідко, що більшу частину часу молекули рухаються вільно. Ідеальним називають такий газ, для якого можна знехтувати розмірами молекул та силами молекулярної взаємодії.
pV = b, b – константа пропорціональна масі тіла T Реальні гази поводять себе як ідеальний тоді, коли середня відстань між молекулами у багато разів перевищує їхні розміри, тобто коли розрідження досить велике. Газ може бути в різних станах, тобто деяка маса газу має об’єм V, тиск p і температуру Т. Величини V, p,Т, що характеризують стан газу, називаються термодинамічними параметрами.
Умови, за яких реальні гази можна вважати ідеальними
39Теплота. Внутрішня енергія. Перший принцип термодинаміки.
Внутрiшня енергiя - однозначна функцiя термодинамiчного стану системи, тобто в кожному станi система володiє цiлком певною внутрiшньою енергiєю (вона не залежить вiд того, як система прийшла в даний стан). Це означає, що пiд час переходу системи з одного стану в iнший зміна внутрiшньої енергiї визначається тiльки рiзницею значень внутрiшньої енергiї цих станiв i не залежить вiд шляху переходу. Перший закон термодинамiки: теплота, що надається системi, витрачається на змiну її внутрiшньої енергiї i на здiйснення нею роботи проти зовнiшнiх сил. Q = ∆U + A
або в бiльш коректнiй формi δQ = dU + δA
де dU - нескiнченно мала змiна внутрiшньої енергiї системи δA елементарна робота δQ - нескiнченно мала кiлькiсть теплоти. В цьому виразi dU є повним диференцiалом δA а δQ такими не є. 40. Теплоємність 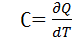 Теплоємність при сталому об’ємі Теплоємність при сталому об’ємі 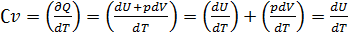 Теплоємність при сталому тиску Теплоємність при сталому тиску 
Співвідношення Маєра
41.Внутрішня енергія ідеального газу: 42.Закон Больцмана: -розподіл однакових частинок, що складають макросистему поліпотенціальних сил -ідеальний газ в полі потенціальній системі
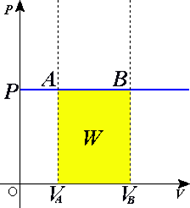
43) Процеси в ідеальному газі 1. P=const При ізобаричному процесі об'єм ідеального газу прямопропорційний температурі (див. Закон Гей-Люссака). На графіках процес зображується лініями, які називаються ізобарами. Для ідеального газу вони є прямими у всіх діаграмах, які пов'язують параметри T (температура), V (об'єм) і P (тиск).
Жовта ділянка відповідає роботі газу. З визначення роботи слідує, що макроскопічна робота при нескінченно малій зміні об'єму на величину dV при ізобаричному процесі дорівнює:
Повна робота процесу визначається інтегралом від даного виразу:
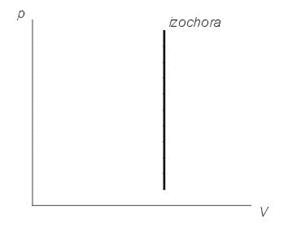
2. V=сonst При ізохоричному процесі тиск ідеального газу прямопропорційний його температурі. Закон Шарля:
На графіках зображується лініями, які називаються ізохорами. Для ідеального газу вони є прямими у всіх діаграмах, які пов'язують параметри T (температура), V (об'єм) і p (тиск). З визначення роботи слідує, що зміна роботи при ізохоричному процесі дорівнює:
Щоб визначити повну роботу процесу проінтегруємо даний вираз. Оскільки об'єм сталий, то:
Але такий інтеграл дорівнює нулю. Отже, при ізохоричному процесі газ роботи не виконує:
3. T=const
Якщо до ізотермічного процесу застосувати рівняння Клапейрона, то з урахуванням сталості температури
або
Робота при ізотермічному процесі:
Таким чином, робота, яка виконується ідеальним газом при ізотермічному процесі, визначається формулою
4. Q=0 (Адіабатичний процес)
При адіабатичному розширенні внутрішня енергіяробочого тіла повинна зменшуватись Роботу, яка виконується газом при адіабатичному процесі, можна знайти декількома способами. У першому способі можна за допомогою рівняння адіабати знайти залежність тиску від об’єму (
або
Підставивши вираз для внутрішньої енергії
Напишемо цю формулу у вигляді
Використаємо рівняння Пуассона для адіабатичного процесу
З рівняння стану випливає, що
Математично адіабатичний процес описується рівнянням
де p — тиск, V — об'єм,
Для адіабатичного процесу теплообмін з навколишнім середовищем відсутній, тобто кількість теплоти
де E — внутрішня енергія системи, а W — робота, що виконується самою системою. Будь-яка робота (W) здійснюється за рахунок витрат внутрішньої енергії E, адже надходження теплоти ззовні немає. Робота W, що виконується системою визначається як
Однак p не залишається константою в адіабатичному процесі, а змінюється разом з V. Бажано знати, як величини
де R — універсальна газова стала. Нехай задані
Тепер підставимо (2) та (3) в рівняння (1) та отримаємо:
спрощуючи,
Розділимо обидві частини на pV,
З диференціального числення відомо, що
що може бути записано як
для визначених констант
Після зведення у ступінь обох частин,
та позбавлення від мінуса,
тоді
та
44) Ентропія ідеального газу У кінцевому оборотному процесі зміни ентропії може бути підраховане по формулі:
1. P=const Оскільки у системі при ізобаричному процесі відбувається теплообмін із зовнішнім середовищем, то відбувається зміна ентропії. З визначення ентропії випливає:
Вище вже було виведено формулу для визначення кількості теплоти. Перепишемо її у диференціальному вигляді:
де ν — кількість речовини,
Або, якщо проінтегруємо останній вираз, повна зміна ентропії після проходження процесу:
У цьому випадку виносити вираз молярної теплоємності при сталому тиску за знак інтегралу не можна, оскільки вона є функцією, яка залежить від температури. 2. V=const Оскільки у системі при ізохоричному процесі відбувається теплообмін із зовнішнім середовищем, то відбувається зміна ентропії. З визначення ентропії випливає:
Вище вже було виведено формулу для визначення кількості теплоти. Перепишемо її у диференціальному вигляді:
де ν — кількість речовини,
Або, якщо проінтегруємо останній вираз, повна зміна ентропії після проходження процесу:
У цьому випадку виносити вираз молярної теплоємності при сталому об'ємі за знак інтегралу не можна, оскільки вона є функцією, яка залежить від температури. 3. T=const T 1 = T 2:
4. Q=0 (Адіабатний) При адіабатному процесі dQ=0, а отже ентропія S=0.
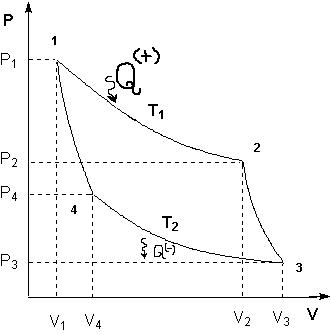
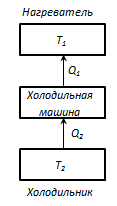
45) Циклічні процеси. Теплова машина. Коефіцієнт корисної дії теплової машини
З формулювання другого початку т/д по Кельвіну випливає, що вічний двигун другого роду неможливий. (Вічний двигун – це періодично діючий двигун, що робить роботу за рахунок охолодження одного джерела теплоти.)
Термостат – це т/д система, яка може обмінюватися теплотою з тілами без зміни температури. Принцип дії теплового двигуна: від термостата з температурою Т 1 - нагрівача, за цикл віднімається кількість теплоти Q 1, а термостату з температурою Т 2 (Т 2 < Т 1) -холодильнику, за цикл передається кількість теплоти Q 2, при цьому відбувається робота А = Q 1 - Q 2
Круговим процесом або циклом називається процес, при якому система, пройшовши через ряд станів, вертається у вихідне. На діаграмі станів цикл зображується замкненою кривою. Цикл, чинений ідеальним газом, можна розбити на процеси розширення (1-2) і стиску (2-1), робота розширення позитивна А 1-2 > 0, тому що V 2 > V 1, робота стиску негативна А 1-2 < 0, тому що V 2 < V 1. Отже, робота чинена газом за цикл, визначається площею, охоплюваної замкненою кривою 1-2-1. Якщо за цикл відбувається позитивна робота зворотний цикл (цикл відбувається в напрямку проти годинникової стрілки). Прямий цикл використовується в теплових двигунах - періодично діючих двигунах, що роблять роботу за рахунок отриманої ззовні теплоти. Зворотний цикл використовується в холодильних машинах - періодично діючих установках, у яких за рахунок роботи зовнішніх сил теплота переноситься до тіла з більш високою температурою. У результаті кругового процесу система вертається у вихідний стан і, отже, повна зміна внутрішньої енергії дорівнює нулю. Тоді I початок т/д для кругового процесу Q = ΔU + A = A, т. т. робота, чинена за цикл дорівнює кількості отриманої ззовні теплоти, але Q = Q 1 - Q 2 Q 1 - кількість теплоти, отримана системою, Q 2 - кількість теплоти, віддана системою. Термічний к.к.д. для кругового процесу дорівнює відношенню роботи, зробленою системою, до кількості теплоти, підведеною до системи:
Щоб η = 1, повинне виконуватися умова Q 2 = 0, тобто тепловий двигун повинен мати одне джерело теплоти Q 1, але це суперечить другому початку т/д. Процес зворотний, що відбувається в тепловому двигуні, використовується в холодильній машині.
Від термостата з температурою Т 2 віднімається кількість теплоти Q 2 і передається термостату з температурою T 1, кількість теплоти Q 1. Q = Q 2 - Q 1 < 0, отже A < 0. Без здійснення роботи не можна відбирати теплоту від менш нагрітого тіла й віддавати її більш нагрітому.
Ґрунтуючись на другому початку т/д, Карно вивів теорему. Теорема Карно: із усіх періодично діючих теплових машин, що мають однакові температури нагрівачів (Т 1) і холодильників (Т 2), найбільшим к.к.д. мають оборотні машини. К.К.Д. оборотних машин при рівних Т 1 і Т 2 рівні й не залежать від природи робочого тіла. Робоче тіло – тіло, що робить круговий процес, що й обмінюються енергією з іншими тілами. Цикл Карно – оборотний найбільш економічний цикл, що полягає з 2-х ізотерм і 2-х адіабат.
2-3 – адіабатичне розширення, газ робить роботу A 2-3>0 над зовнішніми тілами. 3-4-ізотермічний стиск при Т 2 холодильника; відбирається теплота Q 2 і відбувається робота;
4-1-адіабатичний стиск, над газом відбувається робота A4-1<0 зовнішніми тілами. При ізотермічному процесі U = const, тому Q 1 = A 12
При адіабатичному розширенні Q 2-3 = 0, і робота газу A 23 відбувається за рахунок внутрішньої енергії A23 = - U
Кількість теплоти Q 2, віддана газом холодильнику при ізотермічному стиску дорівнює роботі стиску А 3-4
Робота адіабатичного стиску
Робота, чинена в результаті кругового процесу A = A 12 + A 23 + A 34 + A 41 = Q 1 + A 23 - Q 2 - A 23 = Q 1 - Q 2 і дорівнює площі кривій 1-2-3-4-1. Термічний к.к.д. циклу Карно
З рівняння адіабати для процесів 2-3 і 3-4 одержимо
Тоді
т.т. к.к.д. циклу Карно визначається тільки температурами нагрівача й холодильника. Для збільшення к.к.д. потрібно збільшувати різницю Т 1 - Т 2. 46. Цикл Карно. ККД теплової машини, що працює за циклом Карно Цикл Карно – теплова машина, що має 2 теплових резервуари(2 тіла, які підтримують сталу Т), складається з 2 ізотермічних та 2 адіабатичних процесів.
ККД для циклу Карно
47. Принцип Кельвіна. Перша теорема Карно Принцип Кельвіна: не може існувати процес, у якому машина виконує роботу та обмінюється енергією лише з одним тепловим резервуаром. Перша теорема Карно: якщо є теплові машини, які працюють за зворотнім циклом Карно, а температури холодильника і нагрівача однакові та ККД однакові. 48. Друга теорема Карно ККД теплової машини, яка працює за незворотнім циклом Карно, не може бути більше за ККД машини, що працює за зворотнім циклом Карно при умові рівності температур нагрівача і холодильника.
49.Неравенство Клаузиуса Для получения неравенства Клаузиуса в общем виде можно рассмотреть систему A, работающую с n резервуарами температур Ti и получающую от них тепло Qi. Вводится дополнительный Резервуар температуры T0. Между ним и остальными резервуарами запускаются машины Карно — по одной на каждый.
Циклы Карно проводятся таким образом, чтобы передавать резервуарам столько тепла, сколько они передали системе А. Тогда. Это тепло отдаст резурвуар температуры T0, в то время как состояние остальных резервуаров вернётся к исходному. Следовательно, рассмотренный процесс эквивалентен процессу передачи тепла резурвуаром температуры T0 системе A, причём совокупность «система A — резервуар T0» теплоизолирована. Следовательно, по первому началу термодинамики системой A совершена работа. В соответствии с формулировкой Томсона второго начала термодинамики эта работа не может быть положительной. Отсюда очевидно неравенство Клаузиуса в общем виде:
2.Приведенная теплота - отношение теплоты Q в изотермическом процессе к температуре, при которой происходила передача тепллоты Q'=Q/T
50. Термодинамическая энтропия Термодинамическая энтропия S, часто именуемая просто энтропией, — физическая величина, используемая для описания термодинамической систем
|
||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.184.162 (0.315 с.) |
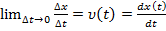


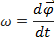
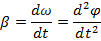
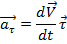 Тангенціальне прискорення в даній точці траєкторії у напрямку збігається з напрямком швидкості руху тіла або протилежно йому.
Тангенціальне прискорення в даній точці траєкторії у напрямку збігається з напрямком швидкості руху тіла або протилежно йому. Нормальне прискорення направлено по радіусу кривизни траєкторії (до осі обертання). Нормальне прискорення перпендикулярно напрямку швидкості.
Нормальне прискорення направлено по радіусу кривизни траєкторії (до осі обертання). Нормальне прискорення перпендикулярно напрямку швидкості.



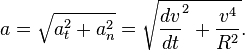
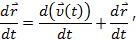

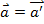
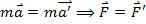
 : існують системи відліку, названі інерціальними, відносно яких тіло, на яке не діють інші тіла чи зовнішні дії взаємно скомпенсовані, знаходиться у стані спокою або рухається без прискорення.
: існують системи відліку, названі інерціальними, відносно яких тіло, на яке не діють інші тіла чи зовнішні дії взаємно скомпенсовані, знаходиться у стані спокою або рухається без прискорення.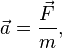
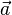 - прискорення тіла,
- прискорення тіла, 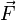 - сила,
- сила, 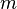 прикладена до тіла, а - маса матеріальної точки.
прикладена до тіла, а - маса матеріальної точки.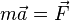

 - імпульс (кількість руху) точки,
- імпульс (кількість руху) точки, 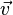 - її швидкість,
- її швидкість, 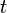 а - час.
а - час.
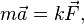
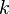 - коефіцієнт пропорційності, значення якого визначається вибором одиниць виміру
- коефіцієнт пропорційності, значення якого визначається вибором одиниць виміру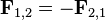
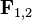 — сила, що діє на перше тіло з боку другого тіла, а
— сила, що діє на перше тіло з боку другого тіла, а  — навпаки, сила, що діє з боку першого тіла на друге тіло.
— навпаки, сила, що діє з боку першого тіла на друге тіло.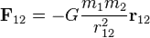
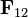 — сила, що діє на друге тіло (матеріальну точку) з боку першого тіла,
— сила, що діє на друге тіло (матеріальну точку) з боку першого тіла, 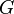 = 6, 67х10-11
= 6, 67х10-11 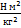 — гравітаційна стала,
— гравітаційна стала, 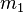 та
та  — маси першого та другого тіла, відповідно,
— маси першого та другого тіла, відповідно, 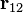 — одиничний вектор, що направлений в напрямку другого тіла від першого.
— одиничний вектор, що направлений в напрямку другого тіла від першого. 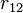 — відстань між тілами.
— відстань між тілами.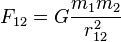 .
.



 , En=mgh
, En=mgh


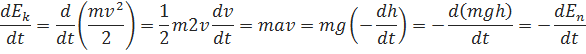
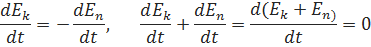
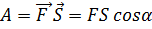

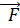
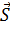
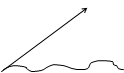

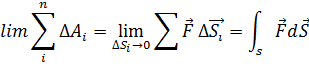



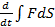 =
=  (FdS)=
(FdS)=  =
= 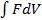

 =
= 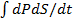 =
= 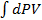 =
= 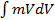 =
= 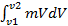 =
= 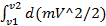 =
= 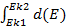 =Ek2-Ek1
=Ek2-Ek1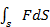 =
=  mg(h2-h1)
mg(h2-h1)
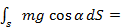
 =mgh= mg(h2-h1)
=mgh= mg(h2-h1)
 mg(h2-h1)
mg(h2-h1)
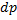 /dt=F (рівнодійна сила), −це сила, що діють з боку всіх інших тіл на данне.
/dt=F (рівнодійна сила), −це сила, що діють з боку всіх інших тіл на данне.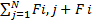
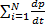 =
= 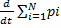 - імпульс системи=
- імпульс системи=  =
= 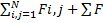
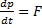 , F=0 dp/dt=0, p=const
, F=0 dp/dt=0, p=const відносно довільної осі дорівнює сумі моменту інерції цього тіла
відносно довільної осі дорівнює сумі моменту інерції цього тіла  відносно осі, що проходить черезцентр маси тіла паралельно до осі, що розглядається, і добутку маси тіла m на квадрат відстані a між осями:
відносно осі, що проходить черезцентр маси тіла паралельно до осі, що розглядається, і добутку маси тіла m на квадрат відстані a між осями: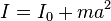
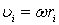 , де
, де 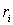 – відстань частинки до осі обертання. Тоді, оскільки кутова швидкість обертання для всіх точок однакова, то кінетична енергія
– відстань частинки до осі обертання. Тоді, оскільки кутова швидкість обертання для всіх точок однакова, то кінетична енергія .
.
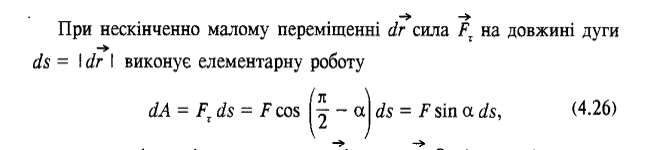










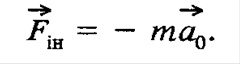
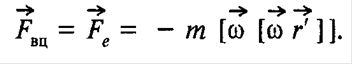




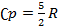
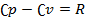
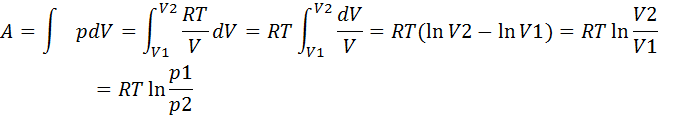


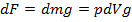
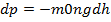
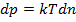
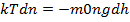
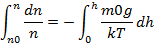

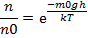

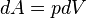
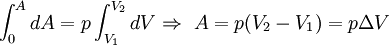
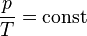 ,
,
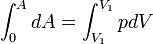 ,
,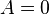 .
.
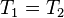 воно набуде вигляду
воно набуде вигляду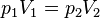
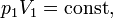
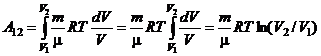 .
.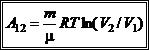
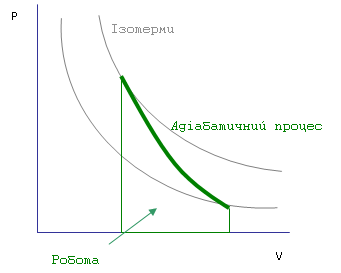
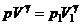 ,
, 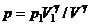 ), підставити цю залежність і знайти шукану роботу
), підставити цю залежність і знайти шукану роботу  . У другому способі використаємо перший закон термодинаміки, візьмемо до уваги, що для адіабатичного процесу
. У другому способі використаємо перший закон термодинаміки, візьмемо до уваги, що для адіабатичного процесу 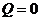 . Тоді
. Тоді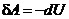
 .
.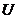 в цю формулу, знаходимо роботу ідеального газу при адіабатичному процесі
в цю формулу, знаходимо роботу ідеального газу при адіабатичному процесі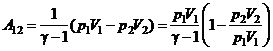 .
. .
.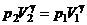 . Тоді остаточно
. Тоді остаточно .
.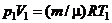 . Зробивши таку заміну, отримаємо ще один вираз для роботи, яка виконується ідеальним газом при адіабатичному процесі:
. Зробивши таку заміну, отримаємо ще один вираз для роботи, яка виконується ідеальним газом при адіабатичному процесі:
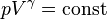
 — показник адіабати,
— показник адіабати,
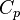 — молярна теплоємність за умов постійного тиску, а
— молярна теплоємність за умов постійного тиску, а 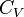 — молярна теплоємність за умов постійного об'єму. Для одноатомного ідеального газу,
— молярна теплоємність за умов постійного об'єму. Для одноатомного ідеального газу, 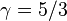 , а для двоатомного (таких як азот або кисень, головних складовихповітря)
, а для двоатомного (таких як азот або кисень, головних складовихповітря) 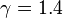 . Ця формула може бути застосована лише для класичних газів.
. Ця формула може бути застосована лише для класичних газів.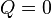 . Тоді, відповідно до першого закону термодинаміки,
. Тоді, відповідно до першого закону термодинаміки,

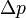 та
та 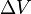 співвідносяться між собою в адіабатичному процесі. Припустимо тепер, що в нас є одноатомний газ, тоді
співвідносяться між собою в адіабатичному процесі. Припустимо тепер, що в нас є одноатомний газ, тоді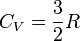
 та
та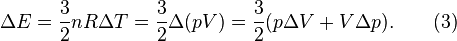


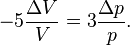
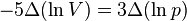
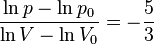
 та
та  первісного стану. Далі
первісного стану. Далі
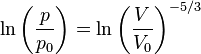
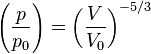
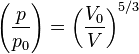
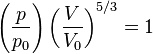

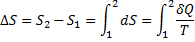
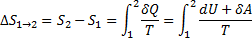



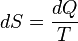
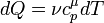 ,
, — молярна теплоємність при сталому тиску. Отже, мікроскопічна зміна ентропії при ізобаричному процесі може бути визначена за формулою:
— молярна теплоємність при сталому тиску. Отже, мікроскопічна зміна ентропії при ізобаричному процесі може бути визначена за формулою:

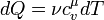 ,
,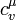 — молярна теплоємність при сталому об'ємі. Отже, мікроскопічна зміна ентропії при ізохоричному процесі може бути визначена за формулою:
— молярна теплоємність при сталому об'ємі. Отже, мікроскопічна зміна ентропії при ізохоричному процесі може бути визначена за формулою:
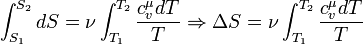


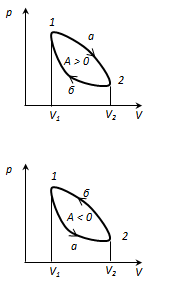
 (цикл за годинниковою стрілкою), то цикл називається прямим, якщо
(цикл за годинниковою стрілкою), то цикл називається прямим, якщо  -
-
 1 - 2-ізотермічне розширення при Т 1 нагрівача; до газу підводить теплота Q 1 і відбувається робота
1 - 2-ізотермічне розширення при Т 1 нагрівача; до газу підводить теплота Q 1 і відбувається робота 
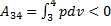 ;
;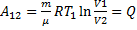 1
1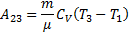
 2
2