
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация и свойства аминокислотСодержание книги
Поиск на нашем сайте
Белки и аминокислоты. Классификация и свойства аминокислот Аминокислоты (син. аминокарбоновые кислоты) — органические (карбоновые) кислоты, содержащие одну или более аминогрупп; основная структурная часть молекулы белков. I. Физико-химическая – основана на различиях в физико-химических свойствах аминокислот. 1) Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы и ароматические кольца. К гидрофобным аминокислотам относятся: глицин, аланин, валин, лейцин, изолейцин, фенилаланин, триптофан, метионин, пролин. 2) Гидрофильные (полярные) незаряженные аминокислоты. Радикалы таких аминокислот содержат в своем составе полярные группировки (-ОН, -SH, -NH2). Эти группы взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них. К полярным незаряженным относятся серин, треонин, тирозин, цистеин, глутамин, аспаргин. 3) Полярные отрицательно заряженные аминокислоты. К ним относятся аспарагиновая и глутаминовая кислоты. 4) Полярные положительно заряженные аминокислоты: аргинин, лизин и гистидин. Имеют дополнительную аминогруппу в радикале. II. Биологическая классификация. 1) Незаменимые аминокислоты не могут синтезироваться в организме человека и должны обязательно поступать с пищей валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин 2) аминокислоты относятся к частично незаменимым аргинин, гистидин. 3) Заменимые аминокислоты могут синтезироваться в организме человека глутаминовая кислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин. Свойства: Строение аминокислот. Все аминокислоты являются α-аминокислотами. Аминогруппа общей части всех аминокислот присоединена к α-углеродному атому. Аминокислоты содержат карбоксильную группу –COOH и аминогруппу -NH2. В белке ионогенные группы общей части аминокислот участвуют в образовании пептидной связи, и все свойства белка определяются только свойствами радикалов аминокислот. Аминокислоты амфотерные соединения. Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. Аминокислоты – это бесцветные кристаллические вещества, плавящиеся при высоких температурах (>250°С). Легко растворимы в воде и нерастворимы в органических растворителях. Имея в своем составе NH2–группу основного характера и COOH– с кислыми свойствами, АК обладают амфотерностью. В водных растворах α-АК в основном существуют в виде биполярных ионов или цвиттер-ионов с диссоциированной COO––группой и протонированной NH3+–группой.
В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в виде смеси их форм.
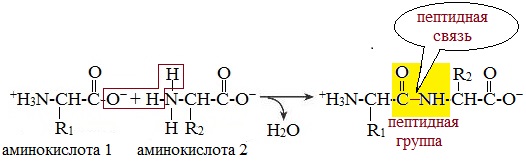
Уровни структуры белка Пептиды – семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными (амидными) связями - С(О)NН-. Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот. Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно.
Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –СО-NH-.
Первичная структура белка - определенная последовательность a-аминокислотных остатков в полипептидной цепи. Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве. Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
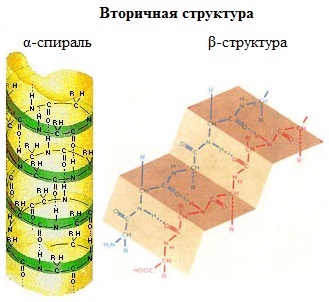
Вторичная структура белка - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль. Существует два основных способа укладки цепи. Одна из моделей вторичной структуры - a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи. В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
Основные особенности α-спирали: · спиральная конфигурация полипептидной цепи, имеющая винтовую симметрию; · образование водородных связей между пептидными группами каждого первого и четвертого аминокислотных остатков; · регулярность витков спирали; · равнозначность всех аминокислотных остатков в α-спирали независимо от строения их боковых радикалов; · боковые радикалы аминокислот не участвуют в образовании α-спирали. В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями. Имеются разновидности β-структур. Ограниченные слоистые участки, образуемые одной полипептидной цепью белка, называют кросс-β-формой (короткая β-структура). Водородные связи в кросс-β-форме образуются между пептидными группами петель полипептидной цепи. Другой тип — полная β-структура — характерен для всей полипептидной цепочки, которая имеет вытянутую форму и удерживается межпептидными водородными связями между смежными параллельными полипептидными цепями (рис. 3). Эта структура напоминает меха аккордеона. Причем возможны варианты β-структур: они могут быть образованы параллельными цепями (N-концы полипептидных цепей направлены в одну и ту же сторону) и антипараллельными (N-концы направлены в разные стороны). Боковые радикалы одного слоя помещаются между боковыми радикалами другого слоя. Во многих белках одновременно имеются α-спиральные участки и β-структуры. Природных белков, состоящих на 100% из α-спирали, почти не бывает (исключение составляет парамиозин — мышечный белок, на 96-100% представляющий собой α-спираль), тогда как у синтетических полипептидов 100%-ная спирализация. Другие белки имеют неодинаковую степень спирализации. Высокая частота α-спиральных структур наблюдается у парамиозина, миоглобина, гемоглобина. Напротив, у трипсина, рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые β-структуры. Белки опорных тканей: кератин (белок волос, шерсти), коллаген (белок сухожилий, кожи), фиброин (белок натурального шелка) имеют β-конфигурацию полипептидных цепей.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий. Третичная структура – это трехмерная пространственная конфигурация закрученной α-спирали или β-структуры в пространстве. Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена). Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них — α-спираль; напротив, в глобулярных белках может быть большое количество β-структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь. Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот. Эти связи можно разделить на: · сильные (ковалентные) [показать]. · слабые (полярные и ван-дер-ваальсовы) [показать]. Многочисленные связи между боковыми радикалами аминокислот определяют пространственную конфигурацию белковой молекулы. У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу». Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие — от греч. гидро – вода, фобос – страх) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу. Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи. В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп (солевые мостики) NH3+ и COO— . Миоглобин Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей. Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами. Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом. Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема. Четвертичная структура характерна для белков, построенных из двух или более пептидных цепей. Белки такого типа называются олигомерами или олигомерными белками. Отдельные структурные единицы олигомерного белка называют субъединицами или протмерами. Субъединица (протомер) полипептидная цепь, характеризующаяся наличием третичной структуры. Взаимное расположение субъединиц, т.е. способ их совместной укладки и упаковки с образованием нативной конформации олигомерного белка и называют четвертичной структурой.
Субъединицы связаны друг с другом посредством лишь слабых нековалентных взаимодействий (электро-статических, водородных, гидрофобных). Причем субъединицы взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки). Взаимное «узнавание» контактных участков происходит по принципу комплементарности. Каждая субъединица взаимодействует с другими во многих точках. Следовательно, ошибочные комплексы в олигомере практически невозможны. Олигомерный белок может содержать две, три, четыре или более субъединиц. Иногда встречаются олигомеры, состоящие из 12 субъединиц и имеющие молекулярную массу до 1 000 000 килодальтон. Субъединицы могут быть одинаковыми или разными.
Гемоглобин — сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул) 2 альфа и 2 бэта цепи, соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет. В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода. Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях. Присоединяя первую мол-лу кислорода меняется пространственная организация геоглобина, способность остальных 3 субъединиц присоединять кислород увеличивается в 500 раз – кооперативный эффект. Гемоглобин переходит из состояния Т в состояние R Способность гемоглобина связывать О2 зависит от условий. В легких рН выше чем в тканях-7,6. Это условие поддерживает парциальное давлении О2. Сродство миоглобина к О2 больше-50% насыщение миоглобина кислородом достигается при 1-2 мм РТ ст, а гемоглобина при 26мм РТ ст. Миоглобин предназначен для временного хранения О2 и отдает его в экстренной ситуации, поэтому отдает кислород он гораздо хуже. Разница рН в легких 7,6 и тканях 7,2 обусловлена связыванием гемоглобина кислорода и высвобождением протонов. Сродство гемоглобина к кислороду в тканях падает, а в легких увеличивается в связи с изменением рН и концентрации газов- эффект Бора У малышей фетальный гемоглобин. Заболевания, связанные с гемоглобином: микроцетарная анемия гемоглобинопатия-нарушение первичной стр одной из субъединиц серповидно-клеточная анемия из-за SHb-глутамин заменен на валин крупные эритроциты-гемолиз-гемалитическая анемия Распад гемоглобина: Hb Fe2 Hb Fe3-метгемоглобин Вероглобин-зеленый пигмент уходит железо и гемоглобин превращается в билевердин-желчный пигмент Билирубин-желтый Билирубин связался с кислотой Мезобилиноген-бесцветный Рис. 12. Фракционирование белков методом гель-фильтрации Белки вымываются (элюируются) из колонки в порядке убывания молекулярной массы. Следовательно, первыми элюируются крупные белковые молекулы (рис. 12, б), которые не диффундируют в зерна, затем мелкие молекулы и в последнюю очередь низкомолекулярные примеси.
Этот метод применяют не только для фракционирования белков по молекулярной массе, но и для очистки их от низкомолекулярных примесей. – аффинная хроматография – или хроматография по сродству. Принцип метода заключается в том, что происходит избирательное взаимодействие белков со специфическими веществами – лигандами, закрепленными на носителях (рис. 13). В качестве носителя используют активированную бромцианом сефарозу. К сефарозе присоединяют лиганды различного происхождения – субстрат, или антиген, или рецептор, которые будут афинно связывать только один белок из смеси: – субстрат → фермент; – антиген → антитело; – гормон → рецептор данного гормона. Другие белки, не связавшиеся с лигандом, удаляются путем промывания колонки. Снятие с колонки афинно закрепленного белка осуществляется спомощью буферного раствора (элюента). В состав буфера вводят детергент, который ослабляет связи между белком и лигандом, или через колонку пропускают раствор с высокой концентрацией свободного лиганда. В этом случае белок легче связывается со свободным лигандом и вымывается (элюируется) из колонки. Классификация белков Существует несколько классификаций белков. В основе классификации лежат различные принципы: 1. По степени сложности (простые и сложные); 2. По форме молекул (глобулярные и фибриллярные); 3. По растворимости; 4. По функциям. Классификация по функциям По выполняемым функциям белки можно разделить на структурные, питательные и запасные белки, сократительные, транспортные, каталитические, защитные, рецепторные, регуляторные и др. Структурные белки К структурным белкам относятся коллаген, эластин, кератин, фиброин. Белки принимают участие в формировании клеточных мембран, в частности, могут образовывать в них каналы или выполнять другие функции (рис. 23).
Питательные и запасные белки Питательным белком является казеин, основная функция которого заключается в обеспечении растущего организма аминокислотами, фосфором и кальцием. К запасным белкам относятся яичный белок, белки семян растений. Эти белки потребляются во время развития зародышей. В организме человека и животных белки в запас не откладываются, они должны систематически поступать с пищей, в противном случае может развиться дистрофия. Сократительные белки Сократительные белки обеспечивают работу мышц, движение жгутиков и ресничек у простейших, изменение формы клеток, перемещение органелл внутри клетки. Такими белками являются миозин и актин. Эти белки присутствуют не только в мышечных клетках, их можно обнаружить в клетках практически любой ткани животных. Транспортные белки Гемоглобин, рассмотренный в начале параграфа, является классическим примером транспортного белка. В крови присутствуют и другие белки, обеспечивающие транспорт липидов, гормонов и иных веществ. В клеточных мембранах находятся белки, способные переносить через мембрану глюкозу, аминокислоты, ионы и некоторые другие вещества. На рис. 24 схематически показана работа переносчика глюкозы.
Рис. 24. Транспорт глюкозы через клеточную мембрану
Белки-ферменты Каталитические белки, или ферменты, представляют собой самую многообразную группу белков. Почти все химические реакции, протекающие в организме, протекают при участии ферментов. К настоящему времени открыто несколько тысяч ферментов. Более подробно они будут рассмотрены в следующих параграфах. Защитные белки К этой группе относятся белки, защищающие организм от вторжения других организмов или предохраняющие его от повреждений. Иммуноглобулины, или антитела, способны распознавать проникшие в организм бактерии, вирусы или чужеродные белки, связываться с ними и способствовать их обезвреживанию. Другие компоненты крови, тромбин и фибриноген, играют важную роль в процессе свертывания крови. Они предохраняют организм от потери крови при повреждении сосудов. Под действием тромбина от молекул фибриногена отщепляются фрагменты полипептидной цепи, в результате этого образуется фибрин: фибриноген Образовавшиеся молекулы фибрина агрегируют, формируя длинные нерастворимые цепи. Сгусток крови вначале является рыхлым, затем он стабилизируется за счет межцепочечных сшивок. Всего в процессе свертывания крови участвует около 20 белков. Нарушения в структуре их генов является причиной такого заболевания, как гемофилия – сниженная свертываемость крови. Рецепторные белки Клеточная мембрана является препятствием для многих молекул, в том числе и для молекул, предназначенных для передачи сигнала внутрь клеток. Тем не менее клетка способна получать сигналы извне благодаря наличию на ее поверхности специальных рецепторов, многие из которых являются белками. Сигнальная молекула, например, гормон, взаимодействуя с рецептором, образует гормон-рецепторный комплекс, сигнал от которого передается далее, как правило, на белковый посредник. Последний запускает серию химических реакций, результатом которых является биологический ответ клетки на воздействие внешнего сигнала (рис. 25).
Рис.25. Передача внешних сигналов в клетку
Регуляторные белки Белки, участвующие в управлении биологическими процессами, относят к регуляторным белкам. К ним принадлежат некоторые гормоны. Инсулин и глюкагон регулируют уровень глюкозы в крови. Гормон роста, определяющий размеры тела, и паратиреоидный гормон, регулирующий обмен фосфатов и ионов кальция, являются регуляторными белками. К этому классу белков принадлежат и другие протеины, участвующие в регуляции обмена веществ.
Кератин является механически прочным и химически неактивным белком. Он обнаружен у большинства позвоночных и представляет собой важный компонент внешнего эпидермального слоя и различных структур: волос, рогов, ногтей и перьев. Кератины классифицируют на 2 основные группы: α-кератины (у человека) и β-ке- ратины (у птиц и рептилий). Геном человека содержит ~50 генов, кодирующих тканеспецифичные кератины. Кератин имеет очень сложную структуру, отличающуюся от той, которую имеют глобулярные белки. Первичная структура α -кератина точно так же представляет собой цепочку аминокислотных остатков. Центральный сегмент каждой полипептидной цепи α-ке- ратина имеет псевдоповтор из 7 аминокислотных остатков: a-b-c-d-e-f-g. В позициях -a- и -d- чаще всего находятся гидрофобные аминокислотные остатки (см. Рис. 17). Поскольку на один виток α-спирали приходится ~3,6 остатка, аминокислотные остатки -a- и -d- расположены всегда по одну сторону цепи. Это позволяет двум полипептидным цепям образовывать димеры (в рамках надвторичной структуры). Кроме того, α-кератины содержат остатки цистеина, между которыми образуются прочные дисульфидные связи. Они стабилизируют общую структуру кератина, связывая между собой полипептидные цепи. Вторичная структура α-кератина очень похожа на обычную α-спираль, однако в α-кератине она имеет меньший шаг (~5,1 Å), а значит, более плотную упаковку. Это вызвано тем, что в α-кератине две полипептидные цепи оборачиваются относительно друг друга и формируют закрученную нить, одновременно вызывая небольшие структурные изменения в цепях (см. Рис. 18 ▼). Характеристика структуры молекулы коллагена. Особняком стоит тройная спираль коллагена - основного белка соединительной ткани
а) молекула коллагена построена из трёх полипептидных цепей. Каждая полипептидная цепь содержит около 1000 аминокислотных остатков (35% - глицин, 21% - пролин и оксипролин, 11% - аланин); б) полипептидные цепи коллагена построены из чередующихся блоков --гли–х–про- или -гли–х–оксипро- (х - аланин или другие аминокислоты). Как пролин, так и оксипролин препятствуют образованию α‑спиралей и в) каждая полипептидная цепь имеет конформацию плотной (3 аминокислотных остатка на виток) левозакрученной спирали (спирализация 1-го порядка); г) в молекуле коллагена эти три спирали перевиты друг с другом, в результате чего образуется тройная суперспираль коллагена (спирализация 2-го порядка), которая принципиально отличается от α‑спирали. Это очень слабо закрученная (один оборот на 10 000 нм) правая спираль; д) между спиралями 1-го порядка за счёт пептидных групп образуются водородные связи. Эластин — основной белковый компонент тканей, которые должны обладать высокими пластическими свойствами. Этот протеин входит в состав: артерий; легких; стенок мочевого пузыря; кожи; эластичных связок; хряща. Переваривание белков Соляная кислота Одним из важнейших компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, секретирующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой. При ее диссоциациии, кроме ионов водорода, образуются карбонат-ионы НСО3–. Они по градиенту концентрации движутся в кровь в обмен на ионы Сl–. В полость желудка ионы Н+ попадают энергозависимым антипортом с ионами К+ (Н +,К + -АТФаза), хлорид-ионы перекачиваются в просвет желудка также с затратой энергии. Н+,К+-АТФаза (протонная помпа) является мишенью действия лекарственных препаратов "ингибиторов протонной помпы" – омепразол, пантопразол и др., используемых для лечения заболеваний желудочно-кишечного тракта, связанных с повышенной кислотностью (гастриты, язвы желудка и 12-перстной кишки, дуоденит). При нарушении нормальной секреции HCl возникают гипоацидный или гиперацидный гастрит, отличающиеся друг от друга по клиническим проявлениям, последствиям и требуемой схеме лечения.
Синтез соляной кислоты Функции соляной кислоты 1. Денатурация белков пищи. 2. Бактерицидное действие. 3. Высвобождение железа из комплекса с белками, что необходимо для его всасывания. Аналогично высвобождаются и другие металлы. 4. Высвобождение различных органических молекул, прочно связанных с белковой частью (гем, коферменты - тиаминдифосфат, ФАД, ФМН, пиридоксальфосфат, кобаламин, биотин), что позволяет витаминам впоследствии всасываться. 5. Превращение неактивного пепсиногена в активный пепсин. 6. Снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина. 7. После перехода в 12-перстную кишку – стимуляция секреции кишечных гормонов и, следовательно, выделения панкреатического сока и желчи. Кислая реакция желудочного сока обусловлена, главным образом, присутствием HCl, гораздо в меньшей степени иона H 2 PO 4 -, при патологиях (гипо- и анацидное состояние, онкология) свой вклад может вносить молочная кислота. Совокупность всех веществ желудочного сока, способных быть донорами протонов, составляет общую кислотность. Соляную кислоту, находящуюся в комплексе с белками, мукополисахаридами слизистой оболочки и продуктами переваривания, называют связанной соляной кислотой, оставшуюся часть - свободной соляной кислотой. Содержание свободной HCl подвержено изменениям, в то же время количество связанной HCl относительно постоянно. Влияние гастрина и гистамина на обкладочные клетки сводится к усилению работы Н +,К + -АТФазы. Действие гастрина заключается в активации кальций-фосфолипидного механизма передачи сигнала, гистамин действует по аденилатциклазному механизму. Пепсин Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр "прикрыт" N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что "раскрывается" активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), т.е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
Гастриксин Гастриксин по своим функциям близок к пепсину, его количество в желудочном соке составляет 20-50% от количества пепсина. Синтезируется главными клетками желудка в виде прогастриксина (профермент) и активируется соляной кислотой. Оптимум рН гастриксина соответствует 3,2-3,5 и значение этот фермент имеет при питании молочно-растительной пищей, слабее стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот. Трипсин Синтезируемый поджелудочной железой трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина. Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групп лизина и аргинина, может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу. Параллельно трипсин участвует в переваривании пищевых липидов, активируя фермент переваривания фосфолипидов – фосфолипазу А 2, и колипазу панкреатической липазы, отвечающей за гидролиз триацилглицеролов. В таких продуктах, как бобовые (соя, горох, фасоль) содержится пептид – ингибитор трипсина, снижающий переваривание белков этих продуктов в сыром, термически необработанном, виде.
Химотрипсин Образуется из химотрипсиногена при участии трипсина, который расщепляет пептидную связь между аргинином-15 и изолейцином-16 с образованием уже активных промежуточных форм π-химотрипсина и δ-химотрипсина, которые аутолизисом удаляют два дипептида из собственных цепей. Три образованных фрагмента удерживаются друг с другом посредством дисульфидных связей, формируя стабильный α-химотрипсин. Фермент специфичен к пептидным связям, образованных с участием карбоксильных групп ароматических аминокислот – фенилаланина, тирозина и триптофана. Эластаза Активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот – аланина, пролина, глицина. Карбоксипептидазы Карбоксипептидазы являются экзопептидазами, они гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки основных аминокислот – лизина и аргинина. Аминопептидазы Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Представителями аминопептидаз являются аланин-аминопептидаза и лейцин-аминопептидаза, обладающие широкой специфичностью. Например, лейцин-аминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин. Дипептидазы Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов. Лизосомы энтероцитов Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами. Дезаминирование аминокилот Трансаминирование Реакции трансаминирования протекают в 2 стадии. На первой стадии к пиридоксальфосфату в активном центре фермента присоединяется аминогруппа от первого субстрата – аминокислоты. Образуется комплекс фермент- пиридоксаминфосфат и кетокислота – первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований (альдимин и кетимин). На второй стадии пиридоксаминфосфат соединяется с новой кетокислотой (второй субстрат) и снова через промежуточное образование 2 шиффовых оснований передает аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота – второй продукт реакции.
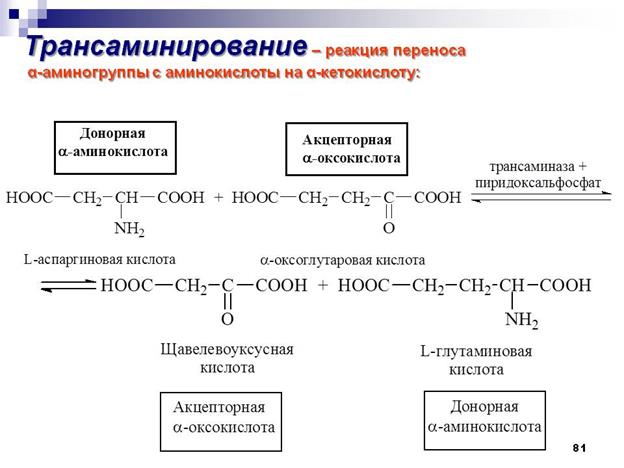
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных – глутамат, аланин, аспартат. Наиболее распространенными в большинстве тканей являются аланинаминотрансфераза (АлАТ) и аспартатаминотрансфераза (АсАТ). Наибольшая активность АсАТ обнаруживается в клетках сердечной мышцы и печени, в то время как в крови обнаруживается только фоновая активность АлАТ и АсАТ. Поэтому можно говорить об органоспецифичности этих ферментов, что позволяет их широко примененятьих с диагностической целью (при инфарктах миокарда и гепатитах). Декарбоксилирование В природе встречаются разные типы декарбоксилирования аминокислот. В организме человека происходит только окислительное декарбоксилирование. Ферменты - декарбоксилазы. Их простетическая группа представлена пиридоксальфосфатом - это активная форма витамина В6:
В реакциях декарбоксилирования участвует альдегидная группа пиридоксальфосфата:
Субстратная специфичность декарбоксилаз очень разная. Несмотря на ограниченный круг аминокислот, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции – биогенные амины (гистамин, g-аминомасляная кислота и др.) оказывают сильное фармакологическое действие на физиологические функции организма. Гистамин образуется при декарбоксилировании гистидина, оказывает широкий спектр биологического действия: вызывает расширение капилляров (обладает сосудорасширяющим действием в отличие от других биогенных аминов), повышение их проницаемости (жидкость из крови выходит в межклеточную среду, что приводит к уменьшению объема крови), понижает АД, стимулирует секруцию желудочного сока и слюны, усиливает секрецию соляной кислоты в желудке; сокращает гладкие мышцы легких, что может вызвать «гистаминовый шок», что проявляется как приступ удушья; участвует в развитии болевых ощущений. Большое количество гистамина образуется в очаге воспаления, что имеет определенный биологический смысл, вызывая расширение сосудов в очаге воспаления, гистамин тем самым ускоряет приток лейкоцитов, способствуя активации защитных сил организма. При повышенной чувствительности к гистамину в клинике используют антигистаминные препараты (санорин, димедрол и др.), оказывая влияние на рецепторы сосудов. g-аминомасляная кислота (ГАМК) образуется при декарбоксилировании глутаминовой кислоты, оказывает тормозящее действие на ЦНС (нейрогуморальный ингибитор). Обнаружена в сером веществе головного мозга, ее введение в организм вызывает торможение в коре (центральное торможение). Серотонин образуется из триптофана в нейронах гипоталамуса, функционирует как нейромедиатор в ЦНС, оказывает мощное сосудосуживающее действие, регулирует АД, температуру тела, дыхание, почечную фильтрацию. Этаноламин образуется при декарбоксилировании серина. Используется для синтеза холина, ацетилхолина, фосфолипидов (фосфатидилэтаноламина, фосфатидилхолина). Дофамин образуется из тирозина в почках, надпочечниках, синаптически
|
||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 329; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.28.234 (0.019 с.) |

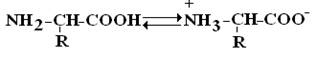

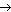 фибрин.
фибрин.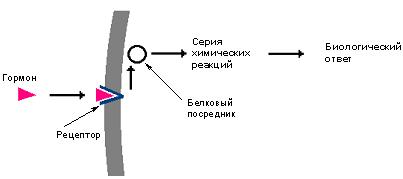

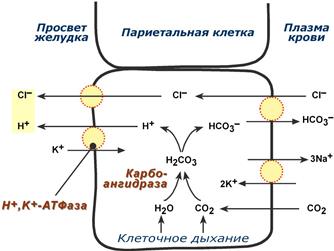
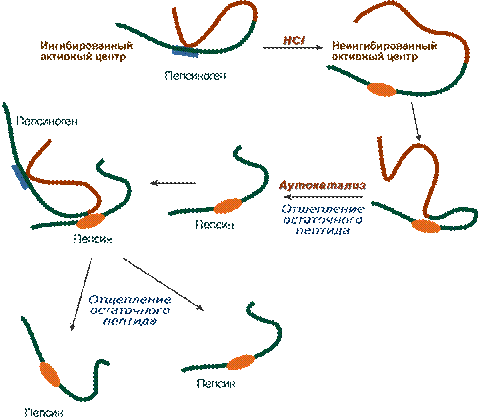
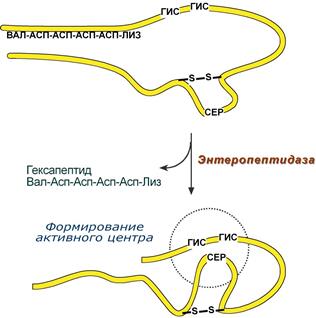 Схема активации трипсина
Схема активации трипсина
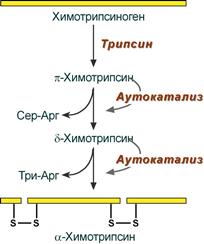 Схема активации химотрипсина
Схема активации химотрипсина
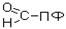
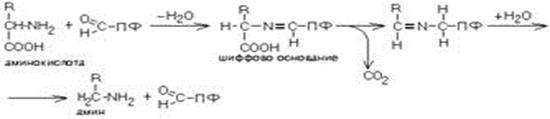 Аминокислота соединяется с активным центром фермента, в состав которого входит альдегидная группа ПФ. Образуются Шиффовы основания (альдимины и кетимины). В результате СООН-группа становится лабильной и отщепляется в виде СО2. Далее происходит гидролиз до соответствующего амина. Эта реакция необратима. Отнятие СО2 происходит без окисления.
Аминокислота соединяется с активным центром фермента, в состав которого входит альдегидная группа ПФ. Образуются Шиффовы основания (альдимины и кетимины). В результате СООН-группа становится лабильной и отщепляется в виде СО2. Далее происходит гидролиз до соответствующего амина. Эта реакция необратима. Отнятие СО2 происходит без окисления.


