Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химические свойства белков. Денатурация
1.Молекулярная масса. Белки – высокомолекулярные органические азотсодержащие полимеры, построенные из аминокислот. Молекулярная масса белков зависит от количества аминокислот в каждой субъединице. Масса свыше 6000 Да. Высокая молекулярная масса белков обусловливает их неспособность проходить через полупроницаемые мембраны 2. Многообразие конформации белков при строгой ее специфичности. Поразительная особенность белков состоит в том, что каждый из них имеет четко определенную, присущую только ему трехмерную структуру. Будучи развернутыми или уложенными случайным образом, полипептидные цепи лишены биологической активности. Функциональные свойства белков определяются их конформацией, т.е. пространственным расположением атомов, которое формирует своеобразный рельеф поверхности молекулы белка. Конформация определяется первичной структурой белка, изменение которой приводит к нарушению нативной конформации белка и, следовательно, изменению его функциональных свойств. 3.Динамичность конформации белков. Конформация белка в целом и отдельных участков его поверхности не остается неизменной и характеризуется динамичностью. Важнейшим условием реализации этого свойства является стабилизация структуры белка множеством слабых связей. Динамичность конформации является не столько следствием, сколько важнейшим условием проявления функциональной активности белков. 4.Гидратация и растворимость белков. Большинство глобулярных белков относятся к гидрофильным веществам, хорошо растворяющимся в воде. Это свойство обусловлено расположенными на поверхности белка группами, способными гидратироваться. Под гидратацией понимается связывание диполей воды с ионными и полярными группами белка, такими как -СОО`, -NН3+, -СОNH2, -OH, -SH, в результате чего образуется гидратная оболочка белков (рис. 1.3). Благодаря этому каждая молекула белка покрывается несколькими молекулярными слоями воды, т.е. одна молекула белка отделена от другой слоем воды и находится в состоянии истинного раствора. 5.Ионизация белка и зависимость заряда от рН среды. Значение рН, при котором число положительных зарядов равно числу отрицательных зарядов, называется изоэлектрической точкой данного белка. В растворах с рН ниже изоэлектрической точки белок приобретает положительный заряд, а выше ИЭТ отрицательный. В ИЭТ точке белки наиболее неустойчивы.
6.Способность радикалов аминокислот в процессе жизнедеятельности подвергаться различным превращениям. В некоторых белках после сборки их полипептидных цепей происходит химическая модификация радикалов некоторых аминокислот с образованием минорных аминокислот. 7.Способность белков к специфическим взаимодействиям с другими веществами основана на том, что связывающий участок белка и взаимодействующее с ним вещество являются комплиментарными друг другу За счет этого достигается безошибочность взаимодействия белков со своим лигандом при условии, что одновременно в клетке происходят миллионы реакций. 8. Способность белков к денатурации. Под денатурацией белка понимают нарушение нативной конформации белковой молекулы, приводящее к уменьшению или полной потере ее растворимости, изменению других физико-химических свойств, утрате специфической биологической активности. Денатурация не сопровождается разрывом пептидных связей и нарушением первичной структуры белка. Происходит расщепление дисульфидных мостиков, гидрофобных, ионных, водородных связей. В результате нарушается третичная структура и в значительной мере вторичная. Денатурацию белка вызывают как физические, так и химические факторы. К физическим денатурирующим факторам относятся: нагревание, ультрафиолетовый свет, высокое давление, механические воздействия, ультразвук. К химическим факторам денатурации относятся: тяжелые металлы, органические растворители, минеральные и органические кислоты, экстремальные значения рН, ионные детергенты. Можно выделить следующие фазы денатурации: вначале при воздействии денатурирующего агента происходит ослабление внутренних связей, стабилизирующих белковую молекулу, плотность укладки полипептидных цепей уменьшается, внутрь молекулы белка могут проникать молекулы воды - это стадия рыхлого клубка, затем происходит полное развертывание полипептидной цепи белка- это стадия нити, в последующем полипептидная цепь укладывается в пространстве случайным образом, наступает стадия случайного клубка.
Денатурированный белок легче подвергается ферментативному гидролизу, поэтому термические способы обработки пищи способствуют лучшему усвоению пищевых белков. Во многих случаях денатурация является необратимым процессом (белки сваренного яйца). В некоторых случаях при медленном возвращении белка к оптимальным условиям (например, уменьшении концентрации мочевины) возможна его ренатурация. Ренатурация белков в живых организмах не описана. По-видимому, это связано с тем, что денатурированный белок легко расщепляется протеолитическими ферментами. 9. Буферные свойства. Белки – амфотерные полиэлектролиты, т.е. они сочетают в себе кислые и основные свойства. В зависимости от этого белки могут быть кислыми и основными. Уровни структуры белка Пептиды – семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными (амидными) связями - С(О)NН-. Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот. Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно.
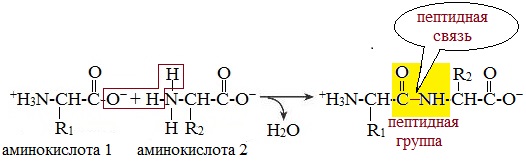
Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –СО-NH-.
Первичная структура белка - определенная последовательность a-аминокислотных остатков в полипептидной цепи. Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве. Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
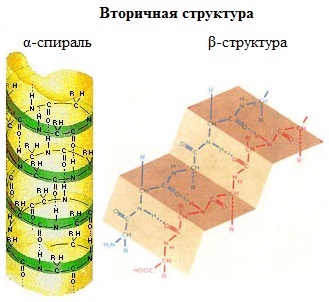
Вторичная структура белка - конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О. В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль. Существует два основных способа укладки цепи. Одна из моделей вторичной структуры - a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи. В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль. Основные особенности α-спирали: · спиральная конфигурация полипептидной цепи, имеющая винтовую симметрию; · образование водородных связей между пептидными группами каждого первого и четвертого аминокислотных остатков; · регулярность витков спирали; · равнозначность всех аминокислотных остатков в α-спирали независимо от строения их боковых радикалов; · боковые радикалы аминокислот не участвуют в образовании α-спирали. В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Имеются разновидности β-структур. Ограниченные слоистые участки, образуемые одной полипептидной цепью белка, называют кросс-β-формой (короткая β-структура). Водородные связи в кросс-β-форме образуются между пептидными группами петель полипептидной цепи. Другой тип — полная β-структура — характерен для всей полипептидной цепочки, которая имеет вытянутую форму и удерживается межпептидными водородными связями между смежными параллельными полипептидными цепями (рис. 3). Эта структура напоминает меха аккордеона. Причем возможны варианты β-структур: они могут быть образованы параллельными цепями (N-концы полипептидных цепей направлены в одну и ту же сторону) и антипараллельными (N-концы направлены в разные стороны). Боковые радикалы одного слоя помещаются между боковыми радикалами другого слоя. Во многих белках одновременно имеются α-спиральные участки и β-структуры. Природных белков, состоящих на 100% из α-спирали, почти не бывает (исключение составляет парамиозин — мышечный белок, на 96-100% представляющий собой α-спираль), тогда как у синтетических полипептидов 100%-ная спирализация. Другие белки имеют неодинаковую степень спирализации. Высокая частота α-спиральных структур наблюдается у парамиозина, миоглобина, гемоглобина. Напротив, у трипсина, рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые β-структуры. Белки опорных тканей: кератин (белок волос, шерсти), коллаген (белок сухожилий, кожи), фиброин (белок натурального шелка) имеют β-конфигурацию полипептидных цепей.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий. Третичная структура – это трехмерная пространственная конфигурация закрученной α-спирали или β-структуры в пространстве. Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена). Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них — α-спираль; напротив, в глобулярных белках может быть большое количество β-структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь. Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот. Эти связи можно разделить на: · сильные (ковалентные) [показать]. · слабые (полярные и ван-дер-ваальсовы) [показать]. Многочисленные связи между боковыми радикалами аминокислот определяют пространственную конфигурацию белковой молекулы. У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу». Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие — от греч. гидро – вода, фобос – страх) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу. Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи. В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп (солевые мостики) NH3+ и COO— . Миоглобин Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей. Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами. Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом. Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема. Четвертичная структура характерна для белков, построенных из двух или более пептидных цепей. Белки такого типа называются олигомерами или олигомерными белками. Отдельные структурные единицы олигомерного белка называют субъединицами или протмерами. Субъединица (протомер) полипептидная цепь, характеризующаяся наличием третичной структуры. Взаимное расположение субъединиц, т.е. способ их совместной укладки и упаковки с образованием нативной конформации олигомерного белка и называют четвертичной структурой. Субъединицы связаны друг с другом посредством лишь слабых нековалентных взаимодействий (электро-статических, водородных, гидрофобных). Причем субъединицы взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки).
Взаимное «узнавание» контактных участков происходит по принципу комплементарности. Каждая субъединица взаимодействует с другими во многих точках. Следовательно, ошибочные комплексы в олигомере практически невозможны. Олигомерный белок может содержать две, три, четыре или более субъединиц. Иногда встречаются олигомеры, состоящие из 12 субъединиц и имеющие молекулярную массу до 1 000 000 килодальтон. Субъединицы могут быть одинаковыми или разными.
Гемоглобин — сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул) 2 альфа и 2 бэта цепи, соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет. В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода. Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях. Присоединяя первую мол-лу кислорода меняется пространственная организация геоглобина, способность остальных 3 субъединиц присоединять кислород увеличивается в 500 раз – кооперативный эффект. Гемоглобин переходит из состояния Т в состояние R Способность гемоглобина связывать О2 зависит от условий. В легких рН выше чем в тканях-7,6. Это условие поддерживает парциальное давлении О2. Сродство миоглобина к О2 больше-50% насыщение миоглобина кислородом достигается при 1-2 мм РТ ст, а гемоглобина при 26мм РТ ст. Миоглобин предназначен для временного хранения О2 и отдает его в экстренной ситуации, поэтому отдает кислород он гораздо хуже. Разница рН в легких 7,6 и тканях 7,2 обусловлена связыванием гемоглобина кислорода и высвобождением протонов. Сродство гемоглобина к кислороду в тканях падает, а в легких увеличивается в связи с изменением рН и концентрации газов- эффект Бора У малышей фетальный гемоглобин. Заболевания, связанные с гемоглобином: микроцетарная анемия гемоглобинопатия-нарушение первичной стр одной из субъединиц серповидно-клеточная анемия из-за SHb-глутамин заменен на валин крупные эритроциты-гемолиз-гемалитическая анемия Распад гемоглобина: Hb Fe2 Hb Fe3-метгемоглобин Вероглобин-зеленый пигмент уходит железо и гемоглобин превращается в билевердин-желчный пигмент Билирубин-желтый Билирубин связался с кислотой Мезобилиноген-бесцветный
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 215; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.33.87 (0.032 с.) |