
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В равных объемах ( V ) различных газов при одинаковых условиях (температура, давление и Т. Д. ) содержится одинаковое Число молекул. (закон справедлив только для газообразных веществ. )
Следствия. 1).Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объем. Следовательно, объем одного моля любого газа (т.е. 6.02 · 1023молекул) при определенных внешних условиях есть величина постоянная. Объем одного моля называется молярным объемом и обозначается Vм. Молярный объем зависит от температуры и давления. Молярный объем любого газа при н.у. равен 22,4 л/моль. V=Vм*n 2) Второе следствие используется для расчета относительных плотностей газов. Плотность любого вещества p – отношение массы этого вещества m к его V ρ = m/ V Отношение плотностей различных газов ρ (Х)/ ρ (У) называется относительной плотностью газа Х по газу У и обозначается Dу(Х). Dу(Х)= ρ (Х)/ ρ (У)=М(Х)/М(У) Относительная плотность одного газа по другому газу равна отношению их молярных или относительных молекулярных масс. Решение задач. Вычисление массовой доли атомов химического элементов. Зная формулу вещества и относительные атомные массы входящих в его состав элементов, можно определить массовую долю (ɷ)атомов каждого элемента, т. е. установить, какую долю от общей массы вещества составляет масса атомов этого элемента. Следовательно, задача заключается в нахождении части от числа. Массовая доля атомов элемента в данном веществе (ɷ(Х)) – это отношение относительной атомной массы этого элемента, умноженной на число его атомов в молекуле (индекс), к относительной молекулярной массе вещества: где ɷ(Х) – массовая доля элемента X в долях единицы; Аr(Х) – относительная атомная масса элемента X; n – число атомов элемента X в молекуле вещества (индекс); Мr – относительная молекулярная масса вещества. Массовую долю можно выражать и в процентах:
ɷ – греческая буква читается омега; n – греческая буква читается ню
Вычисления на основе знаний законов химии Закон сохранения массы (Ломоносова-Лавуазье): масса веществ, вступивших в реакцию, равна массе веществ, полученных в результате реакции. Алгоритм решения расчётных задач по уравнениям химических реакций Составить уравнение химической реакции. В уравнении одной чертой подчеркнуть формулу вещества, масса которого указана в условии задачи, а двумя чертами – формулу того вещества, массу которого требуется вычислить.
3. Под формулами этих веществ указать количество вещества (число молей) согласно уравнению реакции (оно соответствует коэффициенту, стоящему перед формулой вещества в уравнении реакции). 4. По массе вещества, заданной в условии задачи, вычислить количество вещества:
Поставить полученное значение над формулой этого вещества. 5. Над формулой вещества, масса которого неизвестна, поставить х моль.
|
|||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 136; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.191.214 (0.006 с.) |
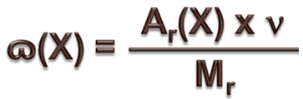 , (1)
, (1)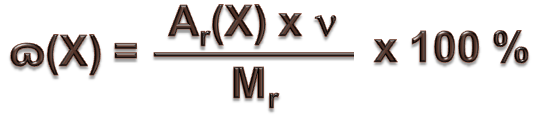 , (2)
, (2)





