
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
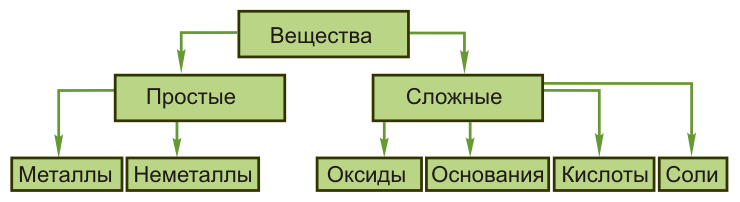
Способность химического элемента образовывать несколько простых веществ называется аллотропией.
А различные простые вещества, образованные одним элементом, - аллотропными видоизменениями, или аллотропными модификациями. Явление аллотропии обусловлено несколькими причинами: 1. Образованием молекул с различным числом атомов (кислород О2 и озон О3, фосфор двухатомный Р 2 и четырехатомный Р4) 2. образованием кристаллов различных модификаций (углерод в виде графита и алмаза). Вещества, образованные из двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.
Формулы вещества составляют на основании еще одного важнейшего понятия в химии – валентности. Валентность – это способность атомов одного химического элемента соединятся со строго определенным числом атомов другого химического элемента. Относительная атомная масса (Ar) химического элемента – это величина, показывающая отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода: Единая углеродная атомная единица массы (а. е. м.) равна:
1 а. е. м. = кг. Относительная атомная масса – одна из основных характеристик химического элемента.
Относительная молекулярная масса ( ) равна сумме относительных атомных масс всех атомов, образующих молекулу вещества. Mr (H2O)= 2 Ar(H)+Ar(O)=2*1+16=18 г/моль Задание. Определить относительную молекулярную массу: Н2СО3,CuO, Ag2O,Ва(ОН)2 Количество вещества (n или v) — это порция данного вещества, содержащая определенное число его структурных единиц; характеризуют числом атомов, молекул или других формульных единиц данного вещества. В Международной системе СИ за единицу количества вещества принят моль. Моль – это количество вещества, содержащее столько молекул (атомов) этого вещества, сколько атомов содержат в 12 г(0,012кг) углерода. Из этого следует, что это число равно числу молекул (атомов) в одном моле любого вещества. Оно называется числом Авогадро и обозначается, как NA NA = 6,022 141 29(27)·1023 моль−1. Массу одного моля называют молярной массой и обозначают буквой М: г/моль. Молярная масса, выраженная в г/моль, численно равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Современный период в развитии химии начинается с открытия в 1869 году Периодического закона Д.И. Менделеевым. Однако, химия стала превращаться в точную науку еще в середине XVIII века в результате установления ряда стехиометрических законов, относящихся к числу основных законов химии. Стехиометрические законы – законы, устанавливающие количественные соотношения между массами и обьём реагирующих веществ, между массами элементов, входящими в состав данного вещества. Стехиометрическими законами являются: 1.Закон сохранения массы веществ. 2. Закон постоянства состава веществ. 3. Закон Авогадро. Закон сохранения массы веществ (М.В.Ломоносов, 1748; А.Лавуазье, 1789) Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Для реакции: NaOH + HCl = NaCl - H 2 O m1 m2 m3 m4 По закону сохранения массы: m 1 + m 2 = m 3 + m 4 Сохранение массы веществ в химических реакциях обьясняется тем, что число атомов каждого элемента до и после реакции не изменяется. В ходе химической реакции происходит только перегруппировка атомов, из которых состоят вещества.
Закон сохранения массы вещества является частным случаем всемирного закона сохранения материи. При написании химических реакций следует помнить о законе сохранения массы веществ и соблюдать баланс атом в левой и правой части уравнения реакции. Химическое уравнение – это выражение химической реакции, в котором записаны формулы исходных веществ(реагентов) и продуктов реакции, а также коэффициенты, показывающие число молекул каждого вещества. Закон постоянства состава. Впервые сформулировал Ж.Пруст (1808 г) Состав молекулы любого вещества отражается химической формулой вещества. Согласно закону: все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенноехимическое строение, независимо от способа получения. Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях. Пример. CuS - сульфид меди. m(Cu): m(S) = Ar(Cu): Ar(S) = 64: 32 = 2: 1 Чтобы получить сульфид меди (CuS) необходимо смешать порошки меди и серы в массовых отношениях 2: 1. Если взятые количества исходных веществ не соответствуют их соотношению в химической формуле соединения, одно из них останется в избытке. Например, если взять 3 г меди и 1 г серы, то после реакции останется 1 г меди, который не вступил в химическую реакцию. Вещества немолекулярного строения не обладают строго постоянным составом. Их состав зависит от условий получения. Закон объемных отношений (Жозеф Луи Гей-Люссак, 1802). Объемы вступающих в реакцию газов, а также объемы газообразных продуктов реакции относятся друг к другу как простые целые числа. Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества. Закон кратных отношений. (Дальтон, 1803) Если два элемента образуют между собой несколько соединений, то массовые доли любого из элементов в этих соединениях относятся друг к другу как небольшие целые числа. Закон Авогадро. (1811 г.) В газообразном состоянии расстояния между частицами вещества намного больше, чем в жидком и твердом агрегатных состояниях. Эти расстояния намного больше размеров молекул данного газа. Поэтому объем газа определяется не размером его молекул, а расстоянием между ними. Эти расстояния зависят от внешних условий: температуры и давления.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 68; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.107.90 (0.01 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
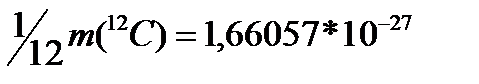
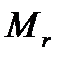 Задание. Определить относительная атомную массу: H,C,O,Cl (относительные атомные массы приведены в ПСХЭ).
Задание. Определить относительная атомную массу: H,C,O,Cl (относительные атомные массы приведены в ПСХЭ).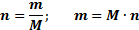
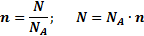
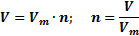

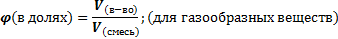
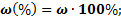
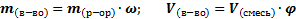
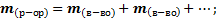
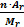 ; n – число атомов, Аr – атомная масса, Mr – молекулярная масса
; n – число атомов, Аr – атомная масса, Mr – молекулярная масса


