Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Основные химические понятия и законы.Стр 1 из 5Следующая ⇒
Колледж приборостроения и информационных технологий Лекционный учебный материал
Учебная дисциплина ОУД.10 Химия
ПреподавательСергеева Светлана Павловна
Специальность09.02.07 Информационные системы и программирование 09.02.06 Сетевое и системное администрирование 10.02.04 Обеспечение информационной безопасности телекоммуникационных систем 10.12.05 Обеспечение информационной безопасности автоматизированных систем 11.02.15 Инфокоммуникационные сети и системы связи Группы АКС-11, АКС-12, АКС-13,ПКС-11.ПКС-12, ПКС-13, ПКС-14,ИКС-11,ИБ-11,ИБ-12,ИБ-13,ИТ-11,ЭО-11
Тема: Основные химические понятия и законы. ЦЕЛЬ: познакомить студентов с основными понятиями химии; формировать умение решать расчетные задачи на нахождение количества вещества, массы, объема и числа молекул; создать условия для актуализации и систематизации знаний студентов о фундаментальных законах общей химии. Задание. Ознакомьтесь с теоретическим материалом занятия. Составить опорный конспект, используя различные источники литературы и интернет ресурсы по плану: Важнейшие химические понятия: химический элемент, вещество, атом, молекула, атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, Важнейшие химические законы: атомно-молекулярное учение, закон сохранения массы веществ, периодический закон Д.И.Менделеева, закон кратных отношений, закон постоянства состава, закон объемных отношений, закон Авогадро.
Различают в качественный и количественный состав веществ. Качественный состав – это совокупность химических элементов и (или) атомных группировок, составляющих данное химическое вещество. Количественный состав – это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество. Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или первой и одной из последующих букв латинских названий элементов.
Простые вещества – это вещества, образованные одним химическим элементом. Один и тот же химический элемент может образовывать несколько простых веществ.
Закон Авогадро. (1811 г.) В газообразном состоянии расстояния между частицами вещества намного больше, чем в жидком и твердом агрегатных состояниях. Эти расстояния намного больше размеров молекул данного газа. Поэтому объем газа определяется не размером его молекул, а расстоянием между ними. Эти расстояния зависят от внешних условий: температуры и давления. В равных объемах (V) различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул. (Закон справедлив только для газообразных веществ.) Следствия. 1).Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объем. Следовательно, объем одного моля любого газа (т.е. 6.02 · 1023молекул) при определенных внешних условиях есть величина постоянная. Объем одного моля называется молярным объемом и обозначается Vм. Молярный объем зависит от температуры и давления. Молярный объем любого газа при н.у. равен 22,4 л/моль. V=Vм*n 2) Второе следствие используется для расчета относительных плотностей газов. Плотность любого вещества p – отношение массы этого вещества m к его V ρ = m/ V Отношение плотностей различных газов ρ (Х)/ ρ (У) называется относительной плотностью газа Х по газу У и обозначается Dу(Х). Dу(Х)= ρ (Х)/ ρ (У)=М(Х)/М(У) Относительная плотность одного газа по другому газу равна отношению их молярных или относительных молекулярных масс. Решение задач. Вычисление массовой доли атомов химического элементов. Зная формулу вещества и относительные атомные массы входящих в его состав элементов, можно определить массовую долю (ɷ)атомов каждого элемента, т. е. установить, какую долю от общей массы вещества составляет масса атомов этого элемента. Следовательно, задача заключается в нахождении части от числа. Массовая доля атомов элемента в данном веществе (ɷ(Х)) – это отношение относительной атомной массы этого элемента, умноженной на число его атомов в молекуле (индекс), к относительной молекулярной массе вещества: где ɷ(Х) – массовая доля элемента X в долях единицы; Аr(Х) – относительная атомная масса элемента X; n – число атомов элемента X в молекуле вещества (индекс); Мr – относительная молекулярная масса вещества.
Массовую долю можно выражать и в процентах:
ɷ – греческая буква читается омега; n – греческая буква читается ню
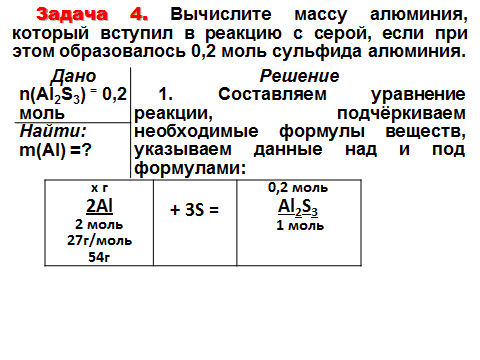
Записать ответ.
1 моль любого вещества содержит 6,02 • 1023 молекул, атомов или других частиц. Например: • 1 моль воды Н2O содержит 6 • 1023 молекул Н2O; • 1 моль железа Fе содержит 6 • 1023 атомов Fе; • 1 моль хлора Сl2 содержит 6 • 1023 молекул Сl2. В то же время 1 моль хлора Сl2 содержит 2 моль атомов хлора Сl: N(Сl) = 2 • N(Сl2); N(Сl) = 2 • 6 • 1023 = 12 • 1023. Величину 6,02 • 1023 моль–1 называют постоянной Авогадро (в честь итальянского учёного XIX в. А. Авогадро) и обозначают латинской буквой N с индексом А (NА): NА = 6,02 • 1023 моль–1 = 6,02 • 1023 1/моль Запомним: число молекул или атомов N(Х), содержащихся в определённом количестве вещества n(Х), можно вычислить по формуле: N(X) = NА • n(Х) (1) Например, определим число молекул, содержащихся в воде количеством вещества 0,5 моль: N(H2O) = NА • n(H2O); N(H2O) = 6,02 • 1023 моль–1 • 0,5 моль = 3 • 1023.
Проверьте себя (ответы в скобках – выучить!) 1. Что такое атом? (Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства) 2. Что такое молекула? (Молекула - наименьшая частица вещества, обладающая его химическими свойствам). 3. Что такое атомная масса? (Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C) 4. Что такое относительная молекулярная масса? Как ее найти? (Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Чтобы ее посчитать, необходимо сложить атомные массы с учетом их стехиометрических коэффициентов) 5. Что такое молярная масса вещества? В каких единицах она выражается? (Молярная масса показывает массу одного моля вещества. Выражается в граммах на моль – г/моль. 6. Как вычислить количество вещества, зная массу, объём или число структурных единиц? (n=m/M n=N/NА n=V/Vm) 7. Как формулируется закон Авогадро? (В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул) 8. Что называется относительной плотностью одного газа по другому? (Отношение масс двух газов, занимающих равные объёмы при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D D=M1/М2). 9. Сформулируйте закон постоянства состава. (Состав соединений молекулярной структуры является постоянным независимо от способа получения. Состав соединений с немолекулярной структурой (атомной, ионной и металлической кристаллической решеткой) не является постоянным и зависит от способа получения). 10. Сформулируйте закон сохранения массы веществ. Масса веществ, вступивших в реакцию, равна массе образующихся продуктов). Колледж приборостроения и информационных технологий Лекционный учебный материал
Учебная дисциплина ОУД.10 Химия
ПреподавательСергеева Светлана Павловна
Специальность09.02.07 Информационные системы и программирование 09.02.06 Сетевое и системное администрирование 10.02.04 Обеспечение информационной безопасности телекоммуникационных систем 10.12.05 Обеспечение информационной безопасности автоматизированных систем 11.02.15 Инфокоммуникационные сети и системы связи Группы АКС-11, АКС-12, АКС-13,ПКС-11.ПКС-12, ПКС-13, ПКС-14,ИКС-11,ИБ-11,ИБ-12,ИБ-13,ИТ-11,ЭО-11
Тема: Основные химические понятия и законы. ЦЕЛЬ: познакомить студентов с основными понятиями химии; формировать умение решать расчетные задачи на нахождение количества вещества, массы, объема и числа молекул; создать условия для актуализации и систематизации знаний студентов о фундаментальных законах общей химии. Задание. Ознакомьтесь с теоретическим материалом занятия. Составить опорный конспект, используя различные источники литературы и интернет ресурсы по плану: Важнейшие химические понятия: химический элемент, вещество, атом, молекула, атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, Важнейшие химические законы: атомно-молекулярное учение, закон сохранения массы веществ, периодический закон Д.И.Менделеева, закон кратных отношений, закон постоянства состава, закон объемных отношений, закон Авогадро.
|
|||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.248.119 (0.019 с.) |

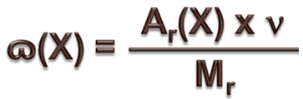 , (1)
, (1)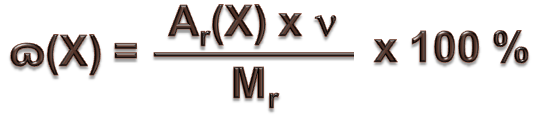 , (2)
, (2)