
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Истинная и средняя теплоемкости
Так как теплоемкость идеального газа зависит от температуры, а реального и от давления, то в технической термодинамике различают истинную и среднюю теплоемкости. Теплоемкость, определяемая уравнениями (5.1), (5.3), (5.4) при данных значениях параметров состояния υ и Т или р и Т (т. е. в данном состоянии тела), называют истинной теплоемкостью. Следовательно, истинной теплоемкостью называется отношение элементарного количества теплоты, сообщаемой термодинамической системе в каком либо процессе, к бесконечно малой разности температур. В практических расчетах при определении количества теплоты обычно применяют так называемые средние теплоемкости. Средней теплоемкостью схт данного процесса в интервале температур от t1 до t2 называют отношение количества теплоты q1-2 к конечной разности температур t2-t1:
Так как количество теплоты q1-2,x, полученное системой в процессе х=const, определяется уравнением (5.2), где сх — истинная теплоемкость в данном процессе, то
Если средние теплоемкости даны в таблице для интервала температур от 0 до t,°С, то средняя теплоемкость
Таким образом, если в каком-либо процессе идеальный газ был нагрет от температуры t1 до t2, то количество теплоты, затраченное на нагревание, равно
где m – масса газа, Vн – объём при нормальных условиях.
5.5. Отношение теплоемкостей ср и сυ
В термодинамике часто используется отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме, обозначаемое обычно буквой k:
Если считать cx=const, то из табл. 5.1 получаем: для одноатомного газа k = 1,66; для двухатомного газа k=1,4, для трех- и многоатомных газов k= = 1,33. Теплоемкость смесей идеальных газов
При расчетах тепловых установок приходится встречаться со смесями газов, а в таблицах приводятся теплоемкости только для отдельных идеальных газов; поэтому нужно уметь определить теплоемкость газовой смеси. Если смесь газов задана массовыми долями, то массовая теплоемкость смеси определяется как сумма произведений массовых долей на массовую теплоемкость каждого газа:
где g1, g2, gn—массовые доли каждого газа, входящего в смесь. Если смесь газов задана объемными долями, то объемная теплоемкость смеси равна сумме произведений объемных долей на объемную теплоемкость каждого газа:
Массовая теплоемкость смеси газов может быть определена, если известны плотность и удельный объем смеси газов при нормальных физических условиях:
Энтропия.
Разделив обе части уравнения первого закона термодинамики на Т, получим:
Отсюда выражение dq/T при обратимом изменении состояния газа есть полный дифференциал некоторой функции переменных Т и υ (сυ зависит только от температуры, а R— величина постоянная). Клаузиус назвал эту функцию энтропией и обозначил буквой S. Измеряется полная энтропия S в джоулях на градус (Дж/град), а удельная энтропия s — в джоулях на килограмм на градус [Дж/(кг · град)]. Таким образом, дифференциал энтропии для обратимого изменения состояния определяется как
Энтропия есть однозначная функция состояния газа, принимающая для каждого его состояния вполне определенное значение. Энтропия может быть определена как функция основных параметров состояния:
Величина дифференциальа энтропии как функции Т и υ определяется уравнением:
Интегрируя при сυ = const найдем для идеального газа
В случае когда энтропия является функцией p и T, полуаем:
Интегрируя при ср = const, находим
При условии s=f (p,υ), будем иметь
Интегрируя, определяем
Тепловая Т s-диаграмма
то на Тs-диаграмме площадь 1234, ограниченная линией процесса, крайними ординатами и осью s, в некотором масштабе изображает теплоту, участвующую в процессе. Из уравнения dq = Тds следует, что dq и ds имеют одинаковые знаки. Если в процессе энтропия s увеличивается, то теплота к газу подводится. Если энтропия s уменьшается, то это указывает на отвод теплоты от рабочего тела. Для идеальных газов условно принято считать энтропию равной нулю при нормальных физических условиях.
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ИДЕАЛЬНЫХ ГАЗОВ 6.1. Основные определения
Первый закон термодинамики устанавливает взаимосвязь между количеством теплоты, изменением внутренней энергии и внешней работой газа, причем количество теплоты, подводимое к телу или отводимое от него, зависит от характера процесса. К основным процессам, имеющим большое значение, как для теоретических исследований, так и для практических работ в технике, относятся: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермный, протекающий при постоянной температуре; адиабатный, протекающий при отсутствии теплообмена с внешней средой. Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными и характеризуются постоянством теплоемкости в процессе. Изохорный процесс
Процесс, протекающий при постоянном объеме, называют изохорным (dυ = 0, или υ = const). Кривая процесса называется изохорой. На рис. 6.1 представлен график процесса.
Внешняя работа газа при υ=const равна нулю, так как dυ = 0, т.е. l=0. Основное уравнение первого закона термодинамики (4.6) при d l = 0 принимает вид
dqυ = duυ = cυdt.
Количество теплоты, участвующее в процессе при постоянной теплоемкости, равно
Вся внешняя теплота расходуется только на изменение внутренней энергии тела. Если процесс 1-2, осуществляется с увеличением давления, теплота в нём подводится, при этом увеличивается внутренняя энергия и температура. Если давление газа в процессе понижается, то теплота отводится, уменьшается внутренняя энергия и температура (рис.6.1)
Изменение энтропии в изохорном процессе определяем из уравнения (5.21):
но при υ=const ln υ2/υ1=0, поэтому изменение энтропии при постоянной теплоемкости равно
Как видно из данного уравнения, изохора на Тs-диаграмме представляет собой логарифмическую кривую.
Изобарный процесс
Рис. 6.2
Процесс, протекающий при постоянном давлении, называют изобарным (dр = 0, или р = const). Кривая процесса называется изобарой. На рис. 6.2 изображен график процесса. Из уравнения состояния идеального газа для изобарного процесса находим
В соответствии с з аконом Гей-Люссака, в изобарном процессе объемы одного и того же количества газа изменяются прямо пропорционально абсолютным температурам:
При расширении газа его температура возрастает, при сжатии — уменьшается. Удельная работа изменения объема при этом выражается следующим уравнением: или
Основное уравнение первого закона термодинамики при р=const (dр=0) имеет вид
Следовательно, количество теплоты, сообщенное телу в изобарном процессе при постоянной теплоемкости, равно
при переменной теплоемкости
Для обратимого изобарного процесса при постоянной теплоемкости изменение энтропии находится по уравнению (5.23):
но при р = const lnp2/p1=0, поэтому
Изобара на Тs-диаграмме также, как и изохора, изображается логарифмической кривой. Площадь под изобарой в некотором масштабе изображает количество теплоты qр, сообщаемое газу, равное изменению энтальпии i 2- i 1. Из сопоставления уравнений (6.3) и (6.9) следует, что в случае осуществления изохорного и изобарного процессов в одном интервале температур возрастание энтропии будет больше в изобарном процессе, так как ср всегда больше сυ. Изобары являются более пологими кривыми, чем изохоры (см. рис. 6.3).
Рис. 6.3
Изотермный процесс
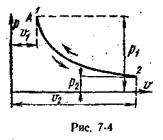
Процесс, протекающий при постоянной температуре, называют изотермным (Т = const, или dТ = 0). Кривая процесса называется изотермой (рис. 6.4).
Для изотермного процесса
На рυ-диаграмме изотермный процесс представляет собой равнобокую гиперболу.
Количество подведенной к идеальному газу теплоты численно равно работе изменения объема. Зная уравнение изотермного процесса для идеального газа, и применяя уравнение состояния, определим удельную работу газа.
Энтальпия и внутренняя энергия идеального газа не меняются, Изотермный процесс на Ts-диаграмме изображается горизонтальной прямой, параллельной оси абсцисс. Для определения изменения энтропии следует воспользоваться уравнениями (5.21) и (5.23) при T=const, после чего плучаем:
Теплота, участвующая в изотермном процессе, равна произведению изменения энтропии (s2 – s1) на абсолютную температуру Т:
Адиабатный процесс
Процесс, протекающий без подвода и отвода теплоты, т. е. при отсутствии теплообмена рабочего тела с окружающей средой, называют адиабатным, а кривая этого процесса называется адиабатой. Для получения адиабатного процесса необходимым и обязательным условием является dq = 0 и, следовательно, q= 0. Обратимый адиабатный процесс можно осуществить в цилиндре с абсолютно нетеплопроводными стенками при бесконечно медленном перемещении поршня. Уравнение адиабаты выводится на основе уравнения первого закона термодинамики и имеет вид:
pυ k= const. (6.14)
При адиабатном процессе произведение давления на объем газа в степени k есть величина постоянная. Величину k называют показателем адиабаты. Показатель адиабаты k= cp/ cυ (см. раздел5.5). В соответствии с уравнением (6.14) адиабата в pυ – диаграмме графически изображена неравнобокой гиперболой АВ (см. рис. 6.5, а). Рассмотрим зависимость между основными параметрами в адиабатном процессе. Из уравнения адиабаты следует, что
Зависимость между температурой, объёмом и давлением газа в процессе выражается соотношением:
Уравнение первого закона термодинамики для адиабатного процесса принимает вид:
или
l = u1 – u2. (6.17)
Это значит, что работа изменения объема в адиабатном процессе получается за счет убыли внутренней энергии тела;
Если газ расширяется, то его внутренняя энергия и температура убывают; если газ сжимается, то его внутренняя энергия и температура возрастают. Работу газа также можно определить из следующих соотношений:
или
Графически внешняя работа изображается на рυ-диаграмме пл. 12v2v1 (рис. 6.5, а). Из рис. 6.5 видно, что поскольку в уравнении адиабаты k > 1, она на рυ-диаграмме идет круче, чем изотерма. Для обратимого адиабатного процесса dq =0, поэтому
ds = dq/T = 0 и s2-s1 = const,
т. е. обратимый адиабатный процесс является одновременно изоэнтропным (или при постоянной энтропии) и изображается в Тs-диаграмме вертикальной прямой 1 – 2, параллельной оси ординат (см. рис. 6.5, б).
Рис. 6.5
Политропные процессы
Условились всякий процесс идеального газа, в котором теплоемкость является постоянной величиной, называть политропным процессом, а линию процесса — политропой. Из определения политропного процесса следует, что основные термодинамические процессы — изохорный, изобарный, изотермический и адиабатный, если они протекают при постоянной теплоемкости, являются частными случаями политропного процесса. Теплоемкость политропного процесса сn может принимать самые разнообразные положительные и отрицательные значения от + ∞ до - ∞. В результате преобразования аналитических выражений первого закона термодинамики получаем выражение:
Полученное уравнение является уравнением политропного процесса. Величина n в уравнении (6.21) называется показателем политропы; он равен
Показатель политропы n принимает для каждого процесса определенное числовое значение. Для основных процессов: изохорных n=±∞, изобарных n = 0, изотермных n = 1 и адиабатных n = k. Поскольку уравнение политропы отличается от уравнения адиабаты только величиной показателя n, то, очевидно, все соотношения между основными параметрами могут быть представлены формулами, аналогичными адиабатному процессу:
Теплоемкость политропного процесса определяем из формулы
Уравнение (6.23) позволяет определить теплоемкость политропного процесса для каждого значения n. Если в уравнение (6.23) подставить значения n для частных случаев, то получаем теплоемкости рассмотренных процессов: изохорного процесса n=±∞, cn=сυ; изобарного процесса n=0, cn=kсυ=cp; изотермного процесса n=1, cn=±∞; адиабатного процесса n=k, cn=0. Уравнение работы изменения объема, совершаемой телом при политропном процессе, имеет аналогичный вид с уравнением работы в адиабатном процессе, т. е.
или
Изменение внутренней энергии газа и теплота в политропном процессе определяются по формулам:
Изменение энтальпии в политропном процессе
Изменение энтропии газа в политропном процессе определяется по формуле
или для конечного изменения состояния
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
|
|||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 241; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.236.174 (0.107 с.) |
 . (5.10)
. (5.10) . (5.11)
. (5.11) может быть вычислена по формуле
может быть вычислена по формуле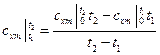 . (5.12)
. (5.12) . (5.13)
. (5.13) (5.14)
(5.14) (5.15)
(5.15)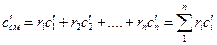 . (5.16)
. (5.16)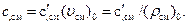 (5.17)
(5.17)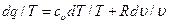 . (5.18)
. (5.18)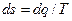 . (5.19)
. (5.19)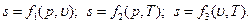
 . (5.20)
. (5.20)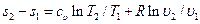 . (5.21)
. (5.21)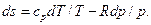 (5.22)
(5.22)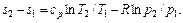 (5.23)
(5.23) (5.24)
(5.24) (5.25)
(5.25) Энтропию можно применять совместно с одним из основных параметров для графического изображения процессов. Удобнее всего энтропию сочетать с абсолютной температурой Т. Если энтропию s откладывать по оси абсцисс, а абсолютную температуру—по оси ординат, то получаем координатную систему: Т s, т.е. Ts-диаграмму, где состояние газа графически изобразится точкой, а процесс — в виде кривой, уравнение которой можно представить как Т = f(s). Элементарная теплота процесса dq= Тds изобразится на диаграмме элементарной площадкой, высота которой равна Т, а основание ds (рис. 5.2). Поскольку количество тепла, подводимого в этом процессе
Энтропию можно применять совместно с одним из основных параметров для графического изображения процессов. Удобнее всего энтропию сочетать с абсолютной температурой Т. Если энтропию s откладывать по оси абсцисс, а абсолютную температуру—по оси ординат, то получаем координатную систему: Т s, т.е. Ts-диаграмму, где состояние газа графически изобразится точкой, а процесс — в виде кривой, уравнение которой можно представить как Т = f(s). Элементарная теплота процесса dq= Тds изобразится на диаграмме элементарной площадкой, высота которой равна Т, а основание ds (рис. 5.2). Поскольку количество тепла, подводимого в этом процессе , (5.26)
, (5.26) Согласно закону Шарля, при постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам:
Согласно закону Шарля, при постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам: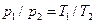 . (6.1)
. (6.1)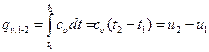 . (6.2)
. (6.2) . (6.3)
. (6.3)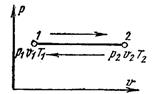
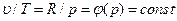
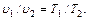 (6.4)
(6.4)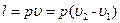 , (6.5)
, (6.5)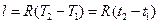 . (6.6)
. (6.6) .
.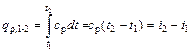 ; (6.7)
; (6.7) . (6.8)
. (6.8)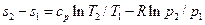 ,
,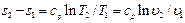 . (6.9)
. (6.9)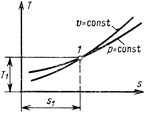
 объем газа изменяется обратно пропорционально его давлению (закон Бойля — Мариотта):
объем газа изменяется обратно пропорционально его давлению (закон Бойля — Мариотта): . (6.10)
. (6.10)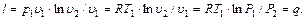 (6.11)
(6.11)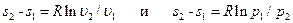 . (6.12)
. (6.12)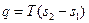 . (6.13)
. (6.13)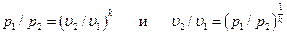 . (6.15)
. (6.15)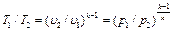 . (6.16)
. (6.16)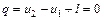
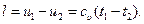 (6.18)
(6.18)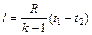 (6.19)
(6.19)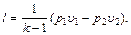 (6.20)
(6.20)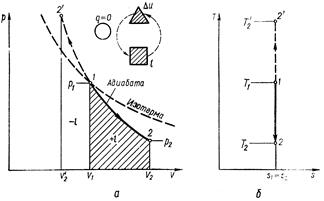
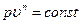 . (6.21)
. (6.21)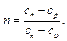 (6.22)
(6.22)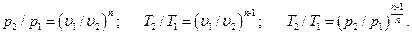
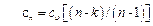 . (6.23)
. (6.23) , (6.24)
, (6.24)
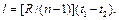 (6.25)
(6.25)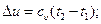
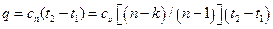 . (6.26)
. (6.26)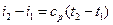 . (6.27)
. (6.27)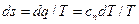 , (6.30)
, (6.30)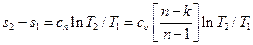 . (6.31)
. (6.31)


