
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные свойства газовых смесей
Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси. Молекулы газа создают давление на стенки сосуда, которое называется парциальным (частичным). Будем считать, что каждый отдельный газ, входящий в смесь, подчиняется уравнению состояния Клапейрона, т. е. он является идеальным газом. Газовая смесь идеальных газов подчиняется закону Дальтона, который гласит: общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь:
где Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси. Параметры газовой смеси могут быть вычислены по уравнению Клапейрона
где все величины, входящие в уравнение, относятся к смеси газов. 3.2. Способы задания состава и расчёт параметров смеси газов.
Газовая смесь может быть задана массовыми, объемными и мольными долями. Массовой долей называется отношение массы каждого газа к общей массе смеси:
где mсм – масса всей смеси. Сумма массовых долей равна единице:
Объемной долей называется отношение парциального (приведенного) объема каждого газа к общему объему смеси газов:
где r 1, r 2,... rn – объемные доли; V 1 V 2,... Vn – парциальные (приведенные) объемы каждого газа; Vсм – объем смеси газов. Парциальным объемом газа называется объем, который занимал бы этот газ, если бы его температура и давление равнялись температуре и давлению смеси газов. Общий объём смеси газов равен
Сумма парциальных объемов газов, составляющих смесь, равна объему смеси газов. Сумма объемных долей равна единице:
Задание смеси мольными долями равнозначно заданию её объемными долями.
Между удельными объемами, плотностями, молекулярными массами и газовыми постоянными какого-нибудь газа и всей смеси в целом на основании закона Авогадро и уравнения Клапейрона – Менделеева существует следующая зависимость:
где Можно записать также, что
Последнее соотношение позволяет составить несколько уравнений, для расчёта параметров газовой смеси.
Для перевода массовых долей в объемные пользуются формулой
Объемные доли переводят в массовые по формуле
Плотность смеси ρсм, кг/м3, определяют из выражения
или, если известен массовый состав, по формуле
Удельный объем смеси представляет величину, обратную ρсм; поэтому, если дан объемный состав смеси, то
Если же известен массовый состав, то
Из уравнения (3.9) легко получить значение так называемой кажущейся молекулярной массы газовой смеси
или через массовый состав
Газовую постоянную смеси газов (R cм) можно выразить или через газовые постоянные отдельных компонентов, входящих в смесь, или через кажущуюся молекулярную массу смеси
или
Парциальные давления определяются проще всего, если известны объёмные доли отдельных компонентов входящих в смесь;
p1 = pсм r1, p2 = pсм r2 и т.д.
или вообще
pi = Рсм ∙ ri, (3.17)
где pi – парциальное давление любого газа, входящего в смесь.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.47.221 (0.014 с.) |
 , (3.1)
, (3.1)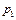 ,
,  ,...
,...  – парциальные давления.
– парциальные давления.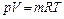 ,
,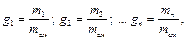 (3.2)
(3.2)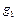 ,
, 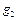 , …
, … 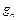 – массовые доли; m 1 m 2,..., mn – масса каждого газа;
– массовые доли; m 1 m 2,..., mn – масса каждого газа; .
.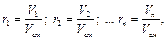 (3.3)
(3.3) . (3.4)
. (3.4)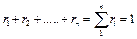 .
. , (3.5)
, (3.5) – плотность каждого газа;
– плотность каждого газа; 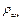 – плотность смеси газов;
– плотность смеси газов; 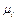 – молекулярная масса каждого газа;
– молекулярная масса каждого газа;  – молекулярная масса смеси газов.
– молекулярная масса смеси газов.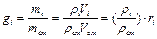 . (3.6)
. (3.6)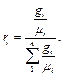 (3.7)
(3.7) (3.8)
(3.8) (3.9)
(3.9)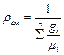 . (3.10)
. (3.10)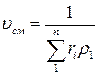 (3.11)
(3.11) . (3.12)
. (3.12)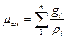 (3.13)
(3.13)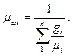 (3.14)
(3.14) (3.15)
(3.15) . (3.16)
. (3.16)


