Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
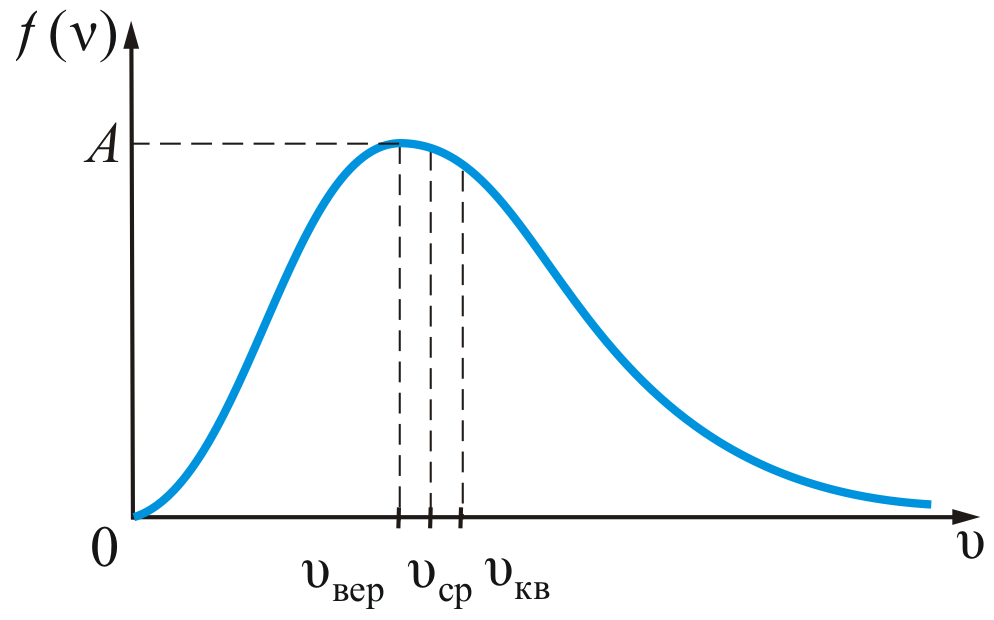
График распределения Максвелла
Наиболее вероятная, средняя арифметическая и средняя квадратичная скорости:
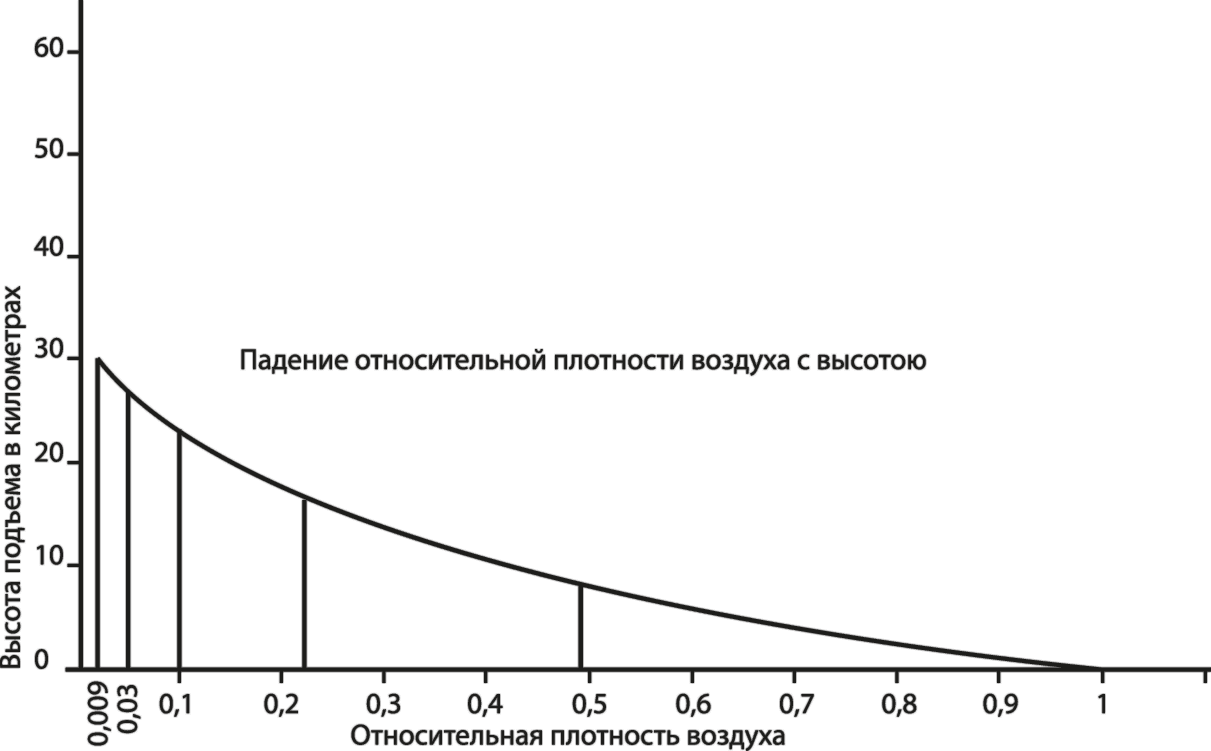
Барометрическая формула для зависимости давления воздуха от высоты над поверхностью Земли.
И 70 Зависимость плотности атмосферы и концентрации молекул газа от высоты над поверхностью Земли.
Внутренняя энергия идеального газа. Первое начало термодинамики. Внутренняя энергия термодинамической системы – сумма кинетической энергии теплового движения частиц и потенциальной энергии их взаимодействия между собой. (если температура высокая и включаются колебательные степени свободы молекул, то надо добавить потенциальную энергию колебаний.)

Первое начало термодинамики: (2 варианта определения) 1) Внутреннюю энергию термодинамической системы можно изменить, совершая над ней механическую работу и/или сообщая ей энергию в процессе теплопередачи. D U = A ’+ Q (для бесконечно больших значений) dU = d A ’+ d Q (для бесконечно малых значений) 2) Энергия сообщенная термодинамической системе в процессе теплопередачи тратится на изменение внутренней энергии и/или совершение им/ей работы над внешней средой. Q = D U + A (для бесконечно больших значений) d Q = Du + d A (для бесконечно малых значений) Количество теплоты. Теплоемкость процесса. Молярная и удельная теплоемкости, связь между ними. Количество теплоты – энергия, которую получает термодинамическая система в процессе теплопередачи.
  
Внутренняя энергия идеального газа. Выражение для внутренней энергии с использованием теплоемкости при постоянном объеме; числа степеней свободы молекул.
Теплоемкость идеального газа при постоянном объеме – выражение через число степеней свободы. Теплоёмкость для одно-, двух- и многоатомных жестких молекул. Зависимость теплоемкости от температуры.
Одноатомная: i =3 Двухатомная жесткая: i =5 Многоатомная жесткая: i =6
Работа в термодинамике. Графическое выражение работы в координатах давление-объем.
Первое начало термодинамики для изохорного и изобарного процессов в идеальном газе. Получите формулу для связи молярных теплоемкостей при постоянном объеме и при постоянном давлении. Связь удельных теплоемкостей.
 
|
||||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 277; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.222.12 (0.006 с.) |