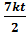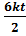Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
И 57 идеальный газ – простейшая модель реальных газов. Основное уравнение молекулярно-кинетической теории идеального газа. Получите основное уравнение мкт.
Идеальный газ – модель реального газа, согласно которой предполагается, что на расстоянии молекулы не взаимодействуют, а при ударах действуют только упругие силы отталкивания, размеры молекулы настолько малы, что они не занимают место в сосуде. Давление в газе обусловлено ударами молекул о стенки в сосуде. Основные положения МКТ: 1) Все тела состоят из частиц (атомов и молекул) 2) Частицы непрерывно и беспорядочно движутся 3) Частицы взаимодействуют друг с другом силами притяжения и отталкивания (на расстоянии частицы притягиваются, при столкновении – отталкиваются)
Уравнение МКТ:
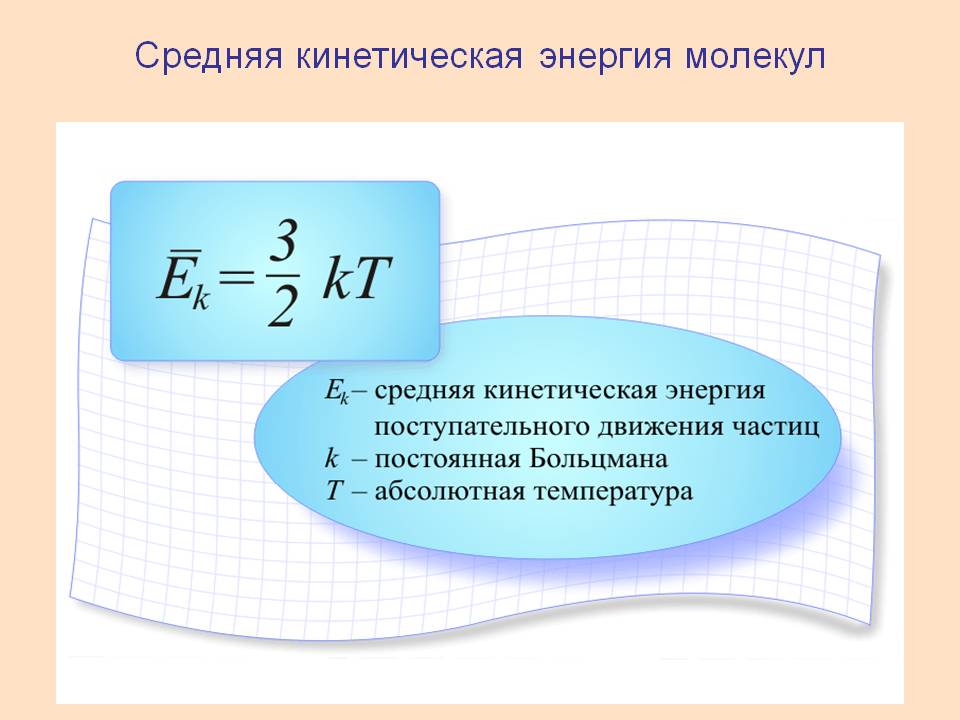
Средняя энергия поступательного движения молекул. Абсолютная температура в МКТ. Средняя квадратичная скорость.
Абсолютная температура – мера средней кинетической энергии поступательного движения молекул.
Параметры состояния газа. Уравнение состояния идеального газа в различных формах: для концентрации молекул, для заданного числа единиц, для заданного числа молей, для заданной массы, для плотности газа. Основными макропараметрами или параметрами состояния идеального газа являются: давление, температура и объем. Давление характеризует силу ударов молекул газа о стенки сосуда. Температура является мерой кинетической энергии поступательного движения молекул газа. Объем – это область пространства, занимаемая газом. Уравнение состояния идеального газа:
И 63 Степени свободы молекул. Постулат о равнораспределении энергии по степеням свободы. Энергия поступательного и вращательного движения различных молекул. Учет колебательного движения атомов в молекуле. Степени свободы молекулы – это количество независимых координат, с помощью которых однозначно задается положение молекулы (кол-во независимых движ., в которых может участвовать молекула). Постулат о равнораспределении энергии по степеням свободы: На каждую степень свободы молекулы в среднем приходится энергия Одноатомная: i = i поступ.=3 < E >=< E к поступ.> Двухатомная жесткая: i = i поступ.+ i вращ.=3+2=5 <E>=<Eк поступ.>+ <E вращ.>= Двухатомная нежесткая: i = i поступ.+ i вращ.+2* i колеб.=3+2+2=7 <E>=<Eк поступ.>+ <E вращ.>+ <E ср.колеб.>= Многоатомная жесткая: i = i поступ.+ i вращ=3+3=6
<E>=<Eк поступ.>+ <E вращ.>= 64-67 Распределение молекул газа по скоростям. Плотность вероятности. Формула для плотности вероятности распределения молекул идеального газа по скоростям (распределение Максвелла). Свойства распределения Максвелла. График распределения Максвелла. Наиболее вероятная скорость. Графики для одного газа при различных температурах, при одинаковой с раз-личной молярной массой. Средняя квадратичная и средняя арифметическая скорости. Молекулы газа, двигаясь хаотически, сталкиваются между собой, в результате скорость каждой из молекул может меняться. Проследив за движением одной из молекул, мы «увидели» бы, что в какие-то моменты времени она движется быстрее, в какие-то - медленнее. Но при большом числе молекул и при неизменных условиях относительное число «медленных» и «быстрых» молекул остается постоянным, т. е. устанавливается распределение молекул газа по скоростям. Закон, описывающий это распределение, был найден Д. К. Максвеллом в 1859 г. и называется распределением Максвелла. Идея плотности вероятности заключается в том, чтобы отразить изменение вероятности на конкретном элементе множества.
 
Свойства распределения Максвелла: 1) При v = 0 множитель v2 функции F(v) обращает ее в ноль. Это означает, что нет молекул, которые не двигались бы. 2) При v > 0 функция F(v) растет за счет множителя v2. Кривая имеет максимум. Это означает, что существует определенная скорость движения молекул, такая, что вблизи нее на данный интервал dV приходится наибольшая часть молекул. 3) При v → ∞ кривая быстро стремится к нулю за счет экспоненциального множителя. То есть кривая не симметрична: спад кривой в одну сторону больше, чем в другую.
|
||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 466; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.74.227 (0.005 с.) |




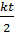 .
.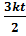 +
+ 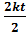 =
= 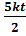
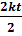 =
=