
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамика и теплотехникаСтр 1 из 18Следующая ⇒
А.В. КИРИС, В.В. ЛИСИН
ТЕРМОДИНАМИКА И ТЕПЛОТЕХНИКА УЧЕБНОЕ ПОСОБИЕ В двух частях Часть 1. ТЕРМОДИНАМИКА
Одесса - 2005
ББК 31.311 К 43 УДК 536 (075.8)
Кирис А.В., Лисин В.В. К 43 Термодинамика и теплотехника: Учебное пособие. В 2 ч. Ч.1: Термодина- мика. – Одесса: ОНМА, 2005. - 96 с.
Рецензенты: профессор ОНМУ Вассерман А.А., д.т.н.; профессор ОГАХ Дорошенко А.В., д.т.н.
Изложены: количественные и качественные соотношения при взаим- ном превращении теплоты и работы; термодинамические пути реализа- ции и принцип действия тепловых двигателей и холодильных установок; методы термодинамического анализа циклов, их основные преимущества и недостатки, пути повышения эффективности циклов тепловых двигате- лей и холодильных установок; истечение и дросселирование газов и па- ров. Учебное пособие предназначено для курсантов и студентов выс- ших морских учебных заведений по направлению подготовки 0925 «Автоматизация и компьютерно-интегрированные технологии».
Утверждено ученым советом ОНМА в качестве учебного пособия для направ- ления подготовки 0925 «Автоматизация и компьютерно-интегрированные техно- логии» и рекомендовано к печати 28 апреля 2005 г., протокол № 8.
© А.В.Кирис, В.В.Лисин, 2005
ОГЛАВЛЕНИЕ
ОСНОВЫ ТЕРМОДИНАМИКИ 1. Введение. Основные понятия и определения….........................................6 1.1. Рабочее тело…………………………………………………….………...7 1.2. Термодинамическая система…………………………………………....8 1.3. Параметры состояния…………………………………………………....8 1.4. Основные законы идеальных газов…………………………………….11 1.5. Контрольные вопросы……………………………………………….….11 2. Состояние термодинамической системы 2.1. Уравнение состояния. Объединенный газовый закон………………..12 2.2. Физический смысл газовой постоянной R……………………….…....13 2.3. Универсальное уравнение состояния идеального газа……………....14 2.4. Газовые смеси………..……………………………………….………....15 2.5. Способы задания смеси…………………………………………….......16
2.6. Расчет газовой смеси. Основные расчетные соотношения…………..16 2.7. Уравнение состояния для смеси……….……………………………....17 2.8. Контрольные вопросы………………………………………………….18 3. Первый закон термодинамики. Энергетические характеристики термодинамических систем 3.1. Теплоемкость…………………………………………………………....18 3.2. Закон Майера……………………………………………………….……19 3.3. Первый закон термодинамики …………………………………………20 3.4. Аналитическое определение и графическое изображение работы…..21 3.5. Теплота и работа в термодинамическом процессе………………..…..22 3.6. Внутренняя энергия……………………………………………………..23 3.7. Энтальпия…………………………………………………………….….24 3.8. Контрольные вопросы…………………………………………………..25 4. Основные термодинамические процессы 4.1. Методика исследования термодинамических процессов……….…....25 4.2. Изохорный процесс………………………………………………….….25 4.3. Изобарный процесс……………………………………………………..26 4.4. Изотермный процесс…………………………………………………....27 4.5. Адиабатный процесс…………………………………………………....28 4.6. Политропный процесс…………………………………………….…….30 4.7. Тепломкость политропного процесса…………………………….…....31 4.8. Определение численного значения показателя n …………………..….31 4.9. Взаиморасположение термодинамических процессов в р-v коор- динатах…………………………………………………………….……..33 4.10. Контрольные вопросы……………………………………………..…..34
5. Второй закон термодинамики 5.1. Круговые процессы……………………………………………………..34 5.2. Второй закон термодинамики………………………………………….36 5.3. Некоторые формулировки второго закона термодинамики……….....37 5.4. Обратимость термодинамических процессов………………………....37 5.5. Цикл Карно………………………………………………………............39 5.6. Свойства обратимых и необратимых процессов (аналитическое выражение второго закона термодинамики)………..…………….......40 5.7. Энтропия…………………………………………………………….…..42 5.8. Работоспособность (эксергия)…………………………………….…...43 5.9. Пределы применимости второго закона…….……………………...…44
5.10. Контрольные вопросы………………………………………………...44 6. Изменение энтропии в процессах. Энтропийные уравнения 6.1. Координатная система Т-s...…………………………………………....45 6.2. Обобщенный (регенеративный) цикл Карно……………….…….…...45 6.3. Среднеинтегральная температура………………………………….…..47 6.4. Энтропийные уравнения…………………………………………….….47 6.5. Изображение термодинамических процессов в Т-s координатной системе……………..………………………….……………………..….48 6.6. Перенос графиков из р-v в Т-s координатную систему…………........49 6.7. Контрольные вопросы……………………………………………….….49 7. Водяной пар 7.1. Уравнение состояния водяного пара……………………………….….50 7.2. Диаграмма Эндрюса…………………………………………………….51 7.3. Механизм парообразования………………………………………….....51 7.4. р-Т диаграмма…………………………………………………….……..52 7.5. Процесс парообразования в р-v диаграмме. Виды пара………….…..52 7.6. График парообразования в Т-s диаграмме……………………….…....54 7.7. Таблицы термодинамических свойств воды и пара…………….…….54 7.8. Теплота парообразования……………………………………………....55 7.9. Анализ параметров 3 фаз парообразования. Критические пара- метры воды…………….…………………………………………………56 7.10. Изменение энтропии по трем фазам парообразования………….…..56 7.11. Диаграмма i-s…………………………………………………………..57 7.12. Контрольные вопросы………………………………………………...58 8. Воздух 8.1. Влажный воздух………………………………………………………...58 8.2. Диаграмма i-d для влажного воздуха……………………………….…59 8.3. Контрольные вопросы……………………………………………….…60 ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА 9. Циклы паросиловых установок 9.1. Паровой цикл Карно…………………………………………………....60 9.2. Цикл Ренкина…………………………………………………………....61
цикла Ренкина………………………………………....62 9.4. Цикл с двойным перегревом пара……………………………………...62 9.5. Регенеративный цикл…………………………….……………………..63 9.6. Коэффициенты полезного действия…………….…………………….64 9.7. Контрольные вопросы………………………………………………….66 10. Циклы двигателей внутреннего сгорания 10.1. Цикл Отто (цикл быстрого горения с подводом теплоты при пос- тоянном объеме)..………….…………………………..……………....67 10.2. Цикл Дизеля (цикл медленного горения, с подводом теплоты при постоянном давлении)……….…………………………...…………....68 10.3. Цикл Тринклера (цикл со смешанным подводом теплоты)….……..69 10.4. Сравнение циклов ДВС………………………………………………..70 10.5. Контрольные вопросы………………………………………………....71 11. Циклы газотурбинных установок и реактивных двигателей 11.1. Газотурбинные установки. Общая характеристика………………....71 11.2. Цикл простейшей ГТУ……………………………………….………..72 11.3. Принцип работы реактивного двигателя…………………………….73
ГТУ………………………………………….74 11.5. Контрольные вопросы………………………………………………...76 12. Циклы холодильных установок 12.1. Холодильные установки морских судов…………………………......76 12.2. Циклы воздушных, пароэжекторных и абсорбционных холодиль- ных установок……………………………………………………….....78 12.3. Контрольные вопросы………………………………………………...80
13. Компрессоры 13.1. Компрессоры…………………………………………………………..80 13.2. Определение работы ступени идеального компрессора……………81 13.3. Цикл одноступенчатого компрессора………………………………..82 13.4. Контрольные вопросы………………………………………………...82 14. Истечение 14.1. Определение работы истечения газа или пара……………………....83 14.2. Определение скорости при истечении……………………………….84 14.3. Массовый секундный расход газа или пара при адиабатном рас- расширении…………………………………………………………….85 14.4. Форма струи при адиабатном истечении газа и пара…………….….85 14.5. Критическое отношение давлений…………………………………....87 14.6. Построение сопла для использования полного теплоперепада (сопла переменного сечения – сопла Лаваля)………………………………...87 14.7. Истечение через короткое цилиндрическое сопло……………….….89 14.8. Графики скорости, расхода и удельного объема…………………….90 14.9. Изохорное истечение газа и пара………………………………….….91 14.10. Адиабатное истечение с трением………………………….…….…..92 14.11. Дросселирование (мятие) пара………………………………….…...92 14.12. Контрольные вопросы…………………………………………….….93 Литература………..……………………………………………………….….94
Светлой памяти профессора Всеволода Феоктистовича Коваленко
ОСНОВЫ ТЕРМОДИНАМИКИ ВВЕДЕНИЕ. ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ В широком понимании термодинамика изучает законы превращения энергии в различного рода физических и химических процессах, сопровождающихся преобразованием теплоты в иные виды энергии (механическую, электрическую, химическую). Широта вопросов, охватываемых термодинамическим методом исследования, вызвала разделение термодинамики на отдельные специализированные области: - общая или физическая термодинамика, предметом изучения которой являются процессы превращения энергии в твердых, жидких и газообразных телах, излучение различных тел, магнитные и электрические явления, а также установление математических зависимостей между термодинамическими величинами; - химическая термодинамика изучает химические и физико-химические процессы и равновесие на основе законов общей термодинамики;
- техническая термодинамика рассматривает применение основных законов термодинамики к теплотехнике и хладотехнике. Техническая термодинамика – наука, изучающая процессы взаимного преобразования теплоты и работы в тепловых двигателях и тепловых машинах, а также свойства тел, которые участвуют в этих преобразованиях. Вся термодинамика базируется на трех экспериментально установленных законах термодинамики: I закон – «Для того, чтобы получить работу, необходимо тратить теплоту». Этот закон представляет собой приложение к тепловым явлениям всеобщего закона природы – закона превращения и сохранения энергии. II закон – «Для того, чтобы получить работу, необходимо отводить теплоту». Этот закон устанавливает условия протекания и направленность макроскопических процессов в системах, состоящих из большого количества частиц. Поэтому имеет более ограниченное применение. В начале ХХ века I и II законы термодинамики были дополнены еще одним опытным положением, названным III законом: «При абсолютном нуле (0оК) энергия равна нулю». Этот закон позволяет определить свойства тел при очень низких температурах, используется в химической термодинамике. Термодинамика в целом в первую очередь основывается на законе сохранения и превращения энергии. До середины XVIII века наука рассматривала теплоту как особое (невесомое, неуничтожаемое и несоздаваемое) вещество – теплород. Первым, кто опроверг этот взгляд, был М.В.Ломоносов (1744 г.). Он первым высказал идею закона сохранения энергии, хотя и без количественных соотношений. Техническая термодинамика, применяя основные законы к процессам превращения теплоты в механическую работу и наоборот, дала возможность разработать теорию тепловых двигателей, исследовать протекающие в них процессы и выявить их экономичность для каждого типа отдельно. Изучение процессов получения механической работы за счет затраченной теплоты началось после изобретения паровой машины. Это произошло в 1766 г. (по проекту И.И.Ползунова). Почти через 20 лет машины такого типа нашли широкое применение после усовершенствований, сделанных Уаттом (конденсация пара начала осуществляться в холодильнике). Первые паровые машины были крайне неэкономными (расход топлива составлял 25 кг/л.с.ч). Первым, кто указал на пути повышения экономичности тепловых двигателей, был инженер Саади Карно, который заложил основы технической термодинамики.
Рабочее тело
Рабочим телом в термодинамике называют некоторое промежуточное тело, при помощи которого осуществляется трансформация тепловой энергии в механическую в тепловых двигателях. Рассмотрим в общих чертах процесс преобразования тепловой энергии в механическую в основных типах тепловых двигателей – паротурбинных установках (ПТУ) и двигателях внутреннего сгорания (ДВС). В любой паротурбинной установке теплота от продуктов сгорания передается кипящей воде, которая превращается в пар, перегревается в пароперегревателе и поступает на рабочую часть турбины. Температура и давление пара перед турбиной гораздо выше, чем эти параметры окружающей среды, поэтому пар способен совершить работу, которую он и совершает в процессе адиабатного расширения на проточной части турбины. При этом давление и температура пара понижаются и отработавший пар поступает в конденсатор, где он конденсируется, отдавая свою теплоту парообразования. Образованный конденсат насосом подается в котел, цикл рабочего тела замыкается. Трансформация тепловой энергии продуктов сгорания в механическую энергию вращения ротора осуществляется в процессе изменения теплового и агрегатного состояния рабочего тела.
При работе ДВС рабочее тело получается в результате горения горючей смеси, подаваемой в пространство цилиндра между его крышкой и поршнем. Т.к. температура и давление рабочего тела больше температуры и давления окружающей среды, оно способно совершить работу, поэтому рабочее тело расширяется, передвигая поршень. Эта часть энергии непосредственно испольуется для работы и обратного движения поршня, которое происходит за счет части энергии, переданной через кривошипно-шатунный механизм маховику. В обоих примерах рабочим телом служил газ или пар. В качестве рабочего тела можно использовать твердое, жидкое, или газообразное вещество, но наиболее эффективно тепло переходит в работу в телах, резко меняющих свой объем при изменении температуры. Аналитическое исследование законов трансформации теплоты в работу с учетом реальных свойств рабочего тела (упругой жидкости) весьма затруднительно, так как при этом нужно учитывать силы взаимодействия между молекулами, их собственный объем и наличие их ассоциированных комплексов. Для упрощения исследования вводится понятие идеального рабочего тела – идеального газа. Идеальным газом называется упругая жидкость, у которой отсутствуют силы сцепления между молекулами, а сами молекулы представляют собой материальные точки (лишенные объема), обладающие свойствами абсолютно упругих шаров. Оказывается, что все технические газы (и воздух в том числе) по своим свойствам достаточно близки к идеальному газу, так как они сильно перегреты – расстояние между молекулами огромно и силы взаимодействия между ними ничтожны. Менее перегретые упругие жидкости уже не обладают свойствами идеального газа и поэтому называются газами реальными.
Термодинамическая система Термодинамической системой называется совокупность материальных тел, находящихся в энергетическом взаимодействии между собой и окружающей средой, например: газ в цилиндре с поршнем. Если термодинамическая система не обменивается энергией с окружающей средой и не взаимодействует с ней, ее называют изолированной системой. Система, состоящая из одной фазы вещества, называется гомогенной. Система, состоящая из нескольких гомогенных частей, имеющих поверхности раздела, называется гетерогенной. В термодинамическую систему входят отдельные тела, которые по своей роли делятся на источники теплоты (горячие источники ГИ), приемники теплоты (холодные источники ХИ) и рабочие тела. Такая термодинамическая система является объектом изучения технической термодинамики.
Параметры состояния Термодинамическим состоянием тела называется совокупность физических свойств, присущих данного телу. Величины, характеризующие физические свойства тела в данный момент, называются параметрами состояния. Непосредственному измерению поддаются три параметра состояния: давление p, удельный объем v и температура T, которые называются основными или термическими параметрами. К параметрам состояния относятся также внутренняя энергия u, энтальпия i и энтропия s, называемые калорическими параметрами состояния. Рассмотрим подробно основные параметры состояния. Давление– это результат силового воздействия молекул рабочего тела на стенки сосуда, в который оно помещено, или на поверхность тел, погруженных в рабочее тело. Давление вычисляется по выражению
(1) где F – сила, воздействующая на поверхность, Н; S – площадь поверхности, м2. В системе СИ давление измеряется в паскалях 1 Па = 1 Н/м2. Эта единица очень мала, поэтому пользуются кПа и МПа (1 кПа = 103 Па, 1 МПа = 106 Па).
Па = 0,1 МПа (что соответствует 750 мм.рт.ст.).
Па = 0,980665 бар (735,6 мм. рт.ст.). Часто измеряют давление высотой столба жидкости, создающей это давление и
, (2)
, (3) где h – высота столба жидкости, м;
- плотность, кг/м3;
- удельный вес, Н/м3; g – ускорение свободного падения, м/с2. Давление, создаваемое атмосферным воздухом, зависит от высоты. В среднем на уровне моря оно равно 1 атм. Эта величина называется физической атмосферой. Это давление соответствует 760 мм.рт.ст, 101332 Па при измерении манометром или 10,33 м водяного столба.
300 км. За пределом этого столба воздуха давление считают равным нулю.
Применяемые в технике манометры (и Рис. 1.
вакуумметры) фиксируют разность между абсолютным давлением рабс в месте измерения и внешним атмосферным (барометрическим) давлением (рис.1). Если давление в системе больше барометрического, то манометр измеряет разность давлений, которое называется избыточным (или манометрическим) дав- лением р изб = рабс – рбар. (4) Если давление в системе меньше барометрического, то имеет место вакуум, и вакуумметр показывает давление р вак = рбар – ра бс. (5) Следует иметь в виду, что во все формулы технической термодинамики входит значение абсолютного давления рабс = рбар + ризб либо рабс=рбар- рвак. Температура определяет направление перехода теплоты, т.е. выступает прежде всего как мера нагретости тела и согласно молекулярно-кинетической теории определяется как величина, соответствующая средней кинетической энергии поступательного движения молекул
, (6) где Т – температура, К; m – масса молекул, кг; к – постоянная Больцмана. Т.к. непосредственно измерять кинетическую энергию нельзя, для измерения температуры пользуются зависимостью какого-либо свойства вещества (тепловое расширение, э.д.с. соприкасающихся металлов, электросопротивление, интенсивность излучения и др.) от температуры. Первый термометр был изготовлен Г.Галилеем в 1597 г. Действие всех термометрических устройств основано на том, что два соприкасающихся тела через некоторое время приходят к состоянию теплового равновесия, т.е. принимают одинаковую температуру. Существуют две основные температурные шкалы: - термодинамическая температурная шкала характеризуется тем, что нулевая точка этой шкалы представляет собой наинизшую термодинамически возможную температуру – абсолютный 0; - международная практическая температурная шкала 1948 г. основывается на шести реперных точках с фиксированными значениями температуры (точка кипения кислорода, тройная точка воды, точки кипения воды и серы, точки затвердевания серебра и золота). Удельный объем – объем, занимаемый единицей массы вещества
м3/кг, (7) где V – объем вещества, м3; m – масса вещества, кг. Обратная величина называется плотностью
кг/м3. (8)
Газовые смеси
В технике очень часто приходится иметь дело с газообразными веществами, близкими по своим свойствам к идеальным газам и представляющими механическую смесь отдельных газов. Это продукты сгорания ДВС, ГТУ, реактивных двигателей и многих других тепловых двигателей. Газовой смесью называется смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси. Парциальным называется давление отдельного i-го компонента смеси на стенки сосуда. По закону Дальтона абсолютное давление смеси идеальных газов равно сумме парциальных давлений ее компонентов
. (20) Таким образом, каждый компонент смеси занимает весь объем смеси vсм и находится под своим парциальным давлением pi. Но если этот компонент будет находиться под давлением рсм при той же температуре Тсм, то он займет объем vi, меньший объема смеси. Парциальным, или приведенным объемом, называется объем данного компонента vi, который он имел бы, если бы находился при полном давлении смеси и ее температуры. Понятие парциального объема необходимо для того, чтобы сравнивать разные количества газов (складывать, делить). А это можно сделать только с такими объемными количествами газов, которые находятся в одинаковых условиях (т.е. имеют одинаковые Т и р). Согласно закону Амага
. (21) Для доказательства закона Амага воспользуемся законом Бойля-Мариотта (так как температура компонента смеси, заполняющего весь объем смеси vсм и при приведенном объеме vi одинакова), которым свяжем два состояния каждого компонента рабочего тела – 1 – при объеме vсм и парциальном давлении, и 2 – при парциальном объеме и давлении рсм р1 v см = v 1 p см, р2 v см = v 2 p см ,…, р n v см = v n рсм . Произведем сложение правых и левых частей vсм(p 1 +…+ p п) = рсм (v1+…+v п). Так как р1+…+р n = p см, v1+…+v n =vсм. Все параметры газовой смеси могут быть вычислены по закону Клапейрона, p V= mRT, где все величины, входящие в уравнение, относятся к смеси газов. Задачей расчета газовой смеси является определение, на основании заданного газового состава смеси, газовой постоянной или средней молярной массы. Остальные параметры можно вычислить по уравнению состояния. Уравнение состояния для смесей можно записать в виде f (p, v, T, z) = 0. 2.5 Способы задания смеси
Состав смеси газов может быть задан массовыми, объемными и мольными долями. Массовой долей каждого компонента называется отношение массы данного компонента к массе всей смеси
. (22) Так как смесь состоит из n компонентов, то общая масса m см = m 1 + m 2 +…+ m п. (23) Из последних двух выражений следует, что
. (24) Объемной долей компонентов называется отношение приведенного объема компонента vi к объему всей смеси vсм, т.е.
(сумма числителей при общем знаменателей vсм по закону Амага равна vсм).
. При этом вводится понятие числа киломолей смеси, которое равно сумме киломолей всех компонентов смеси
. (25)
Теплоемкость Для того, чтобы два различных вещества с одинаковой массой нагреть до одинаковой температуры, нужно затратить разное количество тепла. Так на нагревание воды тепла нужно в 9 раз больше, чем для железа. Следовательно, каждое тело обладает своей теплоемкостью. Теплоемкостью называют количество тепла, необходимое для нагревания данного тела. Обычно сообщение телу тепла вызывает изменение его состояния и сопровождается изменением температуры, что является следствием изменения кинетической энергии молекул.
теплоемкости при нормальных физических условиях, т.е. при р = 101332 Н/м2 и t = 0oC). Между указанными теплоемкостями легко установить связь
, (36)
где v o – удельный объем при нормальных условиях,
В определении средней удельной теплоемкости подчеркнуто, что с находится в заданном интервале температур, т.е. теплоемкость зависит от температуры. Действительно, у подавляющего большинства веществ с растет с ростом температуры. У газов с еще незначительно зависит от давления, т.е. с = f (t, p). Экспериментальные исследования показали, что полученные значения темплоемкостей часто сильно расходились с данными классической молекулярно-кинетической теории. Большую сходимость Рис. 5 имели только опыты при сравнительно невысоких t. Дальнейшее развитие науки о строении вещества (квантовая теория), показало, что при теоретическом определении с необходимо учитывать не только атомность газов, но и энергию внутримолекулярных колебаний атомов.
.
не совпадают). На практике используются значения с, полученные для процессов подвода тепла при р = const (ср) и v = const (с v). Значения теплоемкостей для прочих процессов рассчитываются по специальным формулам.
Закон Майера
. Для этого нужно подвести тепло, в первом цилиндре q v, а во втором – qp. При этом q v =с v (T2- T1), qp=с p(T2- T1). Рис. 6 Очевидно, что qp > q v, так как во втором случае теплота будет расходоваться не только на нагрев газа, но и на совершение работы (рис.6).
, или
Отсюда получим закон Майера: с p -с v = R. (37) В теплотехнических расчетах применяется отношение с p/с v =к, которое называется показателем адиабаты. Т.к. с p> с v, то к>1. С удовлетворительной инженерной точностью применительно ко всем двухатомным газам и воздуху можно считать с p и с v постоянными и равными: с p = 1,004 кДж/кг град; с v = 0,716 кДж/кг град.
.
Первый закон термодинамики Согласно закону сохранения и превращения энергии, последняя не может быть ни создана, ни уничтожена, а может быть только преобразована из одного вида в другой при различных физических и химических процессах. Исторически для измерения отдельных видов энергии принимались различные единицы – калории, кгм, джоули, кВт·ч, л.с.· ч и т.д. В связи с этим превращение энергии происходит не в численно равных, а в эквивалентных отношениях. Из физики известен тепловой эквивалент единицы работы: 1 кгм = 1/427 ккал. Известны также следующие соотношения: 1 л.с.· ч = 632,3 ккал = 0,735 кВт ч; 1 кВт ч = 860 ккал. Раньше нами было отмечено, что I закон является частным случаем всеобщего закона сохранения и превращения энергии применительно к процессам, протекающим в термодинамических системах. В общем случае I закон можно сформулировать следующим образом: “Полная энергия изолированной термодинамической системы при любых происходящих в системе процессах остается неизменной”. Лишь через 100 лет после выводов Ломоносова, после его общей формулировки закона сохранения энергии, в 1842 г. Роберт Майер на основании опытов установил прямую пропорциональность между затраченной теплотой Q и полученной работой L и определил количественное соотношение между ними (если Q и L выражены в Дж): Q = L. (38) Раз теплота затрачена – она исчезла, в результате этого получена работа и наоборот. Т.е. применительно к тепловым и механическим явлениям первый закон может быть сформулирован следующим образом: “Когда исчезает определенное количество тепловой энергии, возникает эквивалентное количество механической энергии (в виде совершенной работы) и наоборот”. Утверждение первого закона способствовало прекращению попыток построить двигатель, вырабатывающий механическую энергию без потребления какого-либо другого вида энергии (например, выделяющейся при горении топлива) – «perpetuum mobile первого рода». Уравнение первого закона в данном виде недостаточно полно характеризует баланс энергии в процессах изменения состояния газа. Эти процессы обычно протекают при теплообмене с газом, поэтому рассмотрим составляющие этого теплообмена.
. Кроме этого, изменятся все виды энергии, присущие состоянию молекул – т.е. изменится внутренняя энергия газа. Таким образом, теплота расходуется на изменение внутренней энергии и совершение работы
. (39) Из описания работы тепловых двигателей видно, что в термодинамике рассматривают две резко различающиеся группы физических изменений газа. В поршневых двигателях движение газа не значительно и им можно пренебречь.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 93; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.173.112 (0.197 с.) |
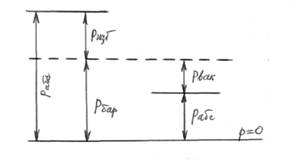 Давление тела измеряется манометрами, барометрами и вакууметрами, устройство которых основывается на уравновешивании усилий, передающихся от тела (уравновешивание осуществляется посредством веса столба жидкости, деформаций пружин или нагрузкой на поршень).
Давление тела измеряется манометрами, барометрами и вакууметрами, устройство которых основывается на уравновешивании усилий, передающихся от тела (уравновешивание осуществляется посредством веса столба жидкости, деформаций пружин или нагрузкой на поршень).


