
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аналитическое определение и графическое изображение работы
Пусть происходит процесс 1-2 расширения рабочего тела в цилиндре. Масса тела 1 кг. Если этот процесс разбить на бесконечно малые элементы, то в каждом элементе давление р можно считать постоянным, принимая его среднее для элемента значение (рис. 7). Если площадь поршня f, то при перемещении ds он совершает работу pfds, где pf – сила,
. Рис. 7
Если в процессе расширения участвует m кг газа, то, рассуждая аналогично предыдущему
, (41) т.е. работа m кг газа в m раз больше работы 1 кг газа. При аналитическом решении для вычисления интегралов должна быть задана зависимость p = f (v). При решении задачи в графической форме используется кривая 1-2 в p-v координатной системе. Из курса математики известно, что площадь S под кривой p = f ( v ) определяется по выражению
, (42) т.е. тем же интегралом, что и работа расширения газа. Отсюда следует, что площадь под кривой любого процесса в p – v диаграмме измеряет работу расширения газа. Из рисунка видно, что как работа расширения, так и работа сжатия зависит не только от начального и конечного состояний тела, но и от характера термодинамического процесса, в котором рабочее тело переходит из одного состояния в другое.
Теплота и работа в термодинамическом процессе Понятие теплоты и работы связано не с термодинамическим состоянием, а с термодинамическим процессом. Термодинамическим процессом называется последовательное изменение состояния тела, происходящее в результате энергетического взаимодействия рабочего тела с окружающей средой. Это энергетическое взаимодействие между телами может осуществляться двумя принципиально различными способами. Первый способ передачи энергии представляет собой процесс силового взаимодействия одного тела с другим, сопровождающейся перемещением другого тела. При этом первое тело совершает над вторым механическую работу L, измеряемую произведением силы на путь перемещения точки приложения силы. В технической термодинамике рассматривается механическая работа, совершаемая рабочим телом не только при перемещении, но и при изменении объема тела.
Работа, отдаваемая телом, считается положительной, а работа, совершаемая над телом – отрицательной. Единица измерения – Дж = Н∙м. Второй способ передачи энергии связан с наличием разности температур. Передача энергии осуществляется либо путем непосредственного соприкосновения тел с различной температурой, либо с помощью излучения. В этом случае количество переданной энергии называется теплотой Q, а сам процесс – теплопередачей. Количество полученной теплоты - положительное, отданной – отрицательное. Единица измерения теплоты – Дж и внесистемная единица - ккал. 1ккал = 4,187 ∙103 Дж. Таким образом, работа и теплота являются двумя способами (формами) передачи энергии в термодинамическом процессе. Обычно в термодинамическом процессе происходит одновременная передача энергии. В зависимости от соотношения между энергией, переданной тем или иным способом, различают и процессы. Так, при L = 0 процесс изохорный, процесс без теплообмена (Q = 0) называется адиабатным. Работа и теплота отличны от нуля только при наличии процесса. Определенному состоянию тела или системы не соответствует какое-либо значение L или Q. Несмотря на общность понятий работы или теплоты как меры переданной энергии в процессе, между ними имеется качественное различие. Энергия, передаваемая первым способом, может непосредственно (без предварительного преобразования) израсходоваться на увеличение любого вида энергии, а теплота непосредственно может израсходоваться только на увеличение внутренней молекулярной энергии.
Внутренняя энергия При изучении термодинамических преобразований теплоты в работу под величиной внутренней энергии понимают тот запас, который был обусловлен тепловым (хаотическим) движением молекул. Внутренняя энергия складывается из: а) кинетической энергии поступательного движения молекул; б) кинетической энергии вращательного движения молекул; в) внутримолекулярной энергии, т.е. энергии внутримолекулярных колебаний атомов.
При обычных температурах внутренняя энергия характеризуется поступательным, при повышенных температурах – поступательным и вращательным, а при очень высоких температурах– поступательным, вращательным и колебательным движением молекул. У реального рабочего тела, так как между молекулами существуют силовые взаимодействия, к отмеченным трем составляющим прибавляется потенциальная энергия взаимодействия молекул, зависящая от расстояния между молекулами и от их взаимного притяжения. Величина этой составляющей связана с величиной удельного объема. На основании данных многочисленных аналитических и теоретических исследований установлено, что с допустимой инженерной погрешностью внутренняя энергия для идеального газа является функцией только температуры, а ее изменение возможно только при изменении температуры
Для реальных газов (паров) u является функцией еще и v или p. Опытным путем также легко установить, что для реальных газов, далеких от перехода их в жидкую среду, u = f (t). Для этого рассмотрим классический опыт Джоуля. Два железных цилиндра помещены в калориметр. Внутри цилиндра А р = 20 бар, а в цилиндре В избыточного давления воздуха нет. В калориметре известна t 1. Затем открывался кран и после устaновления в А и В равного давления измерялись t 2. Оказалось, что t 1 = t 2. Здесь, по условиям опыта, Q = 0, L = 0, тогда u 2 – u 1 = 0, т.е. внутренняя энергия зависит только от температуры. Таким образом, u от характера термодинамического процесса не зависит и является параметром состояния, т.е. зависит только от начальной и конечной температур процесса. Поэтому для всех термодинамичеcких процессов изменение внутренней
u производится по одной формуле:
u = c v (T 2 – T 1). (43)
Энтальпия Рассмотрим уравнение I закона dq = du + pd v. Так как pd v = d (p v) – v dp, то dq = du + d (p v) – v dp или dq = d (u + p v) – v dp. Функция u + p v введена в практику тепловых расчетов известным физиком Гиббсом и названа энтальпией. Удельная энтальпия, т.е. энтальпия, отнесенная к 1 кг, обозначается i. Так как все параметры (u, p и v), определяющие энтальпию, являются параметрами состояния, энтальпия тоже параметр состояния. dq = di – v dp. (44) При p = const dq = di или q = i 2 – i 1. (45) Таким образом, энтальпией называется количество теплоты, необходимое для нагревания 1 кг рабочего тела от 0оС до заданной температуры при p = const. Обычно для упрощения расчетов применяется i = 0 при 0оС, хотя по физическому смыслу предусматривается нагревание от 0оК. Физический смысл энтальпии понятен из примера.
Тогда mgh = phs (где s – площадь поршня). hs – удельный объем газа (т.к. его масса 1кг) mgh = p v. Произведение pv – это работа, которую нужно затратить, чтобы газ объемом v ввести во внеш- Рис. 8 нюю среду с давлением р. Если внутренняя энер гия газа равна u, то u + p v = i - это полная энергия
рабочего тела и окружающей среды.
3.8 Контрольные вопросы 1. Что такое средняя удельная теплоемкость? 2. Чему равны теплоемкости рабочего тела в основных процессах? 3. Почему ср больше сv? 4. Запишите выражения, связывающие между собой ср и сv. 5. Приведите основные формулировки первого закона термодинамики. 6. Приведите аналитические выражения первого закона термодинамики. 7. Что такое теплота и работа? Покажите, что теплота и работа являются функцией процесса. 8. Что такое внутренняя энергия? 9. Что такое энтальпия? В чем заключается физический смысл энтальпии?
|
|||||||||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 151; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.54.63 (0.019 с.) |
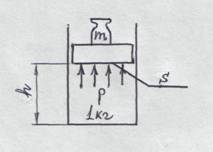 Потенциальная энергия гири равна mhg. Масса гири уравновешивается давлением под поршнем р (рис. 8).
Потенциальная энергия гири равна mhg. Масса гири уравновешивается давлением под поршнем р (рис. 8).


