Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гематология пресноводной рыбыСодержание книги
Поиск на нашем сайте
НОВОСИБИРСКИЙ ГОСУДАРСТВЕНЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ ГЕМАТОЛОГИЯ ПРЕСНОВОДНОЙ РЫБЫ Учебное пособие Новосибирск 2002 УДК ББК П
Рецензент профессор Р.Б.Козин
Пищенко Е.В. Гематология пресноводной рыбы: Учебное пособие/ Новосиб. гос. аграр. ун-т.- Новосибирск, 2002.-с.
В учебном пособии подробно описаны основные форменные элементы крови и патология крови рыб при различных заболеваниях. Приведены методики определения форменных элементов крови. Учебное пособие предназначено для студентов зооинженерного факультета, изучающих курсы «Рыбоводство» и Физиология животных» Утверждено и рекомендовано к изданию методической комиссией зооинженерного факультета Новосибирского государственного аграрного университета
Ó Пищенко Е.В., 2002 ÓНовосибирский государственный аграрный университет, 2002
I. КРОВЬ, ЕЁ СОСТАВ И ОСНОВНЫЕ ФУНКЦИИ В систему крови входят: кровь, циркулирующая по сосудам; органы в которых происходит образование клеток крови и их разрушение; регулирующий нейро-гуморальный аппарат. Кровь состоит из форменных элементов и жидкой части — плазмы. Форменные элементы крови разделяются на 3 группы: эритроциты (красные кровяные тельца), лейкоциты (белые кровяные тельца) и тромбоциты (кровяные бляшки). Количество форменных элементов более или менее постоянно у одного и того же вида животных, но может значительно изменяться при заболевании организма. Поэтому определение количества форменных элементов является важным диагностическим признаком при заболевании человека или животных. Количество тех или иных форменных элементов принято выражать со- держанием их в 1 л крови. Нормой для человека является содержание 4,5-6 ´1012 л эритроцитов и 6- 8´106 л лейкоцитов. У рыб количество форменных элементов различно для разных видов. Так, например, у ручьевой и радужной форели эритроцитов в среднем 1,1 ´1012 л, у карпа - 1,5, у щуки — 1,9 млн.; количество лейкоцитов у них соответственно равняется 25—35 ´106л, 35-85 и 37´106 л.
Морфология системы крови Кроветворение (гемопоэз) как процесс гистогенеза является ответной реакцией ряда тканевых систем организма рыбы на изменение как внешних, так и внутренних факторов. Систематизация клеток крови и понимание гемопоэза возможны лишь на основе глубокого и всестороннего изучения морфологии системы крови. Исследование органов, участвующих в гемопоээе рыб, позволяет установить качественный состав и структурные особенности клеток крови на разных этапах развития. Кроветворными органами рыб являются жаберный аппарат, кишечник, селезенка, почки и др. О характере и степени кроветворной активности жаберного аппарата и других органов свидетельствуют данные, представленные в табл.1.
Рядом авторов [7] установлено, что жаберный аппарат у современных осетровых и костистых рыб, являясь пограничным органом, наряду с дыхательной и другими функциями участвует и в кроветворении. Рассматривая жаберный аппарат как орган, участвующий в кроветворении, следует подчеркнуть, что из эпителия спинной части жаберных мешков развивается еще один орган эндокринной системы рыб - вилочковая железа (зобная) - Glandula thymus. Она состоит из соединительнотканной стромы и лимфоцитов, заключенных в эпителиальную капсулу. Сверху железа прикрыта плот- ной соединительной тканью. У рыб тимус имеет различную форму и расположение. Во время роста и развития железа сильно увеличивается, в неё врастают соединительная ткань, кровеносные сосуды, и она разделяется на две лопасти. К концу метаморфоза в ней можно различать корковый и мозговой слои. Лимфоциты сосредоточены в основном в мозговом слое. Позднее железа делится на части и обрастает жировой тканью. В настоящее время установлено, что кроме общеизвестных функций в вилочковой железе животных и человека образуются Т-лимфоциты, составляющие основную массу иммунных клеток. Таблица 1 Содержание форменных элементов в сосудистой крови и органах, иссле- дованных на гемопоэз (в %)
Другим органом кровообразования являются лимфатические фолликулы. Они представляют собой очаговые образования кроветворной ткани, способной к постоянному продуцированию форменных элементов крови. В слизистой кишечника исследуемых видов рыб подэпителиальные лимфатические участки являются своего рода резервуарами, за счет которых происходит постоянное пополнение форменных элементов белой крови, преимущественно агранулоцитов, в том числе лимфоцитов, которые в основном расходуются при выполнении защитной и ферментативной функций. У рыб всякий пограничный орган, независимо от специальной функции, если судить по составу форменных элементов крови, несёт и функцию защиты. Указания о том, что слизистая желудка у костно-хрящевых, двудышащих и поперечноротых приобретает характер лимфоидной ткани, имеются у Е.К. Суворова [17], И.И Шмальгаузена [23] и др. Данные Ивановой Н.Т. [8] указывают на наличие лимфоидных образований в слизистой пищеварительных органов не только осетровых, но и костистых рыб. Следующий кроветворный орган - селезенка. Кроветворная ткань в ней представлена парными телами овальной формы. Основу этих органов составляют ретикулярный синцитий и множество форменных элементов крови, в том числе молодых. Многие авторы [7,23] считают, что селезенка у рыб служит органом эритропоэза. Данные Н.Т.Ивановой [8] показывают, что кроме эритропоэза в селезенке рыб осуществляется и лимфогранулопоэз. По данным зарубежных и отечественных гематологов, одним из основных органов кроветворения у рыб являются почки. У многих рыб они представлены двумя лентами, тянущимися вдоль позвоночника.У взрослых особей гистологическая структура почек включает ретикулярную ткань. Стенки мочевыделительных канальцев построены из однослойного цилиндрического эпителия. Мочевыделительные канальцы разделены прослойками ретикулярной ткани. В составе этой промежуточной массы содержатся кровеносные сосуды и форменные элементы крови всех категорий, на разных стадиях развития. Сердце, кроме функции центрального органа кровообращения, считается у рыб одним из очагов гемопоэза. У зародыша из ткани, отделившейся от спинного сомита, в первую очередь формируются сердце и кровеносные сосуды, по которым первоначально течет бесцветная кровь, лишенная клеток [24]. Через некоторое время появляются форменные элементы крови. Источники развития форменных элементов крови и взаимоотношение клеток крови пока изучены слабо. Лишь общность происхождения всех форменных элементов крови из единого источника является общепризнанной. Основную массу сердца составляет миокард. Он состоит из продольных и радиально разветвленных мышечных поперечно-полосатых пучков [17]. Внутренние полости желудочков и предсердий выстланы эндокардом, в состав которого входят тончайшие эластичные волокна и клетки однослойного плоского эпителия, составляющие основную массу внутренней выстилки сердца. По материалам А.А. Заварзина [7] и др., эпителиальный слой сердца и эндотелий сосудов служит источником образования клеток крови в этой системе органов. Поверхностный слой - эпикард - состоит из соединительно-тканных эластических волокон и клеток плоского эпителия.
Кроме того, у рыб имеются специальные кроветворные (лимфоидные) органы в виде парных тел овальной формы. Основу этих органов составляют ретикулярный синцитий и множество форменных элементов крови, в том числе молодых. Относительная масса этих органов нередко больше относительной массы почек и селезенки, вместе взятых, что одновременно с подсчетами форменных элементов крови всех категорий указывает на их мощность. Возникновение этих специальных органов произошло, вероятнее всего, одновременно со сменой первичных почек вторичными. Как показывает расположение лимфоидного органа, отщепление и метаморфоз предпочки произошли раньше, чем окончательно сформировалась черепная коробка. Поэтому эти кроветворные органы у хрящевых и костно-хрящевых рыб, оказались под крышкой черепа над продолговатым мозгом. Содержание форменных элементов крови в органах, исследованных на гемопоэз (жаберный аппарат, кишечник, сердце, почки, селезенка, лимфоидный орган), в сосудистой крови и распределение по классам свидетельствуют о том, что наряду с основными функциями в них осуществляется нормальный процесс гемопоэза за счет кроветворной ткани, входящей в состав этих органов. Среди ученых, исследовавших кроветворение и органы кроветворения у рыб, нет единого мнения, какой орган считать основным в процессе кровеобразования, а какой - второстепенным. Некоторые авторы отдают предпочтение почкам, некоторые селезенке. Ряд авторов [8,14] предполагает равноценную роль этих двух органов в процессе гемпоэза. У рыб преобладающей формой клеточных элементов всегда являются лимфоциты, нередко составляющие 90% и более. В период активного питания резко возрастает количество гранулоцитов.
Сапролегниоз икры карпа Сапролегниоз - грибковое заболевание, которое вызывается Saprolegnia parasitica, S. monoica и др. Анализ морфологической картины крови эмбрионов (на стадии пигментации вдоль спины), развивающихся в пораженных и здоровых икринках, показал наличие в ней проэритробластов, первичных эритробластов и нормобластов, гемоцитобластов, миелобластов, промиелоцитов и лимфоидных элементов [5]. Замечено, что в крови эмбрионов, развивающихся в пораженных икринках, миелоидные клеточные структуры встречаются в единичных экземплярах, тогда как в крови они довольно часты, что свидетельствует о задержке развития. В крови таких эмбрионов имеются бластные клетки на стадии митотического деления. Отмечена вакуолизация ядра.
Дактилогироз карпа Дактилогироз карпа вызывается моногенетическими сосальщиками рода Dactylogyrus, паразитирующими на жаберных лепестках рыб. Гематологичеие показатели при дактилогирозе изучали ряд исследователей [1, 18, 5]. Изучение показателей красной крови показывает, что содержание гемоглобина и эритроцитов снижается незначительно, резко уменьшается показатель СОЭ. Это объясняется увеличением в крови до 41% молодых форм эритроцитов, следствием чего являются полихроматофильная анемия и анизоцитоз. В лейкоцитарной формуле происходят существенные изменения: число лимфоцитов постепенно уменьшается, а моноцитов, напротив, возрастает. Происходит постепенное увеличение числа гранулоцитов за счет количества эозинофилов, отсутствующих в норме. Эозинофилия является единственным процессом, характеризующим лейкоцитоз при дактилогирозе. Среди лейкоцитов отмечены клетки, морфологически отличающиеся от типичных форм. Очень часто встречаются моноциты с вакуолизированным ядром и цитоплазмой. В группе лимфоцитов имеются клетки с комковатой и груботяжистой структурой ядра, встречаются лимфобласты. Цитоплазма отдельных нейтрофильных гранулоцитов окрашена в серовато-дымчатый цвет, гранулы четко просматриваются и сконцентрированы у края цитоплазмы. Подобные изменения в морфологии лейкоцитов обычно появляются при анемиях.
Кавиоз сеголетков карпа Кавиоз - гельминтозное заболевание, вызываемое паразитированием в кишечнике карпа гвоздичника Khawia sinensis. Известно, что невысокие интенсивности инвазии (до 10 гельминтов) существенно не отражаются на содержании гемоглобина, числе эритроцитов и лейкоцитов [9, 3, 10]. Однако лейкоцитарная формула таких рыб отличается от таковой у незараженных рыб. В крови зараженной рыбы полностью отсутствуют базофилы (у незараженной рыбы 2,5%) и, наоборот, имеются псевдоэозинофилы (1,89%), которые отсутствуют у незараженных рыб. Почти в 2 раза возрастает число псевдоэозинофилов, а в соотношении молодых и зрелых иейтрофилов у зараженных рыб отмечается сдвиг в сторону последних (0,94 и 2,05% вместо 1,17 и 0,8%).
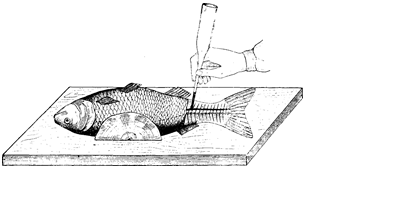
ВЗЯТИЕ КРОВИ Существует несколько методов взятия крови у рыб. Так, ее получают непосредственно из сердца с помощью шприца [11]. При этом инъекционную иглу, наклоненную в сторону головы, рекомендуется вводить по средней линии тела между грудными плавникам (рис.1). Из хвостовой артерии кровь берут иглой Франка. У сеголетков кровь получают из подкожной артерии также инъекционной иглой или пастеровской пипеткой. Прокол проводят в точке пересечения средней горизонтальной и вертикальной линии, идущей от передней части анального плавника (рис.2).
Рис. 1 Место введения иглы при взятии крови из сердца рыб по Кудрявцеву и др., 1969)
Рис. 2 Место прокола для получения крови и кроветворной ткани у рыб (по Кудрявцеву и др., 1969): 1- у сеголетков; 2- у рыб старшего возраста; 3 -место прокола для взятая кроветворной ткани у костистых рыб Рис. 3 Взятие крови у рыб.
У рыб старших возрастных групп кровь берут из хвостовой артерии. Иглу от шприца или пастеровскую пипетку вводят в точке пересечения средней продольной линии и линии, идущей перпендикулярно ей от задней границы анального плавника (см. рис. 2). Из жаберной и хвостовой артерии кровь забирают иглой от шприца или системы забора крови в зависимости от возраста рыбы. Позади анального плавника вытирают полотенцем покрывающую кожу слизь, в этом месте делают препаровальной иглой прокол кожи, в который вводят иглу или пастеровскую пипетку вглубь тканей под углом 45° по направлению несколько вперед к голове до встречи с позвоночным столбом. Здесь проходит ствол хвостовой артерии. Наклоненную вперед иглу вращают до поступления в нее крови. Во всех случаях полученную кровь переносят на часовое стекло, из которого ее берут микропипеткой для дальнейших анализов.
Кровь можно получить и путем отсечения хвостового стебля. Для прижизненного исследования кроветворной ткани рыб также используют шприц, снабженный прочной иглой с относительно широким просветом, или специальную иглу, применяемую в медицине для взятия костного мозга. У хрящевых и костных ганоидов кроветворные органы располагаются под крышей черепа над продолговатым мозгом в месте его перехода в спинной мозг. У костных рыб кроветворная ткань концентрируется в затылочной части черепа с внешней стороны. Так, у щуки кроветворные органы расположены от второго до шестого позвонка. В этой же области органы гемопоэза концентрируются у ряда различных представителей карповых и многих других костистых рыб. Они надежно защищены мышечной, соединительной и другими тканями. Полученную каплю пунктата помещают на предметное стекло. Препарат изготовляют и обрабатывают подобно мазку сосудистой крови.
Свойства крови в зависимости от способа ее взятия. Состав крови рыб различается в зависимости от способа ее взятия. При пункции сердца получают венозную кровь в конце ее полного круга обращения. Из жаберной артерии получают ту же кровь, что и из сердца, но после ее обогащения кислородом в жабрах и частичного освобождения от метаболитов. Кровь, взятая пастеровской пипеткой из гемального канала хвостового стебля, — это артериальная кровь вместе с некоторой примесью венозной; при этом разрушаются хвостовая артерия, хвостовая вена и сосуды хвостовой мускулатуры. При взятии крови путем отрезания хвостового стебля к ней примешивается тканевая жидкость, что может исказить показатели. Так, в крови, взятой у карпов путем отсечения хвоста, была выше активность глутама-токсало-ацетат-трансаминазы, лактатдегидрогеназы; выше содержание креатина, неорганического фосфора; ниже активность кислой фосфатазы. Не зависят от способа взятия крови содержание белка, глюкозы, мочевины, холестерина, креатинина, магния, активность глутамат-пируват-трансаминазы, щелочной фосфатазы, лейцин-аминопептидазы, амилазы, холинэстеразы. После взятия крови в количестве 1% от массы тела в плазме форели отмечено увеличение содержания калия и уменьшение общего белка, холестерина, фосфора, кальция, магния. Анализируемая кровь должна быть свежевыпущенной, жидкой. Для получения сравнимых результатов исследования необходимо проводить в сходных условиях. Общее количество крови у рыб варьирует от 1,1 до 7,3% [14].
Стабилизация крови, ее причины. Для предотвращения свертывания взятой крови применяют стабилизаторы. Кровь, лишенная способности свертываться, называется стабилизированной. Стабилизаторы устраняют ионы кальция и препятствуют образованию тромбина. При взятии крови для обработки инструментов используются следующие водные растворы: лимоннокислого натрия (цитрат) или щавелевокислого натрия (оксалат) - 0,2%-й, гепарин (антикоагулянт быстрого действия) — 1000 ЕД/мл. Гепарин используют для обработки гематокритных капилляров, и для этой же цели применяют раствор Геллера и Пауля: 1,2% оксалата аммония в смеси с оксалатом калия — 0,8%. Кроме того, можно применять с целью стабилизации раствор трилона Б. При получении плазмы кровь сразу же смешивают со стабилизатором из расчета на 100 мл крови 0,3 г цитрата или 0,15 оксалата, однако лучше пользоваться гепарином (примерно 0,01%). Можно проводить стабилизацию полученной крови посредством омывания пробирок несколькими каплями трилона Б с последующей их просушкой. При обработке рабочих игл гепарином непосредственно перед взятием крови, как правило, дополнительных средств для стабилизации не требуется. Сыворотку крови получают без стабилизации, когда образовался сгусток (фибрин + форменные элементы), путем ее отсасывания после отстаивания или центрифугирования. Сыворотка — это дефибринированная плазма. Быстрое отделение от клеточной массы — непременное условие максимального сохранения свойств плазмы (сыворотки). Для полного отделения форменных элементов крови от плазмы на обычных центрифугах достаточно центрифугирования в течение 10 мин при 3000 об/мин. Используются и другие режимы с учетом фактора разделения. Плазма имеет плотность 1,022-1,029 г/см3. Ее можно хранить несколько месяцев при температуре —20°С и до года при температуре –80°С, однако при повторном замораживании и оттаивании происходит денатурация и выпадение в осадок белка. Следует учитывать, что верхний слой сыворотки после оттаивания и центрифугирования не содержит белка, а в нижнем его в 1,5-2 раза больше, чем в не замороженной. Этим можно пользоваться для его концентрирования. Количество плазмы варьирует в зависимости от условий сезона. Гемолиз и выход содержимого эритроцитов в плазму (сыворотку) происходит при ряде отравлений и заболеваний, стрессе рыб, длительном (более суток) хранении сыворотки на сгустке крови в обычном холодильнике, а также небрежном взятии и обращении с кровью и по другим причинам. Гемолиз искажает результаты электрофореза (усиление в области -глобулинов) увеличивает значение общего белка при рефрактометрии; изменяет показатели электролитного состава вызывает (даже следы) повышенное содержание ферментов. Во избежание гемолиза кровь разбавляют физиологическими растворами - чаще изотоничными растворами хлористого натрия различных концентраций. Осмотическая резистентность эритроцитов (ОРЭ) такова, что в норме они выносят разбавление плазмы до солености, эквивалентной 0,33-0,39%-му раствору хлористого натрия.
ТЕХНИКА МИКРОСКОПИРОВАНИЯ Микроскопируют окрашенные препараты под обыкновенным световым микроскопом МБИ-1, МБИ-2 и др. с применением иммерсионного объектива. Наибольшая четкость изображения достигается при использовании окуляра х7, а разрешающая способность увеличивается с применением окуляра х15 и более. Удобен при камеральной обработке гематологического материала большой биологический бинокулярный микроскоп с наклонным тубусом. Исследуют мазки при дневном свете с применением плоского зеркала или и использованием электрической подсветки с светофильтром. Вогнутым зеркалом пользуются при искусственном освещении (рекомендуется при микрофотографии и другой микроскопии с большими увеличениями). Осветителями служат ОИ-24 и ОИ-Ти др. Микрофотографирование производят с помощью микрофотонасадок различных конструкций: МФН-1, МФН-12 и др., а также с помощью специального микроскопа с вмонтированным в него фотоаппаратом (модель "Ультрафот" Цейса) и др. Нужные зарисовки делают с помощью рисовального аппарата, который прикрепляют к верхней части тубуса микроскопа. Благодаря наличию особой кубической линзы, состоящей из двух прямоугольных линз, склеенных особым образом, видимое исследователем изображение сбрасывается на бумагу, расположенную на рабочем столе рядом с микроскопом, или же на особую подставку, покрытую бумагой. При таком положении увеличенные контуры изучаемого предмета можно довольно точно обвести карандашом. Для установления правильного соотношения освещенности бумага и аппарата служат сменные светофильтры, заключенные в барабане рисовального аппарата. Из других приспособлений к обыкновенному световому микроскопу удобно поставить окуляр с указательной стрелкой. Можно рекомендовать бинокулярную насадку, фазово-контрастное устройство и др.
ПОДСЧЕТ СООТНОШЕНИЯ ОТДЕЛЬНЫХ ВИДОВ ЛЕЙКОЦИТОВ КРОВИ (ЛЕЙКОЦИТАРНАЯ ФОРМУЛА) Техника подсчета лейкоцитарной формулы заключается к приготовлении мазка крови, его окраске и подсчете различных форм лейкоцитов в мазке. Мазок делают на тщательно вымытом и обезжиренном (путем погружения в смесь спирта с эфиром) предметном стекле. Чтобы сделать мазок, берут в правую руку чистое покровное стеклышко, касаются одним краем капли крови и, затем, наклонив его на 45°, приводят в соприкосновение с предметным стеклом. Капля крови растекается в силу капиллярности по краю покровного стекла. После этого покровное стекло ведут вдоль предметного. Необходимо, чтобы капля крови тянулась за покровным стеклом, а не находилась впереди его. Мазок не должен быть ни слишком тонок, ни слишком толст. После того как мазок подсохнет, его фиксируют, опуская на 3 минуты в метиловый спирт. Осушив мазок от спирта, его окрашивают. Для окраски препаратов краску Романовского разводят дистиллированной водой из расчета 1—2 капли краски на 1 мл воды. Вода должна иметь рН7. Для этой цели к дистиллированной воде добавляют фосфатный буфер. Краску разводят непосредственно перед окраской. Затем разведенную краску берут пипеткой и покрывают ею зафиксированный мазок. В зависимости от температуры воздуха и от качества краски мазок окрашивают от 2 до 40 мин. После этого краску сливают, мазок промывают водопроводной водой и высушивают, осторожно промокая фильтровальной бумагой. Мазок рассматривают под микроскопом с иммерсией. Для получения правильных результатов подсчет ведут по краям мазка зигзагообразно (от края мазка вглубь на три-четыре поля зрения и обратно). Всего подсчитывают 200 лейкоцитов, по 50 шт. на четырех краях мазка. Все обнаруженные формы лейкоцитов записывают в таблицу, а затем суммируют в отдельности по формам. Для удобства записи и последующего расчета встречающиеся формы лейкоцитов отмечают в специальной таблице, составленной по следующему образцу. Каждый раз встречая в мазке какую-нибудь форму лейкоцита, отмечают её в соответствующей строке палочкой. Записав 10 лейкоцитов в вертикальной графе, начинают запись в следующей вертикальной графе. Верхняя цифра в вертикальной графе показывает сумму подсчитанных лейкоцитов. После того как все 12 вертикальных граф будут заполнены, подсчитывают количество отдельных лейкоцитов каждой формы и определяем их соотношение в процентах.
Библиография 1. Бауер О.Н. Взаимоотношения между паразитами и хозяевами (рыбами)//Основные проблемы паразитологии рыб.-Л.,1958.-С.90-108. 2. Беспалый И.И. Жаберная гниль карпа и меры борьбы с ней.-Киев: Изд-во АН УССР, 1950.-42 с. 3. Возный Н.Е., Ивасик В.М. Некоторые морфологические и биохимические показатели крови карпов и сазано-карповых гибридов при инвазии паразитами//Вестник зоологии.- 1974.-С.40-45. 4. Головин Н.П., Головина Н.А. Некоторые вопросы цитогенеза при газопузырьковой болезни// Материалы 2-й регион. конф. по паразитам и болезням рыб и мерам борьбы с ними в Казахстане и республиках Средней Азии.-Алма-Ата,1977.-С.68-69. 5. Головина Н.А. К морфологии белой крови двухлетних карпов// Тр. ВНИИПРХ.-1976.- Т.26.-С.48-53. 6. Головина Н.А., Поддубная А.П., Манкирова В.Б. Влияние некоторых заболеваний на гематологические показатели// Вестник зоологии.-1977.- №5.-С29-33. 7. Заварзин А.А., Щелкунов С.С. Руководство по гистологии.-М.: Медгиз,1954.-698 с. 8. Иванова Н.Т. Атлас клеток крови рыб (сравнительная морфология и классификация форменных элементов крови рыб).-М.: Легкая и пищевая пром-сть, 1982.-184 с. 9. Канаев А.И. Кариофиллоз карпа: Автореферат дисс… канд.биол.наук.-М., 1956.-16 с. 10. Капустина Н.И. О паразито-хозяиных отношениях в системе Khawia sinensis – карп при невысоких интенсивностях инвазии //Тр.ВНИИПРХ.-1978.-Т.27.-С.75-87. 11. Кудрявцев А.А., Кудрявцева Л.А., Привольньев Т.И. Гематология животных и рыб.- М.,Колос.-1969.-320 с. 12. Маргаритов И. Исследования на някон хематологични показатели на двухлетен шаран болен от бранхионкроза//Рибностопанство.-1973.-№2.-С.5-8. 13. Метелев Б.В. Картина крови карпа при гнойно-некротическом воспалении плавательного пузыря//Тез. докл.IV Всесоюз. совещ. по болезням рыб.-Л., 1963.-С.67-69. 14. Наумов И.П., Корташев И.Ю. Зоология позвоночных.-М.:Высш. шк.,1979.-381 с. 15. Остроумова И.Н. Показатель крови и кроветворение в онтогенезе рыб//Изв.ГосНИОРХ.- 1957.- Т.43, №3.-С.69. 16. Пищенко Е.В., Ефанова Н.В., Бакшеев А.Ф. Характеристика лейкоцитов у двухлетков алтайского зеркального карпа седьмого поколения селекции //Состояние водных экосистем Сибири.-Томск, Томский гос. ун-т, 1998, - С.239-240. 17. Решетникова А.В. Об изменении крови сазана при заражении ихтиофтириусом//Науч.- техн. бюл./ ГосНИОРХ.-1962.- №15.-С.71-73. 18. Садовская О.Д. Изменение лейкоцитарной формулы карпа при инвазии// Работы по гельминтологии к 80-летию акад. И.И.Скрябина.-М.,1967.-С.320-321. 19. Суворов Е.К. Основы ихтиологии.-М.,Советская наука,1948. - 557 с. 20. Терентьева Э.И., Шишканова З.Г. Атлас ультраструктуры клеток кроветворной ткани.- М.:Медгиз.- 1972.-134 с. 21. Тодоров Иордан. Клинические лабораторные исследования в педиатрии.-София.: Медицина и физкультура,1959.-553 с. 22. Турдыев А.А. Ультраструктура гранулоцитов карповых рыб// Архив анатомии, гистологии, эмбриологии.-1975.-№2(19),т.58.-С.75-79. 23. Черникова В.В. Гематологическая характеристика зимующего сеголетка карпа/ Изв. ГосНИОРХ.- 1974.-Т.88.- С.109-135. 24. Чечина А.С., Буянова М.Н. К вопросу о изучении так называемого воспаления плавательного пузыря//Тез. докл. XII науч. конф. по изучению внутр. водоемов Прибалтики.-Вильнюс,1968.- С.70-72. 25. Шмальгаузен И.И. Основы сравнительной анатомии.-М.: Советская наука,1947.-539 с. 26. Шмидт Г.А. Эмбриология позвоночных.-М.:Советская наука,-1953.-403 с. 27. Шполянская А.Ю. Воспаление плавательного пузыря у сеголетков и годовиков карпа//Сб.докл. преп. с.-х. вузов РСФСР по пруд. рыб.-М.,1964.-С.111-115. 28. Deansley R. The structure and development of the thymus in fish, with special reference to Salmo farrio//Q.JI. microsc.Sci.71,1927.-P.113-145. 29. Ellis A.E. The leukocytes of fish// J.Fish.Biol.-1977.-P.453-491. 30. Gottlieb A.A., Woldman S.R. The multiple function of macrophages in immunity// Macrophages and Cellular immunity/London.: Butterworths,-1972.- P.13-44. 31. Turpen J.B., Volve E.P., Cohen N. Ontogeny and perioxid of thimiclimphocytes//Since.-1972.- №182.-P.931-933. СОДЕРЖАНИЕ I. КРОВЬ, ЕЁ СОСТАВ И ОСНОВНЫЕ ФУНКЦИИ................................. 5 Морфология системы крови............................................................................ 5 Гемопоэз и классификация форменных элементов крови рыб................... 8 Клеточные элементы зернистого ряда......................................................... 11 Клеточные элементы лимфоидного ряда.......................... 13 Клеточные элементы моноцитоидного ряда............................................... 15 Клеточные элементы эритроидного ряда.................................................... 15 Клеточные элементы тромбоцитоидного ряда........................................... 16 Морфология клеток крови карпа Cyprinus carpio (L.)................................. 17 в норме и при заболеваниях.......................................................................... 17 Состав и морфология клеток крови у здорового карпа.............................. 17 Морфологическая характеристика клеток белой крови карпа................. 19 Патологические структурные изменения в клетках крови...................... 21 Сапролегниоз икры карпа................................................. 22 Бранхиомикоз двухлетков карпа....................................... 22 Воспаление плавательного пузыря (ВПП)........................ 23 Ихтиофтириоз сеголетков карпа....................................... 24 Хилодонеллез сеголетков карпа........................................ 24 Дактилогироз карпа........................................................... 25 Кавиоз сеголетков карпа.................................................... 25 Газопузырьковая болезнь карпа....................................... 26 II. МЕТОДИКА ИССЛЕДОВАНИЙ КРОВИ РЫБ.................................... 26 1.Оборудование.............................................................................................. 26 2.Взятие крови................................................................................................ 27 3. Подсчет красных и белых кровяных телец............................................. 30 4. Изготовление мазков, фиксация, окраска препаратов........................... 34 5.Техника микроскопирования..................................................................... 37 6.Подсчет соотношения отдельных видов лейкоцитов крови (лейкоцитарная формула)........................................................................... 37 7. Определение количества гемоглобина.................................................... 38 8.Определение стойкости эритроцитов к гипотоническим растворам (гемолиз).......................................................................................................... 39 9.Определение скорости оседания эритроцитов (соэ)............................... 40 10. Определение фагоцитарной способности лейкоцитов крови............. 42 Библиография................................................................................................. 45 Пищенко Елена Витальевна Гематология пресноводной рыбы Учебное пособие
Редактор Н.К. Крупина Компьютерная верстка Пищенко Е.В.
Подписано в печать.............. 2002 г. Формат 60х84 1/16. Объем 2,9 уч.-изд.л. Тираж 100 экз. Изд №96. Заказ №
Отпечатано в ИЗОП 630039. Новосибирск, ул. Добролюбова, 160. НОВОСИБИРСКИЙ ГОСУДАРСТВЕНЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ ГЕМАТОЛОГИЯ ПРЕСНОВОДНОЙ РЫБЫ Учебное пособие Новосибирск 2002 УДК ББК П
Рецензент профессор Р.Б.Козин
Пищенко Е.В. Гематология пресноводной рыбы: Учебное пособие/ Новосиб. гос. аграр. ун-т.- Новосибирск, 2002.-с.
В учебном пособии подробно описаны основные форменные элементы крови и патология крови рыб при различных заболеваниях. Приведены методики определения форменных элементов крови. Учебное пособие предназначено для студентов зооинженерного факультета, изучающих курсы «Рыбоводство» и Физиология животных» Утверждено и рекомендовано к изданию методической комиссией зооинженерного факультета Новосибирского государственного аграрного университета
Ó Пищенко Е.В., 2002 ÓНовосибирский государственный аграрный университет, 2002
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 341; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.168.219 (0.019 с.) |