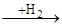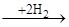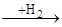Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Одностадійне дегідрування парафінів у дієниСодержание книги
Поиск на нашем сайте
Двохстадійний метод одержання бутадієну-1,3, що відрізняється порівняно високим виходом (до 65 %), має ряд недоліків: необхідність поділу газових сумішей після кожної стадії, підвищені енергетичні і капітальні витрати. З цієї причини проводилися інтенсивні роботи зі створення одностадійного процесу перетворення н-бутану та ізопентану в бутадієн-1,3 та ізопрен. При одностадійному процесі протікають дві оборотні послідовні стадії дегідрування:
С4Н10
Рівноважний склад цієї системи залежить від температури і тиску. При підвищенні температури рівноважна концентрація н-бутану різко падає, вміст н-бутенів проходить через максимум при температурі 800 К, а кількість бутадієну росте, але не настільки значно, через одночасне утворення водню на обох стадіях. Це показує, що для одностадійного процесу варто вибирати більш високу температуру, чим на першій стадії дегідрування парафінів, і знижений парціальний тиск реагентів. Крім того, потрібен каталізатор, що відповідним чином прискорював би обидві реакції дегідрування, наприклад, алюмохромовий. Оскільки при роботі з цим каталізатором не можна використовувати водяну пару, то як розріджувач був розроблений процес, що йде за зниженим тиском (0,015-0,02 МПа) і температурі 580-6000С, що є середнім між оптимальними для першої і другої стадії дегідрування парафінів. Через застосування вакууму реактори з рухомим каталізатором виявилися непридатними для одностадійного процесу. Сильне відкладення коксу і необхідність частої регенерації обумовили використання регенеративної системи Гудрі. Реакційний вузол при одностадійному процесі включає ряд блоків, що складаються з 5-8 горизонтальних реакторів зі стаціонарним шаром каталізатору. Кожен реактор працює періодично, за регенеративним принципом використання тепла. У період випалювання коксу і регенерації каталізатору останній розігрівається до температури 6000С. Потім йде евакуація газів згорання за допомогою вакууму (1,5-2 хв.) і дегідрування, коли тепло насадки використовується для проведення ендотермічного процесу, і вона прохолоджується до мінімально припустимої температури (5800С). Після цього реактор продувають перегрітою водяною парою для витиснення вуглеводнів (1,5-2 хв.) і знову проводять регенерацію каталізатору. Щоб охолодження в період дегідрування відбувалося не занадто швидко, до каталізатора додають гранули прожареного глинозему, що грає роль акумулятора тепла, але й у цьому випадку стадії дегідрування і регенерації тривають усього по 5-9 хв., із загальною тривалістю циклу роботи реактора 15-20 хв. Усі переключення потоків проводяться автоматично і завдяки наявності у блоці 5-8 реакторів створюється безперервний постійний потік вихідних речовин і одержуваних продуктів. Ступінь конверсії вихідної сировини становить 20-30 % при селективності 55 %. Контактний газ містить приблизно 11 % бутадієну-1,3 і 25-30 % бутенів. Через проведення обох стадій дегідрування не в оптимальних для них умовах селективність менше, ніж при двохстадійному процесі, але це компенсується зниженням капітальних вкладень і енергетичних витрат завдяки скороченню деяких стадій виробництв.
Хімія і технологія процесів гідрування
У промисловості основного органічного синтезу широко використовуються процеси гідрування вуглеводнів, кисень-, азотутримуючих з'єднань з метою одержання насичених вуглеводнів, кетонів, карбонових кислот, спиртів, амінів.
Гідрування вуглеводнів
7.1.1 Гідрування по С=С зв'язку Як каталізатор для гідрування олефінів по С=С зв'язку використовували платинову чернь, потім стали використовувати платину, скелетний нікелевий каталізатор (нікель Ренея), нікель на носіях, мідь, змішані каталізатори (мідь, хромоксидний, цинк і хромоксидний) і інші каталізатори. Найбільш типові металевий нікель і нікель, обложений на оксиді алюмінію, оксиді хрому та інших носіях. У їх присутності висока швидкість реакції досягається при температурі 100-2000С і тиску 1-2 МПа. Якщо вихідна сировина містить сіркоутворюючи з'єднання, рекомендується застосовувати каталізатори стійкі до отруєння сіркою (сульфіди нікелю, вольфраму, молібдену), на цих каталізаторах швидкість досягається при температурі 300-3200С і тиску 25-30 МПа. Гідрування по С=С зв'язку протікає дуже легко і майже з теоретичним виходом. При цьому реакційна здатність олефінів залежить від ступеня заміщення атомів вуглецю, що знаходяться при подвійному зв'язку. Швидше всіх гідрується етилен, а для його гомологів швидкість реакції внаслідок екстрагуючого впливу заступників падає в ряді:
СН2=СН2 > RCH=CH2 > RCH=CHR > R2C=CH2 > R2C=CHR > R2C=CR2
Дієнові вуглеводні з прямим ланцюгом гідруються швидше олефінів. У залежності від будівлі дієну водень може приєднуватися на початку в 1,4-положення або одночасно у 1,4 і 1,2-положення, причому часто вдається зупинити реакцію на цій стадії. Більш глибоке гідрування приводить до утворення парафінів:
ô ô ô ô
ô ô ô ô ô ô ô ô ô ô ô С=С-С=С ô ô ô ô ô ô ô ô СН-СН-С=С ô ô
Аналогічним чином гідруються полієнові вуглеводні, що поглинають два атоми водню на кожен подвійний зв'язок, аж до утворення цілком гідрованих з'єднань. При відповідному дозуванні водню і виборі селективного каталізатору вдається провести чисте гідрування таких з'єднань. У циклоолефінах подвійний зв'язок здатний приєднувати водень у присутності тих же каталізаторів гідрування. Наявність алкільних заступників при подвійному зв'язку також зменшує швидкість реакції. При гідруванні циклоолефінів необхідно дотримувати запобіжного заходу, тому що можуть одержати значний розвиток побічні реакції гідрогенолізу по вуглець-вуглецевому зв'язку, що при гідруванні олефінів з відкритим ланцюгом не грають істотної ролі. У більш жорстких умовах відбувається розкриття циклу при дії водню особливо у три-чотиричленних циклічних системах. Вуглеводні із шістьма і більш вуглецевими атомами в циклі в умовах гідрування можуть також ізомерізуватися в більш стабільні п'ять- і шестичленні цикли:
С8Н18
Ці побічні реакції обмежують вибір температури при гідруванні олефінів і особливо циклоолефінів, це необхідно мати на увазі при визначенні оптимальних умов. Гідрування вуглеводнів по С=С зв’язку широко застосовується при стабілізації крекінг-бензину, при селективному очищенні рідких продуктів піролізу від олефінів і т.д. В основах органічного синтезу цей тип реакцій гідрування використовується для одержання деяких циклоолефінів (циклоалкенів) і циклопарафінів (циклоалканів). Циклопентен, циклооктен, циклододілен є коштовними полімерами для одержання синтетичного каучуку, а відповідно циклопарафіни застосовуються для одержання дикарбонових кислот, циклоалканів і лактамів. Для цього синтезу проводять гідрування циклопентадієну (виділенного з продуктів піролізу) циклічних дімерів і тримерів бутадієну. Гідрування до циклоолефінів можна здійснити за допомогою гетерогенних каталізаторів (нікель, кобальт на носіях); у випадку синтезу циклооктану і циклододенану кращі результати отримані з гомогенними каталізаторами. Останні особливо придатні для селективного гідрування поліолефінів у моноолефіни – циклопентен, циклооктен, циклододецен. З цих каталізаторів найбільш розповсюджений гідрокарбоніл родію з трибутилфосфориновим лігандом НRh(CO3)×P(C4H9)3. У його присутності при температурі 1400С і тиску приблизно рівному 2,5 МПа досягається ступінь перетворення циклододекатрієну близько до 100 % і селективність по моноолефіну понад 95 %.
циклопентен
циклооктен
циклододілен
7.1.2 Гідрування по СºС зв'язку Ацетилен і його гомологи гідруються повільніше олефінів, але проміжно утворені олефіни легко витісняються з поверхні каталізатора через меншу здатність до сорбції і тому можуть бути отримані як цільові продукти. Селективне гідрування до олефінів здійсненно при каталізі платини і паладия на носіях, а також молибдатами кобальту, нікелю, заліза та ін. При більшому часі контакту гідрування йде до утворення парафіну:
СНºСН
З гомологів ацетилену легше реагують з воднем ті, які мають потрійний зв'язок на кінці ланцюга. З'єднання з потрійним зв'язком у середині ланцюга гидруються повільніше, і в цьому випадку перша і друга стадія розділені більш чітко, чим у випадку ацетилену. При каталізі нікелю, а особливо міді, і при недоліку водню з ацетилену виходять інші продукти, що представляють собою суміші його частково гідрованих полімерів. На мідному контакті утвориться тверда полімерна речовина – купрен. Він застосовується в якості наповнювача при виготовленні різних матеріалів. Ацетилен можна використовувати для одержання етилену при температурі 180-3200С і 1,5-2,0-кратному надлишку водню з паладієвим каталізатором на силікагелі. Подібний процес застосовують для селективного очищення етилену від домішки ацетилену (останній завжди утвориться при піролизі вуглеводневих газів, при якому виділяється також водень). Гідроочищення від ацетилену досягається пропущенням газу через контактний апарат з каталізатором (паладій; нікель на носії; молібдати нікелю і кобальту).
|
|||||
|
Последнее изменение этой страницы: 2020-03-02; просмотров: 146; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.15.91 (0.008 с.) |

 С4Н8 «С4Н6
С4Н8 «С4Н6 СН-С=С-СН
СН-С=С-СН
 СН-СН-СН-СН
СН-СН-СН-СН цикло С6Н10(СН3)2
цикло С6Н10(СН3)2
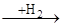 цикло С5Н7(СН3)3
цикло С5Н7(СН3)3