Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Класифікація реакцій дегідруванняСтр 1 из 8Следующая ⇒
ЗМІСТ
ВСТУП Класифікація реакцій дегідрування Класифікація реакцій гідрування Теоретичні основи процесів гідрування і дегідрування Рівновага реакцій гідрування і дегідрування Вплив термодинамічних факторів на вибір умов процесу 3.3 Каталізатори, механізм, кінетика реакцій гідрування і дегідрування 3.3.1 Каталізатори Механізм реакцій гідрування-дегідрування Кінетика реакцій гідрування-дегідрування Селективність реакцій гідрування і дегідрування Дегідрування парафінів і олефінів. Виробництво бутадієну та ізопрену Дегідрування парафінів у моноолефіни 6.2 Дегідрування вищих н-парафінів в олефины С12-С18 6.3 Дегідрування олефінів Окиснювальне дегідрування олефінів Одностадійне дегідрування парафінів у дієни Хімія і технологія процесів гідрування Гідрування вуглеводнів 7.1.1 Гідрування по С=С зв'язку 7.1.2 Гідрування по СºС зв'язку Гідрування ароматичних вуглеводнів Технологія газофазного гідрування Типи реакційних пристроїв Технологія рідинофазного гідрування Типи реакційних пристроїв Література ВСТУП
Тема контрольної роботи «Процеси гідрування і дегідрування» з дисципліни «Технологія нафтохімічного синтезу». Мета роботи – розглянути класифікацію реакцій гідрування і дегідрування; вплив термодинамічних факторів на вибір умов процесів гідрування і дегідрування; каталізатори, механізм, кінетика процесів гідрування і дегідрування; селективність реакцій гідрування і дегідрування; виробництво бутадієну та ізопрену; дегідрування парафінів у моноолефіни С12-С18; одностадійне дегідрування парафінів у дієни; дегідрування олефінів; окисне дегідрування олефінів; хімію і технологію процесів гідрування по С=С, СºС зв'язкам, а також ароматичних з'єднань; технологію газофазного гідрування; технологію рідинофазного гідрування; типи реакційних речовин. Знання механізмів гетерогенного каталізу реакцій гідрування і дегідрування дозволяє зробити крок до розробки загальної теорії каталізу. Розробленість технології дегідрування дозволила спроектувати великотонажні установки й у суміжних галузях.
Під дегідруванням розуміють хімічні процеси, зв'язані з відщіпленням атомів водню від органічної сполуки. Гідрування або гідрогенізація полягає в перетвореннях органічних сполук під дією молекулярного водню. У ряді випадків гідрування приводить до відновлення кисеньмістких речовин, дегідрування– до їхнього окиснення. Процеси дегідрування і гідрування мають дуже важливе значення в промисловості. Дегідруванням одержують ненасичені з'єднання, які представляють велику цінність як мономери для виробництва синтетичного каучуку і пластмас (бутадієн 1,3, ізопрен, стирол), а також альдегіди, кетони (формальдегід, ацетон, метилетилкетон). Реакціями гідрування синтезують циклогексан і його похідні, багато амінів (анілін, гексаметилендиамін), спирти (н-пропанол, н-бутанол, вищі). Дуже часто реакції гідрування і дегідрування є етапами багатостадійних синтезів коштовних органічних сполук – мономерів, поверхнево-активних речовин (ПАР), розчинників і т.і.
Каталізатори, механізм, кінетика реакцій гідрування і дегідрування
Каталізатори Застосування каталізаторів дозволяє досягти високої швидкості процесів при порівняно низькій температурі, коли ще не одержують значного розвитку небажані побічні реакції. Через оборотність реакцій гідрування-дегідрування і здатності будь-яких каталізаторів однаково прискорювати як прямій, так і зворотний процес, обидва ці процеси каталізуються тими самими речовинами. Їх можна розділити на три головні групи: 1. Метали VIII групи (Fe, Co, Ni, Pd, Pt) і 1-Б підгрупи (Cu, Ag), а також суміші цих металів (сплави). 2.Оксиди металів (Mg, Zn, Cr2O3, Fe2O3). 3. Складні оксидні і сульфідні каталізатори, що складаються із суміші оксидів або сульфідів (мідь- і цинкхромокисні Cu×Cr2O3 і Zn×Cr2O3; кобальтмолібденові Co×Mo3; нікель- і кобальтвольфрамокисні NiО×WO3 і Co×WO3). Ці речовини, особливо метали, часто наносять на пористі носії і додають до них різні промотори – оксиди інших металів, лугу. Каталізатори застосовують у різних формах – від тонкодиспергованих у рідині до формованих (у виді циліндрів, кілець, таблеток). Вони мають різну активність і селективність для кожного конкретного процесу. Поки не знайдено яких-небудь загальних закономірностей, що визначають оптимальний вибір каталізатору.
гідрування дегідрування реакція Дегідрування олефінів Дегідрування олефінів у термодинамічному відношенні настільки ж несприятливо, як і дегідрування алкілароматичних вуглеводнів. Тому і тут для підвищення рівноважного ступеня конверсії при допутимій температурі (6000С) приходиться розбавляти реагуючу суміш водяною парою. Н-бутени або н-ізопентени, що надходять на дегідрування, незалежно від їх походження (із продуктів піролизу, крекінгу або дегідрування відповідних парафінів) являють собою суміш ізомерів, дегідруються тільки a-олефіни:
СН2=СН-СН2-СН3
Для селективності ізомерів необхідна попередня ізомеризація з переміщенням подвійного зв'язку або утворенням поверхневого радикалу з делокалізованими електронами:
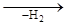 CH2=CH-CH=CH2 CH2=CH-CH=CH2
[CH3-CHLCHLCH2]·
Крім цих цільових реакцій при дегідруваннІ протікають побічні процеси крекінгу, скелетної ізомеризації і коксоутворення. У результаті крекінгу з олефінів виходять метан і вуглеводні С2 і С3. Ізомеризація н-бутену веде до утворення ізобутена, але ця реакція особливо небажана для ізопентенів, коли отриманні пентени можуть далі дегідрувати у пентадієн-1,3 (пиперілен), а останній здатний заміняти цикл з утворенням циклопентадієну:
(СН3)2С=СН-СН3 «СН3-СН2-СН=СН-СН3 «
«СН2=СН-СН=СН-СН3 ®
Негативна роль останніх реакцій складається в одержанні домішок, які утрудняють очищення і виділення цільових речовин. При дегідруванні олефінів утворюються продукти ущільнення, кокс. Вважається, що головним їх джерелом є дієни, що схильні до реакцій конденсації з утворенням циклічних систем (дієновий синтез з наступної дегідроконденсацією ароматичних з'єднань). Нарешті, при дегідруванні олефінів за рахунок утворившегося водню виходить невелика кількість парафінів, що крекуються легше, ніж відповідні олефіни. Частина вуглеводнів і коксу піддається також конверсії водяною парою, унаслідок чого в газі утримуються оксиди вуглецю.
парафін «олефіни «дієн «продукти ущільнення і кокс
низчи вуглеводні ізомеролефіни ізомери дієну
Отже, маються рівнобіжні і послідовні шляхи утворення побічних процесів, селективність росте при зниженні двох факторів: температури (через більш високу енергію активації побічних реакцій) і ступеня конверсії; вибір цих величин обумовлений економічними розуміннями. Тому каталізатори повинні прискорити переважно дегідрування та ізомеризацію з переміщенням подвійного зв'язку, не повинні бути малоактивними у відношенні крекінгу, скелетної ізомеризації і коксоутворення. Кращими є кальцийнікельфосфатні каталізатори ИМ-2204 (Са8Ni(PO4)6), що містять промотируючу добавку 2 % Cr2O3, їх випускають у формованном виді для роботи в стаціонарному шарі. Характерна риса – швидке закоксовування і втрата реактивності, тому потрібне часте випалювання коксу. Періоди дегідрування і регенерації чергуються кожні 5 хвилин, попередньо продуваючи реактор водяною парою.
Дегідрування ведуть, розбавляючи вихідну суміш водяною парою в об'ємному співвідношенні 20:1, при об'ємній швидкості по газоподібному вуглеці 150-200 ч-1 і загальному тиску тільки небагато перевищуючому атмосферний (щоб перебороти гідравлічний опір шару каталізатора і наступної апаратури); температура складає 600-6500С, ступінь конверсії – 40-45 %, селективність – 85 % - при дегідруванні н-бутенів. Для ізопентану, більш реакційноздібного і більш схильного до побічних реакцій, температура складає 550-6000С, ступінь конверсії – 40 %, селективність – 84 %. Для проведення процесу використовують реактори зі стаціонарним шаром каталізатора, що не мають поверхонь теплообміну. При цьому пара відіграє роль теплоносія, що не дозволяє суміші надмірно охолоджуватися (перепад температур між входом і виходом складає 30-400С). Крім кальцийнікельфосфатних контактів застосовують залізооксидні каталізатори (К-16), що містять 25-90 % Fe2O3, 2-50 % Cr2O3, до 15 % К2СО3 та інші компоненти. Вони є саморегенеруючими і здатні працювати до 24 годин, після чого регенеруються. На цих каталізаторах процес ведуть при розведенні вихідної суміші водяною парою в об'ємному співвідношенні 10:1, ступінь конверсії складає 17-20 %, селективність – 80-85 %.
Гідрування вуглеводнів
7.1.1 Гідрування по С=С зв'язку Як каталізатор для гідрування олефінів по С=С зв'язку використовували платинову чернь, потім стали використовувати платину, скелетний нікелевий каталізатор (нікель Ренея), нікель на носіях, мідь, змішані каталізатори (мідь, хромоксидний, цинк і хромоксидний) і інші каталізатори. Найбільш типові металевий нікель і нікель, обложений на оксиді алюмінію, оксиді хрому та інших носіях. У їх присутності висока швидкість реакції досягається при температурі 100-2000С і тиску 1-2 МПа. Якщо вихідна сировина містить сіркоутворюючи з'єднання, рекомендується застосовувати каталізатори стійкі до отруєння сіркою (сульфіди нікелю, вольфраму, молібдену), на цих каталізаторах швидкість досягається при температурі 300-3200С і тиску 25-30 МПа. Гідрування по С=С зв'язку протікає дуже легко і майже з теоретичним виходом. При цьому реакційна здатність олефінів залежить від ступеня заміщення атомів вуглецю, що знаходяться при подвійному зв'язку. Швидше всіх гідрується етилен, а для його гомологів швидкість реакції внаслідок екстрагуючого впливу заступників падає в ряді:
СН2=СН2 > RCH=CH2 > RCH=CHR > R2C=CH2 > R2C=CHR > R2C=CR2
Дієнові вуглеводні з прямим ланцюгом гідруються швидше олефінів. У залежності від будівлі дієну водень може приєднуватися на початку в 1,4-положення або одночасно у 1,4 і 1,2-положення, причому часто вдається зупинити реакцію на цій стадії. Більш глибоке гідрування приводить до утворення парафінів:
ô ô ô ô
ô ô ô ô ô ô ô ô ô ô ô С=С-С=С ô ô ô ô ô ô ô ô СН-СН-С=С ô ô
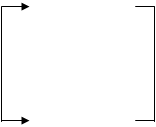
Аналогічним чином гідруються полієнові вуглеводні, що поглинають два атоми водню на кожен подвійний зв'язок, аж до утворення цілком гідрованих з'єднань. При відповідному дозуванні водню і виборі селективного каталізатору вдається провести чисте гідрування таких з'єднань. У циклоолефінах подвійний зв'язок здатний приєднувати водень у присутності тих же каталізаторів гідрування. Наявність алкільних заступників при подвійному зв'язку також зменшує швидкість реакції. При гідруванні циклоолефінів необхідно дотримувати запобіжного заходу, тому що можуть одержати значний розвиток побічні реакції гідрогенолізу по вуглець-вуглецевому зв'язку, що при гідруванні олефінів з відкритим ланцюгом не грають істотної ролі. У більш жорстких умовах відбувається розкриття циклу при дії водню особливо у три-чотиричленних циклічних системах. Вуглеводні із шістьма і більш вуглецевими атомами в циклі в умовах гідрування можуть також ізомерізуватися в більш стабільні п'ять- і шестичленні цикли:
С8Н18
Ці побічні реакції обмежують вибір температури при гідруванні олефінів і особливо циклоолефінів, це необхідно мати на увазі при визначенні оптимальних умов. Гідрування вуглеводнів по С=С зв’язку широко застосовується при стабілізації крекінг-бензину, при селективному очищенні рідких продуктів піролізу від олефінів і т.д. В основах органічного синтезу цей тип реакцій гідрування використовується для одержання деяких циклоолефінів (циклоалкенів) і циклопарафінів (циклоалканів). Циклопентен, циклооктен, циклододілен є коштовними полімерами для одержання синтетичного каучуку, а відповідно циклопарафіни застосовуються для одержання дикарбонових кислот, циклоалканів і лактамів. Для цього синтезу проводять гідрування циклопентадієну (виділенного з продуктів піролізу) циклічних дімерів і тримерів бутадієну.
Гідрування до циклоолефінів можна здійснити за допомогою гетерогенних каталізаторів (нікель, кобальт на носіях); у випадку синтезу циклооктану і циклододенану кращі результати отримані з гомогенними каталізаторами. Останні особливо придатні для селективного гідрування поліолефінів у моноолефіни – циклопентен, циклооктен, циклододецен. З цих каталізаторів найбільш розповсюджений гідрокарбоніл родію з трибутилфосфориновим лігандом НRh(CO3)×P(C4H9)3. У його присутності при температурі 1400С і тиску приблизно рівному 2,5 МПа досягається ступінь перетворення циклододекатрієну близько до 100 % і селективність по моноолефіну понад 95 %.
циклопентен
циклооктен
циклододілен
7.1.2 Гідрування по СºС зв'язку Ацетилен і його гомологи гідруються повільніше олефінів, але проміжно утворені олефіни легко витісняються з поверхні каталізатора через меншу здатність до сорбції і тому можуть бути отримані як цільові продукти. Селективне гідрування до олефінів здійсненно при каталізі платини і паладия на носіях, а також молибдатами кобальту, нікелю, заліза та ін. При більшому часі контакту гідрування йде до утворення парафіну:
СНºСН
З гомологів ацетилену легше реагують з воднем ті, які мають потрійний зв'язок на кінці ланцюга. З'єднання з потрійним зв'язком у середині ланцюга гидруються повільніше, і в цьому випадку перша і друга стадія розділені більш чітко, чим у випадку ацетилену. При каталізі нікелю, а особливо міді, і при недоліку водню з ацетилену виходять інші продукти, що представляють собою суміші його частково гідрованих полімерів. На мідному контакті утвориться тверда полімерна речовина – купрен. Він застосовується в якості наповнювача при виготовленні різних матеріалів. Ацетилен можна використовувати для одержання етилену при температурі 180-3200С і 1,5-2,0-кратному надлишку водню з паладієвим каталізатором на силікагелі. Подібний процес застосовують для селективного очищення етилену від домішки ацетилену (останній завжди утвориться при піролизі вуглеводневих газів, при якому виділяється також водень). Гідроочищення від ацетилену досягається пропущенням газу через контактний апарат з каталізатором (паладій; нікель на носії; молібдати нікелю і кобальту).
Типи реакційних пристроїв
Через низькі коефіцієнти тепловіддачі від газу до стінки проблема тепловідводу при газофазном гідруванні значно складніша, ніж при рідинофазном. Вона ще більш ускладнюється при нерухомому шарі каталізатора, зерна якого перешкоджають дифузії реагентів та їхньому охолодженню. У залежності від ступеня экзотермічності реакції відвід тепла досягається трьома основними способами, що визначають конструктивні особливості реакторів гідрування. У трубчастих апаратах, які застосовуюються для проведення сильно екзотермічних процесів гідрування (відновлення нітроз’єднань, гідрування ароматичних з'єднань), каталізатор поміщають у трубах діаметром 25х50 мм. Парогазовую суміш водню з органічним реагентом звичайно надають зверху (іноді знизу) і реакція протікає в трубах на зернах каталізатора. Виділене тепло знімається хладоагентом, який циркулює в міжтрубному просторі. У якості хладоагенту особливо підходить киплячий водний конденсат, у цьому випадку можна утилізувати тепло реакції для одержання водяної пари. Ступінь використання реакційного об’єму у цих апаратах невеликий, тому для менш екзотермічних реакцій застосовують апарати із суцільним шаром каталізатору, що поміщається на дирчастих полках або в спеціальних кошиках у кілька шарів. У просторі між шарами маються холодильники, але з верхньою подачею парогазової суміші. Іноді використовують трохи адіабатичних реакторів із суцільним шаром каталізатору. Для ще менш экзотермічних реакцій (гідрування насичених альдегідів) можна обмежитися подачею між шарами каталізатору холодного водню, який сприймає надлишкове тепло. При газофазном гідруванні карбонових кислот або їх ефірів у спирти можна взагалі обійтися без охолодження реакційної суміші. Для роботи за високим тиском використовуються апарати, подібні застосовуваним при синтезі аміаку. Каталізатор розміщають у кілька шарів у спеціальній катализаторній коробці, яку монтують поза реактором і яку можна виймати з нього і вставляти при заміні каталізатору. У кільцевий простір між корпусом реактору і каталізаторною коробкою надають холодний водень або реакційну суміш для часткового відводу тепла і запобігання корпусу від дії високих температур. У кілька місць по висоті коробки вводять холодний водень, щоб не послабляти корпус реактора, усі труби виведені не збоку, а через масивну кришку у днищі. При проході парогазової суміші через суцільний шар каталізатору температура трохи підвищується, тому висоту шару потрібно підбирати так, щоб не відбувалося надмірного перегріву і температура знаходилася у припустимих оптимальних межах. Важливим методом регулювання температури при газофазному гідруванні є застосування великого надлишку водню в порівнянні з теоретично необхідним. Він складає в різних процесах від 5:1 до (20¸30):1. Надлишковий водень акумулює выділене тепло, запобігаючи надмірний перегрів реакційної маси. В кожному випадку мається оптимальний надлишок водню, при встановленні якого необхідно враховувати витрати на його рециркуляцію. Цікавим варіантом оформлення процесу є сполучення двох реакторів: реактору для гідрування в рідкій фазі із суспендированим каталізатором і реактору для гідрування в газовій фазі з стационарним каталізатором. Тут у першому апараті також здійснюється основна частка перетворень за тим або іншим способом відводу тепла. Компоненти суміші випаровуються в струмі водню і гідрування завершується в другому апараті, що не вимагає теплообмінних пристроїв. Ця схема особливо підходить для гідрування бензолу в циклогексан, коли досягається майже повна конверсія бензолу при високій продуктивності установки.
Типи реакційних пристроїв
Реакційна маса в процесах рідинофазного гідрування є, як правило, трифазною (рідкий реагент, твердий каталізатор, газоподібний водень). Реакція протікає на поверхні каталізатору, причому її швидкість, за інших рівних умов, залежить від концентрації водню в рідині, що залежить від тиску, швидкості розчинення водню в реакційній масі і швидкості його дифузії к поверхні каталізатору. Підвищенню швидкості сприяє високий тиск водню і перемішування реакційної маси, що є характерним для всіх процесів рідинофазного гідрування. Оформлення реакційного вузла для рідинофазного гідрування сильно залежить від экзотермічності реакції і способу відводу тепла. Тільки в рідких випадках виділення тепла настільки мало, що реакцію можна здійснити без охолодження (гідрування карбонових кислот та їх ефірів). У випадку гідрування летучих речовин (перетворення бензолу в циклогексан) іноді відводять тепло за рахунок випару компонентів суміші, які конденсують і повертають до реактору. Найбільш часто для процесів з диспергованими і суспендованими каталізаторами здійснюють примусове охолодження за допомогою внутрішніх або виносних холодильників; у цьому випадку тепло реакції може використовуватися для одержання пари. Тепловідвод утруднений для процесів зі стаціонарним каталізатором, тоді найчастіше ведуть східчасте охолодження суміші. Останнім часом для рідинофазного гідрування застосовують комбінування двох реакторів із суспендованим і стаціонарним каталізатором. В основному реакція протікає у першому реакторі, у якому тепло відводиться одним з описаних методів. В другому реакторі відбувається тільки невелика частка перетворень, причому охолодження не потрібно зовсім. Завдяки комбінуванню апаратів, близьких відповідно до моделей повного змішання, та ідеального витиснення досягаються висока продуктивність і ступінь перетворення сировини. У ряді випадків колони можна виконувати зі звичайної сталі. Якщо процес проводиться за високим тиском, який сприяє водневій корозії, або з агресивними речовинами (карбонові кислоти та ін.) потрібні спеціальні сталі або облицювання сталевого корпуса легованою сталлю та іншими корозійнно-стійкими металами.
Література 1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1988. 2. Одбашен Г.В., Швец В.В. Лабораторный практикум по химии и технологии основного органического и нефтехимического синтеза. – М.: Химия, 1992. 3. Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органического и нефтехимического синтеза. – М.: Химия, 1992. 4. Кирпичников П.А., Лиакумович А.Г., Победимский Д.Г., Попова Л.М. Химия и технология мономеров для синтетических каучуков. –Л.: Химия, 1981. 5. Черный И.Р. Производство сырья для нефтехимического синтеза. – М.: Химия, 1983. 6. Спарченко В.К. Дегидрирование углеводородов. – Киев: Наукова думка, 1981.
ЗМІСТ
ВСТУП Класифікація реакцій дегідрування
|
||||||||||||||
|
Последнее изменение этой страницы: 2020-03-02; просмотров: 167; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.104.248 (0.059 с.) |
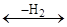 СН2=СН-СН=СН2
СН2=СН-СН=СН2 СН2=СН-СН2-СН3
СН2=СН-СН2-СН3 СН2
СН2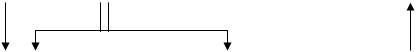
 СН-С=С-СН
СН-С=С-СН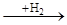
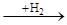 СН-СН-СН-СН
СН-СН-СН-СН цикло С6Н10(СН3)2
цикло С6Н10(СН3)2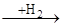
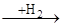 цикло С5Н7(СН3)3
цикло С5Н7(СН3)3