
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Задача 11-5 (автор – Ерёмин В. В.)Содержание книги
Поиск на нашем сайте
1. 2. При нагревании константа равновесия уменьшается, то есть равновесие смещается в сторону реагентов. Согласно принципу Ле Шателье это означает, что реакция идёт с выделением теплоты. 3. Пусть в реакцию вступило a моль N2, тогда прореагировало 3 a моль H2 и образовалось 2 a моль NH3. Общее количество вещества после реакции: n(N2) + n(H2) + n(NH3) = (1– a) + (3–3 a) + 2 a = 4 – 2 a.
a = 0,34.
n(NH3) = 2 × 0,34 = 0,68 моль. 4. Рассчитаем мольные доли веществ после добавления азота и составим из них величину Q, по форме аналогичную константе равновесия:
Это значение превышает значение константы равновесия:
Это означает, что продукта реакции больше, чем необходимо в равновесной смеси, следовательно, для достижения равновесия должна пойти обратная реакция. Таким образом, в данном случае добавление реагента приводит к смещению равновесия влево. Комментарий: Это противоречит традиционной формулировке принципа Ле Шателье (но не самому принципу!). Кажущееся противоречие объясняется тем, что количество азота в исходной смеси сильно превышает стехиометрическое, поэтому дальнейшее добавление азота термодинамически невыгодно. Система оценивания 1. За правильное выражение для константы равновесия 2 балла 2. 2 балла за правильный ответ (выделение теплоты), 2 балла за объяснение 4 балла 3. За правильный расчёт числа молей 6 баллов 4. 2 балла за правильный ответ (равновесие сместится влево), ИТОГО 20 баллов
Школьный этап 11 класс
Тест 1. Цис-бутен-2 и транс-бутен-2 отличаются друг от друга 1) составом 2) углеродным скелетом 3) положением двойной связи в молекуле 4) относительным расположением атомов в пространстве 2. Белый осадок образуется при взаимодействии бромной воды с 1) ацетоном 2) толуолом 3) этанолом 4) фенолом 3. Верны ли следующие утверждения о свойствах спиртов? А. Низшие спирты неограниченно смешиваются с водой. Б. Спирты реагируют с карбоновыми кислотами, образуя сложные эфиры. 1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны 4. В схеме превращений C2H2 → CH3CHO → CH3COOH реагентами «X» и «Y» являются соответственно 1) KOH и O2 2) CuO и Ag2O(NH3) 3) O2 и Cu(OH)2 4) H2O(Hg2+) и Cu(OH)2
5. Полимер, имеющий формулу получают из 6. Реакция замещения в бензольном ядре происходит при взаимодействии фенола с 1) водородом 2) натрием 3) бромом 4) гидроксидом калия 7. К парниковым газам относится 1) водород 2) хлороводород 3) азот 4) углекислый газ Задачи 1.При сгорании вторичного амина симметричного строения образовалось 44,8 л углекислого газа, 5,6 л азота (при н.у.) и 49,5 г воды. Определите молекулярную формулу амина. (5 балла) 2. Космический корабль потерпел аварию и совершил посадку на неизвестную планету. Командир корабля поручил одному из космонавтов определить состав атмосферы. В распоряжении космонавта оказались лишь яблоко, малахитовая шкатулка, известковая вода. Он установил, что разрезанное яблоко не изменяется в атмосфере планеты, известковая вода не мутнеет, а при нагревании малахита образуется красный порошок. К какому выводу пришел космонавт и почему. (5 баллов) 3. В результате полной дегидратации предельного одноатомного спирта массой 11,1 г образовался углеводород объемом 3,36 л (в пересчете на н.у.). Установите молекулярную формулу спирта. (3балла) 4.Предельный углеводород массой 0.75 г подвергли полному бромированию, полученный при этой реакции бромоводород пропустили через раствор нитрата серебра. Выпавший осадок отфильтровали, высушили и прокалили до постоянной массы, которая составила 16.2 г. Определите исходный углеводород(4 балла) 5. Напишите уравнения реакций, позволяющих выполнить следующие превращения: СH4 → A → C2H6 → C2H4 → B → CH2=CH-CH=CH2 (5 баллов) Кроссворд Разгадайте кроссворд, определите выделенное ключевое слово 1. Наука о веществах, их свойствах, превращениях. 2. Углеводороды с двумя двойными связями. 3. Углеводороды с замкнутыми циклами. 4. Вещества, в состав которых входят атомы «С» и «Н». 5. Вещества, содержащие группу «- СООН». 6. Углеводороды с одной двойной связью в молекуле. 7. При взаимодействии аминокислот образуются….. 8. Вещества, содержащие группу «- ОН». 9. Производные аммиака, в молекулах которых атом(ы) «Н» заменены на радикалы. 10. Вещества с одинаковым составом, но разным расположением атомов в молекуле. 11. Вещества, способные вступать в реакцию гидролиза. 12. Органические вещества с функциональной группой «- СОН». 13. (13 баллов) 14. 15. 16.
1. К 20 г смеси карбоната кальция и гидрокарбоната калия прибавлен избыток соляной кислоты. Выделившийся при этом газ пропущен через избыток баритовой воды (Ba(OH)2). Вычислите массу образовавшегося при этом осадка. 2. Карбид кальция и вода могут стать сырьём для получения таких химических соединений как: а) этанол, б) уксусная кислота, в) этилен и полиэтилен, г) винилхлорид и поливинилхлорид, д) бензол. Напишите уравнения реакций получения этих соединений, имея в своём распоряжении карбид кальция, воду и любые другие неорганические вещества. 3. При окислении неизвестного кислородсодержащего предельного органического 4. Амальгама — сплав, один из компонентов которого ртуть. Амальгаму цинка и алюминия массой 10,00 г обработали избытком разбавленного раствора серной кислоты. При этом выделилось 0,896 л водорода (н.у.). Масса полученного нерастворимого остатка оказалась равной 8,810 г. 5. Методом электронного баланса расставьте коэффициенты в уравнении окисления трехсернистого мышьяка азотной кислотой по схеме: Решения 1. В настоящей задаче указана общая масса смеси, но не указан её состав. В данном случае это не имеет значения, так как молярные массы CaCO3 и KHCO3 одинаковы. 2. В основе производства целого ряда химических соединений лежит реакция получения ацетилена из карбида кальция и воды: Всего за задание: 11 баллов 3. Дано: Всего за задание: 7 баллов 4. Ртуть в разбавленной серной кислоте не растворяется, следовательно, масса ртути в амальгаме 8,810 г. (1 балл) х = 0,01 моль; у = 0,02 моль (2,5 балла) Всего за задание: 13 баллов 5. As2 +3S3 -2 + H N +5O3? H3As +5O4 + H2S +6O4 + N +2O (1 балл)
(1 балл) 3As2S3 + 28HNO3 + 4 Н2О? 6 H3AsO4 + 9 H2SO4 + 28 NO (2 балла)
|
||||||||
|
Последнее изменение этой страницы: 2019-12-15; просмотров: 229; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.01 с.) |


 .
.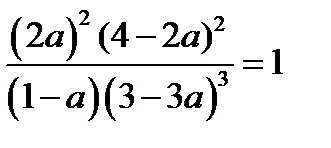 .
.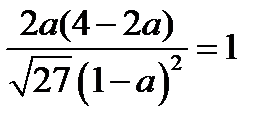 .
. .
. .
. .
.




