Максимальное количество баллов - 100
Решения задач для 11 класса
Задача 11-1. 
1. Рассчитаем количественное соотношение атомов углерода, водорода и азота в пиридине: оно равно n(C): n(H): n(N) = (75,9/12): (6,3/1): (17,8/14) = 6,325: 6,3: 1,27 = 4,98: 4,96: 1 ≈ 5: 5: 1, то есть количественная формула пиридина – C5H5N. 1 балл
2. Используя условие ароматичности, можно установить структурную формулу пиридина:  . Действительно, данная формула удовлетворяет всем требованиям: эта молекула плоская, т.к. в ней содержатся 3 кратные связи, вращение вокруг которых невозможно 2 балла в этой молекуле всего один цикл 1 балл все связи сопряжены (кратные связи чередуются с одинарными) 1 балл система содержит 6π-электронов (по 2 от каждой кратной связи; n=1) 2 балла
. Действительно, данная формула удовлетворяет всем требованиям: эта молекула плоская, т.к. в ней содержатся 3 кратные связи, вращение вокруг которых невозможно 2 балла в этой молекуле всего один цикл 1 балл все связи сопряжены (кратные связи чередуются с одинарными) 1 балл система содержит 6π-электронов (по 2 от каждой кратной связи; n=1) 2 балла
3. Исходя из похожих рассуждений, установим, что циклопентадиен и циклооктатетраен неароматичны (т.к. число π-электронов не равно 4n+2), а тиофен отвечает всем требованиям ароматичности. 3*1 балл =3 балла
Всего 10 баллов
Задача 11-2.
1. Формула винной килоты – НООС-СН(ОН)-СН(ОН)-СООН, следовательно, формула её кислой соли имеет вид ХООС-СН(ОН)-СН(ОН)-СООН.
1 балл
2. По условию, массовая доля углерода в этом соединении равна ω(С) = 25,53%, т.е. ω(С) = 48/16*6+12*4+1*5+ Ar (Х) =0,2553 Отсюда, Х – калий.
0,5 баллов
Формула винного камня – КООС-СН(ОН)-СН(ОН)-СООН, его нынешнее название – гидротартрат калия.
1 балл
3. Поташ К2СО3. 0,5 баллов
4.Калий – серебристый, лёгкий, мягкий металл с низкой температурой плавления. При горении калия на воздухе образуется надпероксид калия: К + О2 → КО2. Соединения калия окрашивают пламя спиртовки в фиолетовый цвет. 1 балл
5. Реакция 1
КООС-СН(ОН)-СН(ОН)-СООН + NaOH → КООС-СН(ОН)-СН(ОН)-СООNa + Н2О
1 балл
Реакция 2 –
Cu2+ + 2OH- + 2C4O6H42- → 
2 балла
Реакция 3 –
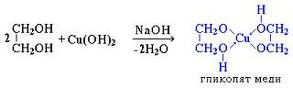
2 балла
6. Хелатные.
1 балл
Всего 10 баллов
Задача 11-3.
1. «Семёрка металлов древности» – это Pb, Fe, Au, Ag, Hg, Cu, Sn. Сульфаты не всех металлов растворимы в воде, т.е. не подвергаются электролизу в растворе. 2 балла
С помощью уравнения Фарадея определим возможное значения молярных массы солей:
m = (M*I*t)/(n*F), откуда M = (m*n*F)/(I*t) = (0,0893*96500*n)/(15*3600*2) = 0,0798n
1 балл
При n=1 М=79,8г/моль При n=2 М=159,6г/моль, что соответствует сульфату меди CuSO4. При n=3 M=239,4г/моль, ни один из указанных сульфатов не подходит. Таким образом, металл Х– медь. 2 балла
2. Малахит (С uOH)2 CO 3, халькопирит или медный колчедан С uFeS 2, халькозин или медный блеск Cu 2 S.
2*0,5= 1 балл
Реакция 1: Сu + 2H2SO4 (конц.) → CuSO4 + SO2 + H2O. Образуются сульфат меди(II) (А), оксид серы(IV) и вода. 0,5 балла
Реакция 2: СuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4. Получается гидроксид меди(II) (Б) сине-голубого цвета и сульфат натрия. 0,5 балла
Реакция 3: СН2О + Сu(OH)2 → HCOOH + 2CuOH +H2O (при нагревании). Продукты: HCOOH – муравьиная кислота (В); CuOH - гидроксид меди(I) (Г) жёлтого цвета, 1 балл который далее распадается на оксид меди (I) красного цвета и воду: 2CuOH → Cu2O + H2O. Этим и объясняется постепенное изменение окраски раствора.
2 балла
Всего 10 баллов
Задача 11-4. 
1. Реакции:
С2Н6 + Сl2 → C2H5Cl (на свету) + HCl 0,5 балла
C2H5Cl + NaCN → C2H5CN + NaCl 0,5 балла
C2H5CN + 2H2O → C2H5COOH + NH3 (в присутствии серной кислоты) 0,5 балла
C2H5Cl + Mg → C2H5MgCl 0,5 балла
C2H5MgCl + CO2(сухой лёд) → C2H5COOMgCl 0,5 балла
C2H5COOMgCl + H2O → C2H5COOH + Mg(OH)Cl 0,5 балла
C2H5COOH + 2Cl2 → CH3CCl2COOH + 2HCl (катализатор – PCl5) 1 балл
CH3CCl2COOH → CH3CHCl2 + CO2 (при нагревании) 1 балл
CH3CHCl2 + 2H2 → C2H6 +2HCl (на никелевом катализаторе) 1 балл
Таким образом, А – C2H5Cl; Б – C2H5CN; В – C2H5COOH; Г – C2H5MgCl; Д – C2H5COOMgCl; Е – CH3CCl2COOH; Ж – CH3CHCl2.
1. Подтверждение дополнительными данными:
Соединение Г действительно содержит 24/(2*12+5*1+24+35,5) = 0,271, т.е. 27,1% Mg по массе; 1 балл в реакции 3НСООН + 2КMnO4 → 2 MnO2 + 3СО2 + 2KOH + 2H2O (при нагревании) выделяется углекислый газ СО2, следовательно, сухой лёд имеет состав СО2. 2 балла
2. Французский химик Виктор Гриньяр. 1 балл
Всего 10 баллов
Всероссийская олимпиада школьников по химии
Муниципальный этап. 2009/2010 г.
Одиннадцатый класс.
Задача 11-1.
При сгорании некоторого количества сахарозы С12Н22О11 выделилось 113,4 кДж теплоты. Рассчитайте тепловой эффект химической реакции горения сахарозы, если при растворении продуктов сгорания этого количества сахарозы в 88 мл раствора гидроксида калия с массовой доли щелочи 20% (плотность 1,15 г/мл) получили раствор с равными молярными концентрациями двух солей. (10 баллов)
Задача 11-2.
Оксид алюминия массой 10,2 г сплавили с кальцинированной содой массой 21,5 г. Какие вещества входят в состав полученного сплава, и какова его масса? Весь сплав растворили в 250 мл 20%-ной хлороводородной кислоты (плотностью 1,10 г/мл). Какие вещества будут находиться в полученном растворе? Рассчитайте их массовые доли. (10 баллов)
Задача 11-3.
Простое газообразное вещество А взаимодействует с горячим раствором вещества Б с образованием двух веществ В и Г, причем вещество Г известно под тривиальным названием «бертоллетова соль».
а) Определите вещества указанные в условии. Как называется подобный тип реакций? Укажите окислитель и восстановитель в этой реакции, и расставьте коэффициенты в ее уравнении методом электронного баланса.
б) Одно из применений бертоллетовой соли – спичечное производство. Напишите уравнение реакции бертоллетовой соли с простым веществом Д, входящим в состав намазки спичечного коробка.
в) Один из русских химиков предложил устройство для защиты органов дыхания от действия вещества А. Назовите фамилию этого химика, название устройства и явления, на котором основано его действие.
(10 баллов)
Задача 11-4.
Раствор сульфата меди массой 200 г с массовой долей 8% был подвергнут электролизу с инертными электродами, в результате чего масса раствора уменьшилась на 10,7 г.
Напишите уравнения реакций, которые проходили при электролизе на катоде и аноде, рассчитайте массы каждого из выделившихся веществ, а также состав (массовые доли) полученного раствора. (10 баллов)
Задача 11-5.
В отдельные годы вблизи Екатеринбурга выпадали так называемые «кислые» дожди с концентрацией ионов водорода 10-4 моль/л. Одним из веществ, содержащихся в такой дождевой воде, может быть серная кислота.
а) Какие процессы могут определять появление серной кислоты в дождевой воде? Напишите уравнение реакций
б) Какая еще одна сильная кислота может определять кислый характер дождевой воды? Какие природные процессы приводят к образованию этой кислоты? Напишите уравнение реакций.
в) Определите массу серной кислоты, содержащейся в 1 т дождевой воды, с концентрацией ионов водорода 10-4 моль/л. Плотность воды считать равной 1 г/мл.
г) Кислотность водных растворов часто характеризуют величиной рН («пэ-аш»). Что такое рН? Как он связан с концентрацией ионов водорода? Какое значение эта величина принимает в кислых, нейтральных и щелочных растворах? Каково ее значение для концентрации ионов водорода 10-4 моль/л? (10 баллов)
Всероссийская олимпиада школьников по химии 2009/2010 г.
Муниципальный этап. Одиннадцатый класс. Решения задач.
Задача 11-1. Уравнения реакций:
С12Н22О11 + 12O2 = 12CO2 + 11H2O (1) (1 балл)
2KOH + СО2 = K2СО3 + Н2О (2) (1 балл)
K2СО3 + Н2О + СО2 = 2KHСО3 (3) (1 балл)
n(KOH) = (88 · 1,15 · 0,2)/ 56 = 0,36 (моль)
Молярная концентрация с = n/V, равенство молярных концентраций солей в растворе означает, что n(K2СО3) = n(KHСО3)
Пусть n(K2СО3) = n(KHСО3) = х моль, судя по содержанию калия, общее количество KOH, которое необходимо для образования этих солей равно 3х, отсюда
3х = 0,36; x = 0,12 (моль). (2 балла)
Судя по содержанию углерода, на образования 0,12 моль каждой соли необходимо 0,12 моль углекислого газа, таким образом, всего при сгорании сахарозы выделилось 0,24 моль CO2. (2 балла)
Находим тепловой эффект реакции горения сахарозы
0,24 моль 113,4 кДж
С12Н22О11 + 12 О2 → 12 СО2 + 11Н2О + Qxр кДж
Qxр = 12*113,4 / 0,24 = 5670 (кДж) (3 балла)
Всего 10 баллов.
Задача 11-2. Уравнение реакции при сплавлении:
Al2O3 + Na2CO3 = 2NaAlO2 + CО2 (1) (1 балл)
Количества вещества n=m/M:
n(Al2O3) = 10,2/102 = 0,1 моль; n(Na2CO3) = 21,5/106 = 0,203 моль;
Судя по уравнению, вещества вступают в реакцию в соотношении 1:1, поэтому карбонат натрия в избытке. Сплав будет состоять из метаалюмината натрия (0,2 моль), и карбоната натрия (0,103 моль). В ходе реакции выделится 0,1 моль углекислого газа массой 4,4 г. Масса сплава будет равна
m(спл) = 10,2 + 21,5 – 4,4 = 27,3 г. (2 балла)
При растворении сплава протекают реакции:
Na2CO3 + 2 HCl = 2NaCl + CО2+ Н2O (2) (1 балл)
NaAlO2 + 4 HCl = NaCl + AlCl3+ 2Н2O (3) (1 балл)
Количество вещества HCl
m(p-pa) = ρV = 1,1*250 = 275 г
n(HCl) = m(p-pa)*w/M = 275*0,2/36,5 = 1,507 моль – избыток (1 балл)
По уравнению 2: n2(HCl) = n2(NaCl) = 2n(Na2CO3) = 0,103*2 =0,206 моль
n2(CО2) = n(Na2CO3) = 0,103 моль
По уравнению 3: n3(HCl) = 4n(NaAlO2) = 0,2*4=0,8 моль;
n3(AlCl3) = n3(NaCl) = n(NaAlO2) = 0,2 моль
Т.о. после окончания реакции раствор будет содержать:
nизб(HCl) = 1,507 - 0,206 - 0,8 = 0,501 моль; nобщ(NaCl) = 0,206 + 0,2 = 0,406 моль;
n3(AlCl3) = 0,2 моль. (2 балла)
Массы веществ m = M*n:
m2(CО2) = 0,103*44 = 4,53 г; mизб(HCl) = 0,501*36,5 = 18,3 г;
m(NaCl) = 0,406*58,5 = 23,7 г; m(AlCl3) = 0,2*133,5 = 26,7 г;
Масса раствора после реакции:
m(p-pa 2) = m(p-pa) + m(спл) - m2(CО2) = 275 + 27,3 – 4,53 = 297,8 г (1 балл)
Массовые доли w = m/ m(p-pa 2):
w(HCl) = 18,3/297,8 = 0,0614 = 6,14%; w(NaCl) = 23,7/297,8 = 0,0798 = 7,98%;
w(AlCl3) = 26,7/297,8 = 0,0897 = 8,97% (1 балл)
Всего 10 баллов.
Задача 11-3. а) Бертоллетова соль это хлорат калия, Г = KClO3; 1 балл
Отсюда вещество А – Cl2, хлор; Б – гидроксид калия КОН, В - KCl 1 балл
Реакция протекает по уравнению:
3Cl2 + 6KOH = 5KCl + KClO3 + 3Н2O;
1 | Cl0 + 5e = Cl+5 | окислитель
5 | Cl0 – e = Cl – 1 | восстановитель 3 балла
И окислителем и восстановителем в этой реакции является хлор, реакция самоокисления-самовсстановления или диспропорционирования. 1 балл
б) В состав намазки спичечного коробка входит красный фосфор. При соприкосновении с головкой спички протекает реакция:
6P + 5KClO3 = 3P2O5 + 5KCl + Q;
сопровождающаяся воспламенением спички 2 балла
в) Этим устройством был фильтрующий угольный противогаз, который был изобретен русским ученым Николаем Дмитриевичем Зелинским в 1915 г. Его действие основано на явлении адсорбции – поглощении вещества из газа или жидкости поверхностью другого вещества – адсорбента. 2 балла
Всего 10 баллов.
Задача 11-4. При электролизе раствора сульфата меди протекают реакции:
Катод: Cu2+ + 2e = Cu | восстановление
Анод: H2O – 4e = 4H+ + O2 | окисление
Что суммарно выражается уравнением:
2 CuSO4 + H2O  2 Cu + O2 + 2 H2SO4 (3 балла)
2 Cu + O2 + 2 H2SO4 (3 балла)
Количество вещества сульфата меди в растворе:
n(CuSO4) = m(p-pa)*w/M = 200*0,08/160 = 0,1 моль (1 балл)
По уравнению реакции: n(Cu) = n(CuSO4) = 0,1 моль;
n(O2) = n(CuSO4) / 2 = 0,05 моль; m(Cu) = 6,4 г, m(O2) = 1,6 г, (1 балл)
что отвечает убыли массы раствора всего на 8 г.
Т.к. масса раствора уменьшилась еще на 10,7 – 8 = 2,7 г, значит электролиз был продолжен и тогда, когда вся медь была выделена из раствора, т.е. это был уже электролиз раствора серной кислоты:
Катод: 2H+ + 2e = H2 | восстановление
Анод: H2O – 4e = 4H+ + O2 | окисление
Что суммарно выражается уравнением:
2H2O  2H2 + O2 (2 балла)
2H2 + O2 (2 балла)
Количество вещества воды разложившееся при этом:
n(H2O) = m /M = 2,7/18 = 0,15 моль
По уравнению реакции 2: n(H2) = n(H2O) = 0,15 моль;
n2(O2) = n(H2O) / 2 = 0,075 моль; m(H2) = 0,3 г, m2 (O2) = 2,4 г, (1 балл)
Т.о. в ходе электролиза на катоде выделилось 6,4 г меди и 0,3 г водорода, на аноде – кислород общей массой 4 г.
По уравнению 1 в ходе электролиза образовалось 0,1 моль или 9,8 г серной кислоты. Массовая доля серной кислоты в растворе будет равна:
w(H2SO4) = m/m(p2) = 9,8/189,3 = 0,0518 = 5,18% (2 балла)
Всего 10 баллов.
Задача 11-5.
а) При сжигании серосодержащих топлив, при обжиге сульфидов в атмосферу попадает сернистый газ SO2: В дальнейшем он взаимодействует с водой и окисляется давая серную кислоту, например: 2ZnS + 3O2 = 2 ZnO + 2 SO2;
SO2 + H2O = H2SO3; 2 H2SO3 + O2 = H2SO4; (3 балла)
б) Второй сильной кислотой, входящей в состав кислых дождей, является азотная. За счет грозовых разрядов в атмосфере образуется оксид азота(II):
N2 + 3O2 = 2 NO; 2NO + O2 = 2 NO2; 4NO2 + 2H2O + O2 = 4HNO3; (3 балла)
в) Одна тонна дождевой воды имеет объем 1 м3 = 1000 л, и содержит
n(H+) = 10-4моль/л * 1000 л = 0,1 моль ионов водорода.
По уравнению диссоциации серной кислоты: H2SO4 = 2 H+ + SO4 2–
n(H2SO4) = n(H+)/2 = 0,1 / 2 = 0,05 моль.
m(H2SO4) = n*M = 0,05*98 = 4,9 г. (3 балла)
г) рН – водородный показатель, рассчитывается по формуле рН = – lg[H+], где [H+] – молярная концентрация (точнее «активность») ионов водорода. В нейтральной среде рН = 7, в кислых средах рН <7, в щелочных – рН > 7. Для концентрации ионов водорода 10-4 моль/л рН = – lg10-4 = 4 < 7, среда кислая. (1 балл)
Всего 10 баллов.
================================================ Итого 50 баллов
Задания для школьного этапа Всероссийской олимпиады по химии 2009–2010 учебный год
Время выполнения 2 часа
11 класс (Уршакбашкарамалы)
11-1. При обжиге на воздухе сложного вещества массой 9,7г образуется оксид массой 8,1г, растворимый в щелочах, содержащий 80,2 % элемента(II) и газ, плотность которого по водороду равна 32, обесцвечивающий раствор, содержащий бром массой 16г. Определите исходное вещество.
11-2. Колбу, содержащую газообразный хлороводород при н.у., заполнили водой. При этом газ полностью растворился. Определите массовую долю HCl в получившемся растворе.
11-3. С помощью каких химических реакций из обычного мела можно получить бензол? В уравнениях реакций укажите условия их протекания. Какой объем бензола (плотность 0,8 г/мл) можно получить из 1кг мела, содержащего 15 % примесей, при условии, что практический выход на каждой стадии составляет 70 % от теоретического?
11-4. При пропускании смеси этилена и ацетилена через раствор брома в воде масса раствора увеличилась на 50г, а при сгорании такого же объема смеси этих углеводородов вы- делилось 84л оксида углерода (IV). Определите (по объему) состав исходной смеси.
Задания для 11 класса
Задача 11-1.
Ещё в давние времена люди заметили, что в винных бочках при длительном хранении вина на стенках образуется налёт, который они назвали винным камнем. Лишь несколько веков спустя учёные выяснили, что это вещество – кислая соль винной (2,3-дигидроксибутандиовой) кислоты и металла Х (ω(С) = 25,53%).
1. Определите металл Х, а также структурную формулу винного камня. Приведите необходимые расчёты. Как сейчас называется винный камень?
2. Какая соль металла Х использовалась в средние века в производстве мыла? Как её тогда называли?
3. Опишите физические свойства металла Х, напишите уравнение реакции его горения на воздухе, назовите продукт реакции. В какой цвет окрашивают пламя спиртовки соединения Х?
При нейтрализции винного камня едким натром (реакция 1) образуется сегнетова соль, имеющая в своём составе атомы пяти химических элементов. Смешением водного раствора медного купороса и щелочного раствора сегнетовой соли (реакция 2) можно получить тёмно-синюю фелингову жидкость, которая используется в качественном анализе для обнаружения углеводов.
Напишите уравнения реакций (1-3), если известно, что один из продуктов реакции 2 – комплексная соль меди, сходная по строению с продуктом реакции этиленгликоля и свежеприготовленного гидроксида меди(II) (реакция 3). Реакцию 2 запишите в сокращённой ионной форме.
Как называются комплексы такого типа?
Задача 11-2.
В молекулу пиридина помимо атомов углерода и водорода входит ещё и атом азота. Известно, что массовая доля углерода в пиридине составляет 75,9%, водорода – 6,3%, остальное – азот.
1. Установите структурную формулу пиридина, если известно, что он является ароматическим соединением (согласно правилу Хюккеля ароматической является плоская моноциклическая сопряженная система, содержащая (4n + 2) π-электронов, где n = 0,1,2…).
2. Являются ли ароматическими следующие соединения:
циклопентадиен  ; циклооктатетраен
; циклооктатетраен  ; тиофен
; тиофен  ?
?
Задача 11-3.
Современной промышленности часто требуются высокочистые металлы. Есть много способов их очистки, один из которых – метод электрохимического рафинирования. Так, для получения металла X высокой чистоты через водный раствор его сульфата пропускают электрический ток с электродами, сделанными из Х. При пропускании в течение двух часов через этот раствор тока силой 15А на аноде выделилось 89,3г металла Х.
1. Определите металл Х (известно, что он входит в число «семи металлов древности»). Ответ подтвердите расчётом.
2. Какие минералы, в состав которых входит металл Х, вы знаете? Приведите химические формулы двух из них, а также названия.
Если к Х прилить избыток концентрированной серной кислоты, то образуется раствор соли А (реакция 1), добавление к которому NaOH вызывает выпадение осадка Б сине-голубого цвета (реакция 2). Добавляя Б к растворуформальдегида при нагревании, можно получить соединение В (реакция 3), а также вещество Г желтого цвета. В ходе реакции наблюдается изменение окраски раствора с жёлтой до красной.
3. Определите вещества А - Г, напишите упомянутые уравнения реакций и назовите их продукты, если известно, что А, Б, Г содержат Х, а В – нет.
4. С помощью уравнения реакции объясните, почему раствор в реакции 3 краснеет не сразу.
Задача 11-4. Рассмотрите следующую схему превращений:
NaCN Б горячая вода, серная кислота В хлор, хлорид фосфора (V) Е
Этан хлор, свет → А
Mg Г cухой лёд Д вода
водород, Ni Ренея Ж нагрев
Известно, что:
- соединение Г содержит 27,1% Mg по массе;
- соединение, имеющее такой же количественный и качественный состав, что и сухой лёд, образуется при нагревании муравьиной кислоты с перманганатом калия;
- реакции получения веществ А, Г, Д относятся к реакциям присоединения;
- при превращении В в Е в реакцию вступает только α-атом углерода (реакция идёт до конца).
1. Осуществите указанные на схеме превращения, ответ подтвердите с помощью дополнительных данных (расчёт + полное уравнение реакции).
2. Какой учёный внёс большой вклад в химию соединений, подобных соединению Г?
Задания для школьного этапа Всероссийской олимпиады по химии
2009–2010 учебный год
11 класс (Уршакбашкарамалы)
11-1. При обжиге на воздухе сложного вещества массой 9,7г образуется оксид массой 8,1г, растворимый в щелочах, содержащий 80,2 % элемента(II) и газ, плотность которого по водороду равна 32, обесцвечивающий раствор, содержащий бром массой 16г. Определите исходное вещество.
11-2. Колбу, содержащую газообразный хлороводород при н.у., заполнили водой. При этом газ полностью растворился. Определите массовую долю HCl в получившемся растворе.
11-3. С помощью, каких химических реакций из обычного мела можно получить бензол? В уравнениях реакций укажите условия их протекания. Какой объем бензола (плотность 0,8 г/мл) можно получить из 1кг мела, содержащего 15 % примесей, при условии, что практический выход на каждой стадии составляет 70 % от теоретического?
11-4. При пропускании смеси этилена и ацетилена через раствор брома в воде масса раствора увеличилась на 50г, а при сгорании такого же объема смеси этих углеводородов выделилось 84л оксида углерода (IV). Определите (по объему) состав исходной смеси.
Одиннадцатый класс
Региональный этап
|
| Поделиться: |









