Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм возникновения наследственных нарушений обмена аминокислот (фенилкетонурия, альбинизм,алкаптонурия)Стр 1 из 6Следующая ⇒
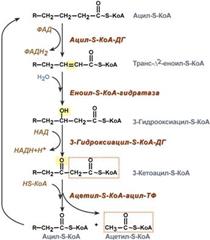
В-окисление жирных кислот. окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. Первая стадия β-окисления — дегидрирование активированной жирной кислоты (ацил-КоА) с образованием β-ненасыщенной жирной кислоты с двойной связью в транс-конфигурации (реакция 1: дегидрирование). При этом оба атома водорода с электронами переносятся от фермента наэлектронпереносящий флавопротеин Вторая стадия деградации жирной кислоты состоит в присоединении молекулы воды к двойной связи ненасыщенной жирной кислоты (реакция [2]: гидратирование). На третьей стадии происходит окисление гидроксильной группы при С-3 в карбонильную группу (реакция [3]:дегидрирование). На четвертой стадии активированная β-кетокислота расщепляется ацилтрансферазой (β-кетотиолазой) в присутствии кофермента А (реакция [4]: тиолитическое расщепление). Продуктами реакции являются ацетил-КоА и активированная жирная кислота, углеродная цепь которой короче на два углеродных атома по сравнению с длиной цепи исходной жирной кислоты. 10. Холестерин, биологическое значение. Биосинтез холестерина до меваловои кислоты. Холестери́н - органическое соединение, природный жирный (липофильный) спирт, содержащийся в клеточных мембранах всех живых организмов, за исключением безъядерных (прокариоты). Нерастворим в воде, растворим в жирах и органических растворителях. Около 80% холестерина вырабатывается самим организмом (печенью, кишечником, почками, надпочечниками, половыми железами), остальные 20% поступают с пищей. 80% холестерина в организме свободные, а 20% — связанные. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов, включая кортизол, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормонатестостерона, играет важную роль в деятельности нервной и иммунной системы. Биосинтез:
Патологии липидного обмена. Нормальное содержание общих липидов в сыворотке крови составляет 4-8 г/л. Увеличение общих липидов называется гиперлипемией.
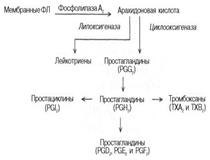
12. Эикозаноиды. Пути образования и биологическая роль в организме. Эйкозаноиды большая группа медиаторов, обладающих широким спектром биологической активности.Предшественником эйкозаноидов является арахидоновая кислота. Депонироваться эйкозаноиды не могут, разрушаются в течение нескольких секунд, поэтому клетка должна синтезировать их постоянно из поступающих в неё соответствующих жирных кислот.Выделяют три основные группы эйкозаноидов:простогландины, тромбоксаны, леикотриены. Пути образования из арахидоновои кислоты:
Роль эикозаноидов: Эйкозаноиды участвуют во многих процессах: регулируют тонус ГМК и вследствие этого влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. Разные типы эйкозаноидов участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции. Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний, например бронхиальной астме и аллергическим реакциям. 13. Биологическая ценность белков, потребность в белке и аминокислотах. Азотистыи баланс и его виды. Биологическая ценность белков. Определяется следующими критериями:1.Чем ближе аминокислотный состав пищевого белка к аминокислотному составу беков тела, тем выше его биологическая ценность.2.В составе белка должны быть все незамеимые аминокислоты: вал, илей, лей, лиз, мет, тре, три, фен. Исключение какой-либо незаменимой аминокислоты из пищи сопровождается развитием отрицательного азотистого баланса.3.В составе белка установлены пропорциональные величины незаменимых аминокислот, относительно триптофана, принятого за единицу, лиз-5, лей-4, вал-3,5.Недостаток в пище одной незаменимой аминокислоты ведет к неполному усвоению других аминокислот.Для человека наиболее ценны белки молока, яиц, мяса, т.к. их аминокислотный состав ближе к аминокислотному составу органов и тканей человека.Потребность в белках зависит от пола, веса, интенсивности труда и других факторов. Все эти факторы влияют на суточную потребность в белке(1-1.5г на кг веса) – общее количество белковой пищи, которую человек должен получить в течение светлого времени суток. Азотистый баланс – разница между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена.Различают 3 вида азотистого баланса:Положительный – количество выводимого из организма азота меньше количества азота, вводимого с пищей. Азот остается в организме и расходуется на синтез белков. Характерен для растушего организма и во время беременности.Отрицательный – количество выделяемого азота превышает количество азота, поступающего в течение суток. Встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела. Отрицательный азотистый баланс наблюдается у пожилых людей. Азотистое равновесие – количество азота выводимого из организма, равно количеству получаемого с пищей азота. Характерно для здорового взрослого человека.
14. Переваривание и всасывание белков в ЖКТ. В желудке имеются все условия для переваривания белков. Во-первых, в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная pH среды. Чистый желудочный сок имеет кислую среду (pH 0,9-1,6), а оптимум pH действия пепсина равен 1,5-2,5. Следует особо указать на существенную роль соляной кислоты в переваривании белков: она переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина, в присутствии свободной НС1 происходят набухание белков (увеличение поверхности соприкосновения фермента с субстратом), частичная денатурация и, возможно, гидролиз пищевых белков.
Пепсин гидролизует преимущественно пептидные связи, образованные аминогруппами ароматических аминокислот (фенилаланин, тирозин). Он расщепляет практически все природные белки. Исключение составляют некоторые кератины, протамины, гистоны и мукопротеиды. Дальнейшее превращение белков пищи осуществляется в тонком кишечнике, где на белки действуют ферменты панкреатического и кишечного соков. В поджелудочной железе вырабатываются три белковых фермента: трипсин, химотрипсин и карбоксипептидаза. Первые два фермента действуют на белки аналогично пепсину, но в отличие от него они разрывают другие внутренние пептидные связи. Кроме того, они активны в слабощелочной среде (оптимум pH действия их составляет 7,2-7,8). Благодаря гидролитическому действию всех трех эндопептидаз (пепсина, трипсина, химотрипсина) на белки образуются различной длины пептиды и некоторое количество свободных аминокислот. Дальнейший гидролиз пептидов до свободных аминокислот осуществляется под влиянием группы ферментов - пептидаз. Продукты гидролиза белков всасываются в желудочно-кишечном тракте в основном в виде свободных аминокислот. Кинетика всасывания аминокислот в кишечнике в опытах in vivo и in vitro свидетельствует о том, что аминокислоты, подобно глюкозе, всасываются свободно с ионами натрия. 15. Пути использования аминокислот в организме: декарбоксилирование, образование биогенных аминов. В организме человека содержится около 100 г свободных аминокислот, которые образуют его аминокислотный фонд. Этот фонд постоянно пополняется за счёт поступления новых молекул аминокислот взамен тех, которые были использованы в метаболических процессах. Процесс отщепления карбоксильной группы аминокислот в виде СO2 получил название декарбоксилирования. Несмотря на ограниченный круг субстратов, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции обладают сильным фармакологическим действием на множество физиологических функций человека и животных.
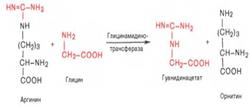
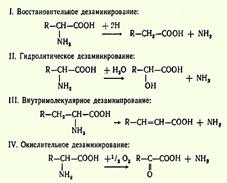
R-CH(NH2)-COOH --> R-CH2-NH2 + CO2 В живых организмах открыто четыре типа декарбоксилирования аминокислот. 1.α-Декарбоксилирование. 2.ω-Декарбоксилированне, характерное для микроорганизмов3.Декарбоксилирование, связанное с реакцией трансаминирования: 4. Декарбоксилирование, связанное с реакцией конденсации двух молекул Превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название гниения белков в кишечнике. Так, в процессе постепенного и глубокого распада серосодержащих аминокислот (цистина, цистеина и метионина) в кишечнике образуются сероводород (H2S) и метилмеркаптан (CH3SH). Диаминокислоты, в частности орнитин и лизин, подвергаются процессу декарбоксилирования с образованием протеиногенных аминов. Из ароматических аминокислот фенилаланина, тирозина и триптофана при аналогичном бактериальном декарбоксилировании образуются соответствующие биогенные амины: фенилэтиламин, парагидроксифенилэтиламин (или триптамин) и индолилэтиламин (триптамин). После всасывания эти продукты через воротную вену попадают в печень, где они подвергаются обезвреживанию В печени аминокислоты используются не только для синтеза собственных белков и белков плазмы крови, но также для синтеза ряда специфических азотсодержащих соединений Накопление биогенных аминов может отрицательно сказаться на физиологическом статусе и вызывать ряд серьезных нарушений в организме. Однако органы и ткани как и целостный организм располагают специальными механизмами обезвреживания биогенных аминов. 16. Дезаминирование, пути использования безазотистых остатков. Доказано существование четырех типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты распада. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака: Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи. 17. Трансаминирование аминокислот. Диагностическое значение определения активности трансаминаз в организме.
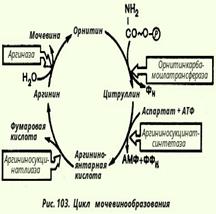
Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. При добавлении к гомогенату мышц глутаминовой и пировиноградной кислот образуются α-кетоглутаровая кислота и аланин без промежуточного образования аммиака; добавление аланина и α-кетоглутаровой кислоты соответственно приводило к образованию пировиноградной и глутаминовой кислот: Аспартат + α-Кетоглутарат <--> ЩУК + Глутамат В сыворотке крови здоровых людей активность этих трансаминаз в среднем составляет 15 и 20 единиц по сравнению с десятками и сотнями тысяч единиц в других органах и тканях. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающихся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. При инфаркте миокарда уровень аспартатаминотрансферазы сыворотки крови уже через 3-5 ч после наступления инфаркта резко повышается, достигая 300-500 единиц. 18. Образование аммиака в организме и пути его обезвреживания. В организме человека подвергается распаду около 70 г аминокислот в сутки; при этом в результате дезаминирования, трансаминирования и окисления биогенных аминов освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтому концентрация аммиака в организме должна сохраняться на низком уровне. Уровень аммиака в норме в крови не превышает 1-2 мг/л. Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах, является биосинтез глутамина и аспарагина. 19. Биосинтез мочевины как основнои механизм предотвращения накопления аммиака. Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% всего азота мочи. суммарная реакция синтеза мочевины без учета промежуточных продуктов: СО2 + NH3 + 3АТФ + 2Н20 + Аспартат --> Мочевина + 2 АДФ + + АМФ + Фумарат + 2 Фн + ФФн
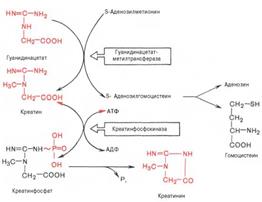
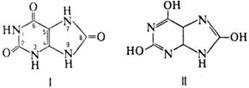
20. Синтез креатинина, креатина, креатин-фосфата и их значение ждя организма. Реакция синтеза креатина протекает в две стадии. Первая стадия – биосинтез гуанидинацетата – осуществляется в почках при участии глицин-амидинотранс-феразы: Вторая стадия синтеза креатина протекает в печени при участии гуанидинацетатметилтрансферазы: Креатин подвергается фосфорилированию с образованием креатин-фосфата, который после дефосфорилирования(необратимая реакция) превращается в креатинин, выделяющийся с мочой. Переваривание и всасывание нуклеопротеидов. Образование мочевой кислоты и патологии, связанные с ее синтезом Переваривание нуклеопротеинов и всасывание продуктов их распада осуществляются в пищеварительном тракте. Под влиянием ферментов желудка, частично соляной кислоты, нуклеопротеины пищи распадаются на полипептидыи нуклеиновые кислоты; первые в кишечнике подвергаются гидролитическому расщеплению до свободныхаминокислот. Распад нуклеиновых кислот происходит в тонкой кишке в основном гидролитическим путем под действием ДНК- и РНКазы панкреатического сока. Продуктами реакции при действии РНКазы являются пуриновые и пи-римидиновые мононуклеотиды. В отношении дальнейшей судьбы мононуклеотидов существует два предположения. Считают, что мононуклеотиды в кишечнике под действием неспецифических фосфатаз (кислой и щелочной), которые гидролизируют фосфоэфирную связь мононуклеотида («нуклеотидазное» действие), расщепляются с образованием нуклеозидов и фосфорной кислоты и в таком виде всасываются. Согласно второму предположению, мононуклеотиды всасываются, а распад их происходит в клетках слизистой оболочки кишечника. Образовавшиеся при гидролизе пуриновые нуклеозиды – аденозин и гуано-зин – подвергаются ферментативному распаду в организме животных вплоть до образования конечного продукта – мочевой кислоты, которая выводится с мочой из организма.
Повышенное выделение мочевой кислоты наблюдается при лейкемии, полицитемии, гепатитах и подагре. Содержание мочевой кислоты в моче повышается также при приеме ацетилсалициловой кислоты и ряда стероидных гормонов. Наряду с мочевой кислотой в моче всегда содержится небольшое количество пуринов экзо, и эндогенного происхождения.
Гормоны щитовидной железы. Щитовидная железа состоит из множества особых полостей – фолликулов, заполненных вязким секретом – коллоидом. В состав коллоида входит особый йодсодержащий гликопротеин с высокой мол. массой – порядка 650000 (5000 аминокислотных остатков). Этот глико-протеин получил название йодтиреоглобулина. Он представляет собой запасную форму тироксина и трийодтиронина – основных гормоновфолликулярной части щитовидной железы. Помимо этих гормонов (биосинтез и функции которых будут рассмотрены ниже), в особых клетках – так называемых парафолликулярных клетках, или С-клетках щитовидной железы, синтезируется гормон пептидной природы, обеспечивающий постоянную концентрацию кальция в крови. Он получил название «кальцитонин». Биологическое действие кальцитонина прямо противоположно эффектупаратгормона: он вызывает подавление в костной ткани резорбтивных процессов и соответственно гипокальциемию и гипофосфатемию. Таким образом, постоянство уровня кальция в крови человека и животных обеспечивается главным образом паратгормоном, кальцитриолом и кальцитонином, Химическая природа гормонов фолликулярной части щитовидной железы выяснена в деталях сравнительно давно. Считается установленным, что все йодсодержащие гормоны, отличающиеся друг от друга содержанием йода, являются производными L-тиронина, который синтезируется в организме из аминокислоты L-тирозина.
Биологическое действие гормонов щитовидной железы распространяется на множество физиологических функцийорганизма. В частности, гормоны регулируют скорость основного обмена, рост и дифференцировку тканей, обменбелков, углеводов и липидов, водно-электролитный обмен, деятельность ЦНС, пищеварительного тракта, гемопоэз, функцию сердечнососудистой системы, потребность в витаминах, сопротивляемость организма инфекциям и др Гипофункция щитовидной железы в раннем детском возрасте приводит к развитию болезни, известной в литературе как кретинизм. Помимо остановки роста, специфических изменений кожи, волос, мышц, резкого снижения скорости процессов обмена, при кретинизме отмечаются глубокие нарушения психики; специфическое гормональное лечение в этом случае не дает положительных результатов. Недостаточная функция щитовидной железы в зрелом возрасте сопровождается развитием гипотиреоидного отека, или микседемы (от греч. myxa – слизь, oedemo – отек). Это заболевание чаще встречается у женщин и характеризуется нарушением водно-солевого, основного и жирового обмена. У больных отмечаются слизистый отек, патологическое ожирение, резкое снижение основного обмена, выпадение волос и зубов, общие мозговые нарушения и психические расстройства. Кожа становится сухой, температура тела снижается; в крови повышено содержание глюкозы. Гипотиреоидизм сравнительно легко поддается лечению препаратами щитовидной железы. Следует отметить еще одно поражение щитовидной железы – эндемический зоб. Болезнь обычно развивается у лиц, проживающих в горных местностях, где содержание йода в воде и растениях недостаточно. Недостаток йодаприводит к компенсаторному увеличению массы ткани щитовидной железы за счет преимущественного разрастаниясоединительной ткани, Белки крови и их роль. Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%. Используя метод высаливания нейтральными солями, белки плазмы крови можно разделить на три группы:альбумины, глобулины и фибриноген. Нормальное содержание альбуминов в плазме крови составляет 40–50 г/л,глобулинов – 20–30 г/л, фибриногена – 2,4 г/л. Плазма крови, лишенная фибриногена, называется сывороткой. Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы. Физиологическая роль белков плазмы крови многогранна. 1. Белки поддерживают коллоидно-осмотическое (онкотическое) давление и тем самым постоянный объем крови. 2. Белки плазмы принимают активное участие в свертывании крови.. 3. Белки плазмы в известной мере определяют вязкость крови, 4. Белки плазмы принимают участие в поддержании постоянного рН крови, так как составляют одну из важнейшихбуферных систем крови. 5. Важна также транспортная функция белков плазмы крови: соединяясь с рядом веществ (холестерин, билирубин и др.),. 6. Белки плазмы играют важную роль в процессах иммунитета (особенно это касается иммуноглобулинов). 7. В результате образования с белками плазмы недиализируемых комплексов поддерживается уровень катионов вкрови. 8. Наконец, белки плазмы крови могут служить резервом аминокислот. Альбумины. На долю альбуминов приходится более половины (55–60%)белков плазмы крови человека. Мол. масса альбумина около 70000. Сывороточные альбумины сравнительно быстро обновляются (период полураспада альбуминов человека 7 дней). Известно, что концентрация альбуминов в сыворотке ниже 30 г/л вызывает значительные изменения онкотического давлениякрови, что приводит к возникновению отеков. Альбумины выполняют важную функцию транспорта многих биологически активных веществ (в частности, гормонов). Они способны связываться с холестерином, желчными пигментами. Значительная часть кальция в сыворотке крови также связана с альбуминами. Глобулины. Сывороточные глобулины при высаливании нейтральными солями можно разделить на 2 фракции – эуглобулины и псевдоглобулины. Фракция эуглобулинов в основном состоит из γ-глобулинов, а фракция псевдоглобулинов включает α-, β- и γ-глобулины, которые при электрофорезе, особенно в крахмальном или полиакриламидном геле, способны разделяться на ряд подфракций. α- и β-Глобулиновые фракции содержатлипопротеины, а также белки, связанные с металлами. Большая часть антител, содержащихся в сыворотке, находится во фракции γ-глобулинов. При снижении уровня белков этой фракции резко понижаются защитные силыорганизма.
Гиперпротеинемия – увеличение общего содержания белков плазмы. Диарея у детей, рвота при непроходимости верхнего отдела тонкой кишки, обширные ожоги могут способствовать повышению концентрации белков в плазме крови. Гипопротеинемия, или уменьшение общего количества белка в плазме крови, наблюдается главным образом при снижении уровня альбуминов. Кроме того, гипопротеинемия может возникнуть при резко увеличенной проницаемости стенок капилляров, при белковой недостаточности (поражение пищеварительного тракта, карцинома и др.).
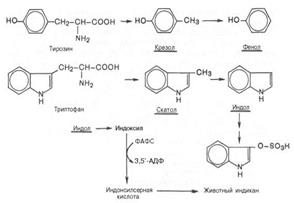
Образование токсинов в толстом кишечнике из аминокислот. превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название «гниение белков в кишечнике». Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальномдекарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин (или тира-мин) и индолилэтиламин (триптамин). Кроме того, микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола.
41Выяснение влияния желчи на активность липазы. Липаза-малоспецифический фермент, который действует на многие жиры при рН 9,0. Липаза гидролитически расщепляет жиры и в первую очередь эфирную связь в а-положении. ПРИНЦИП МЕТОДА: скорость действия липазы в отдельных порциях жира молока можно узнать по количеству жирных кислот, образующихся при гидролизе жира за определенный промежуток времени. Кол-во жирных к-т определяют титрованием щелочью в присутствии фенолфталеина.результаты выражают в мл титрованного раствора щелочи и строят график. ХОДЖ в два стакана наливают молоко и панкреатин. В 1 ст приливают воду, а в другой желчь и перемешивают. Потом добавляют фенолфталеин в каждую и титруют 0,05% рс-м едкого натра до слабо-розовой окраски. Помещают в термостат при 38. и через каждые 10мин отбирают по 1 мл и титруют рс-м едкого натра в присутствии фенолфталеина. Повторяют 5 - 6 раз. И строят график. 42.эмульгирование жиров. Эмульгирование жиров в кишечнике осуществляется при участии солей желчных кислот. Основное переваривание жиров происходит в тонком кишечнике. Соли желчных кислот адсорбируются в присутствии небольших количеств свободных жирных кислот и моноглицеридов на поверхности капелек жира в виде тончайшей пленки, препятствующей слиянию этих капелек. В 5 пробирках помещают по 2 капли растительного масла и добавляют по 1 мл дистил воды. Затем 1-ую пробирку – 5 капель желчи, в 2-ую 5 капель р-ра едкого кали, в 3-ую 5 капель р-ра углекислого натрия, в 4-ую 5 капель р-ра белка, в 5-ую 5 капель воды. Пробирку встряхивают и наблюдают образование устойчивой эмульсии во всех пробирках кроме 5. 43.определение свободных жирных кислот. в крови сод-ся свободных жирных кислот 640-880мкмоль/л. ПРИНЦИП МЕТОДА: медные соли жирных кислот способны образовывать с диэтилдитиокарбаматом натрия окрашенные комплексные соединения, интенсивность окраски которых пропорциональна концентрации свободных жирных кислот. ХОД: в 1-ю пр-ку вносят сыворотку крови, а в другую пальмитиновую кислоту в хлороформе. В обе пробирки доб-ют хлороформ и медного реактива. Пробирки закрывают и встряхивают в течении 3 мин. Содержимое центрифугируют при 3000об/мин в течение 15 мин. Смесь в пробирках разд-ся на три слоя: хлороформ, белок, вода. водную фазу удаляют, белковую пленку сдвигают на стенки пробирок =, а хлороформный слой переносят в пробирки и к это слою доб-ют р-р диэтилдитиокарбамата натрия в бутаноле и перемешивают. Содержимое своб.жир.кислот рассч-ют по формуле Е пробы х 1000/Е стандарта х 0,5 мкмоль/л 44.выделение холестерина из мозга. Холестерин и его эфиры встречаются в крови и различных тканях животных: в головном мозге, кожном сале, желчи. В мозге холестерин в норме содержится в свободном виде. ХОД: в ступке растирают 1 грамм мозга с 2-3 частями гипса, затем тонким слоем распределяют на предметном стекле и высушивают при 60С. Высушенный с гипсом мозг соскабливают скальпелем и заливают хлороформом. Затем экстрагируют при комнатной температуре, постоянно встряхиваю, и затем экстракт фильтруют в сухую пр-ку. К экстракту приб-ют уксусный ангидрид и конц.серную к-ту. Наблюд-ся зеленое окрашивание. 45. определение наличия холестерола в крови. Клинико-диагностическое значене. Холестерин в присутс.уксусного ангидрида и смеси укс.и серной к-т даёт зелёное окрашивание. При нарушении жирового обмена хс может накапливаться в кроаи. Увеличение сод-я хс в крови (гиперхолистеринемия) наблюдается при атеросклерозе, сахарном диабете,механич.желтухе,нефрите, нефрозе, гипотиреозе. Понижение хс в крови (гипохолистеринемия) – при анемиях, голодании, туберкулезе,раковой кахексии,панкрематозной желтухе, поражении ЦНС,лихорад-х сост-ях,при введении инсулина 46. определение липопротеинов низкой плотности в крови. Большинство липидов находится в крови не в свободном состоянии, а в составе белково- липидных комплексов. ПРИНЦИП МЕТОДА: в основу метода положена способность липопротеидов осаждаться в присутствии хлорида кальция и гепарина, при этом изменяется мутность р-ра. По степени помутнения и судят о концентрации липопротеидов в сыворотке крови. Считают что гепарин способен образовывать с липопротеидами комплекс, который под действием хлорида 47. определение кетоновых тел в моче. Кетоновые тела - нормальный продукт липидного обмена. Значение кетоновых тел - энергетическое. Кетоз возникает при патологических состояниях, связанных с недостатком углеводов в тканях (сахарный диабет, голодание, мальабсорбция пищевых сахаров у детей младшего возраста, токсикозы беременности и др.). Кетоз сопровождается ацидозом тканей, что приводит к нарушению метаболизма. При этом определяется повышение уровня кетоновых тел в крови - кетонемия и появление их в моче - кетонурия. ПРИНЦИП МЕТОДА.Смесь нитропруссида Nа и аммиака при наличие кетоновых тел в тканях дает малиновое окрашивание. кальция выпадает в осадок. В-окисление жирных кислот. окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. Первая стадия β-окисления — дегидрирование активированной жирной кислоты (ацил-КоА) с образованием β-ненасыщенной жирной кислоты с двойной связью в транс-конфигурации (реакция 1: дегидрирование). При этом оба атома водорода с электронами переносятся от фермента наэлектронпереносящий флавопротеин Вторая стадия деградации жирной кислоты состоит в присоединении молекулы воды к двойной связи ненасыщенной жирной кислоты (реакция [2]: гидратирование). На третьей стадии происходит окисление гидроксильной группы при С-3 в карбонильную группу (реакция [3]:дегидрирование). На четвертой стадии активированная β-кетокислота расщепляется ацилтрансферазой (β-кетотиолазой) в присутствии кофермента А (реакция [4]: тиолитическое расщепление). Продуктами реакции являются ацетил-КоА и активированная жирная кислота, углеродная цепь которой короче на два углеродных атома по сравнению с длиной цепи исходной жирной кислоты. 10. Холестерин, биологическое значение. Биосинтез холестерина до меваловои кислоты. Холестери́н - органическое соединение, природный жирный (липофильный) спирт, содержащийся в клеточных мембранах всех живых организмов, за исключением безъядерных (прокариоты). Нерастворим в воде, растворим в жирах и органических растворителях. Около 80% холестерина вырабатывается самим организмом (печенью, кишечником, почками, надпочечниками, половыми железами), остальные 20% поступают с пищей. 80% холестерина в организме свободные, а 20% — связанные. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов, включая кортизол, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормонатестостерона, играет важную роль в деятельности нервной и иммунной системы. Биосинтез:
Патологии липидного обмена. Нормальное содержание общих липидов в сыворотке крови составляет 4-8 г/л. Увеличение общих липидов называется гиперлипемией.
|
|||||||||
|
Последнее изменение этой страницы: 2019-05-19; просмотров: 188; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.116.20 (0.074 с.) |


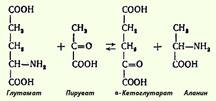 Для клинических целей наибольшее значение имеют две трансаминазы - аспартатаминотрансфераза и аланинаминотрансфераза, катализирующие соответственно следующие обратимые реакции:
Для клинических целей наибольшее значение имеют две трансаминазы - аспартатаминотрансфераза и аланинаминотрансфераза, катализирующие соответственно следующие обратимые реакции: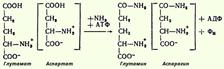 Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% всего азота мочи.
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% всего азота мочи.