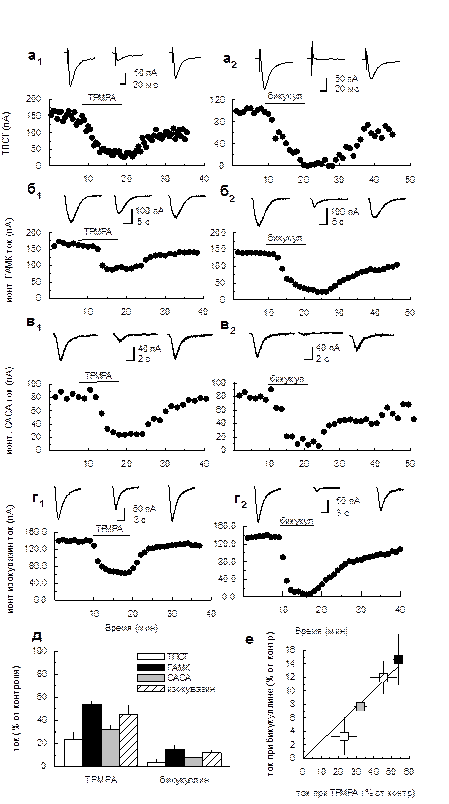Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пентобарбитал по-разному модулирует ГАМКергические токи, вызываемые аппликацией CACA (50 mМ)
ГАМКС рецепторы не чувствительны к аллостерическим модуляторам ГАМКА рецепторов, включая барбитураты (Barnard et al. 1998; Bormann 2000b; Johnston 1996; Zhang et al. 2001). Если ток, возникающий при аппликации САСА (50 µМ), опосредован ГАМКС рецепторами, то он не должен быть чувствителен к
Рис. 3.1.5 Пентобарбитал потенцирует ток, вызываемый аппликацией CACA в интернейронах, но не в пирамидных клетках Аппликация CACA проводилась при базовых условиях (контр., пентобарбиталу. Когда мы провели аппликацию CACA в присутствии пентобарбитала (10 и 100 mМ), мы не обнаружили в пирамидных клетках изменений в величине САСА-тока, по сравнению с током в отсутствие пентобарбитала (96 ± 4 % - ток в присутствии 10 mМ пентобарбитала от тока в его отсутствие; n=4; p=0,39 и 122 ± 41 % в присутствии 100 mМ пентобарбитала; n=4; p=0,62; Рис. 3.1.5б,в). Учитывая, что пентобарбитал значительно потенцирует ГАМКергические ТПСТ в пирамидных клетках, можно сделать заключение о наличии в них отдельных популяций ГАМКА и ГАМКС-подобных рецепторов. Неожиданно, токи, вызываемые аппликацией CACA в интернейронах, значительно усиливались в присутствии пентобарбитала (120 ± 15 %; n=4; p=0,12 и 296 ± 38 %; n=4; p=0,008 при добавлении 10 и 100 mМ пентобарбитала, соответственно; Рис. 3.1.5а,в). Таким образом, ГАМКергические рецепторы в интернейронах, которые активируются САСА, также модулируются пентобарбиталом. Таких фармакологических свойств ГАМКергических рецепторов никогда прежде показано не было. Чтобы исключить возможность ошибки, мы решили провести более детальное изучение особенностей данных токов с использованием других специфических агонистов и антагонистов ГАМКА и ГАМКС рецепторов.
3.1.5 ТПСТ в интернейронах, регистрируемые в присутствии 100 mМ пикротоксина, обладают повышенной чувствительностью к антагонисту ГАМКС рецепторов Помимо использования специфического агониста ГАМКС рецепторов для разделения ГАМКА и ГАМКС, можно воспользоваться селективными антагонистами данных рецепторов. В представленной работе мы использовали (1,2,5,6-тетрогидропиридин-4-ил)метилфосфоновую кислоту (TPMPA) в качестве антагониста ГАМКС рецепторов (Ragozzino et al. 1996). Мы исследовали эффект 200 mМ TPMPA на амплитуду синаптических ТПСТ в интернейронах и пирамидных клетках. Аппликация этого антагониста производила относительно небольшое снижение ТПСТ вызванных как в интернейронах, так и в пирамидных клетках (68 ± 8 %; n=7 и 60 ± 2 %; n=5 от базовых значений в интернейронах и пирамидных клетках, соответственно; p=0,28 t-тест между типами клеток Рис.3.1.6). Поскольку пикротоксин (100 mМ) не полностью блокировал ТПСТ в интернейронах (Рис.3.1.1), мы решили проверить имеет ли остаточный ТПСТ отличную чувствительность к ТPMPA. Оказалось, что TPMPA в присутствии пикротоксина подавляет остаточный ТПСТ в значительно большей степени, чем ТПСТ до добавления пикротоксина (20 ± 6 %; n=4; от базовых значений ТПСТ в присутствии пикротоксина; p=0,03 t-тест между эффектами TPMPA на ТПСТ с пикротоксином и без него; Рис.3.1.6). Этот результат указывает на то, что популяция рецепторов в интернейронах, которая обладает сниженной чувствительностью к пикротоксину, обладает более высокой чувствительностью к TPMPA. Такой фармакологический профиль данных рецепторов указывает на их сходство с ГАМКС рецепторами (McGillem et al. 2000; Zhang et al. 1995b). 3.1.6 Токи, опосредованные ГАМКергическими рецепторами, в присутствии 100 mМ пикротоксина возникают за счет характерной Cl-/HCO3- ионой проводимости
Исходя из полученных данных, можно заключить, что пикротоксин (100 mМ) изолирует в интернейронах популяцию ионотропных ГАМКергических рецепторов с
Рис. 3.1.6 ТПСТ в интернейронах, изолированные аппликацией 100 μМ пикротоксина, более чувствительны к TPMPA Мы исследовали чувствительность ТПСТ в интернейронах (а1) и пирамидных клетках (а2) к TPMPA (антагонисту ГАМКС рецепторов). Было показано, что TPMPA 200 μМ подавляет ТПСТ в отсутствии пикротоксина в обоих типах клеток лишь в небольшой степени, тогда как ТПСТ, оставшийся в интернейронах после добавления 100 μМ пикротоксина, подавляется значительно (а3). Оригинальные записи ТПСТ (усреднены по 10 последовательным ответам) полученные с одного интернейрона и одной пирамидной клетки. б, Гистограмма, демонстрирующая усредненные данные полученные с нескольких клеток. TPMPA (200 μМ) подавлял ТПСТ в пирамидных нейронах (ПК) до 60 ± 2 % (n=5) от базовых значений, в интернейронах в отсутствие пикротоксина (ИН) до 68 ± 8 % (n=7) и в присутствии 100 μМ пикротоксина (ИН пикр) до 20 ± 6 % (n=4). *: p=0,03
нетипичными фармакологическими свойствами. По этой причине дальнейшую часть исследования мы провели в присутствии 100 mМ пикротоксина. Для того чтобы проверить соответствует ли ионный состав ТПСТ в присутствии пикротоксина току, опосредуемому ионотропными ГАМКергическими рецепторами мы построили зависимости регистрируемого тока от потенциала фиксации (I-V зависимости). Использование I-V зависимостей позволило нам определить потенциал реверсии ТПСТ (Рис. 3.1.7а). Традиционно ГАМКергический ТПСТ рассматривается как ток, состоящий из анионов Cl- и HCO3-. Мы рассчитали ECl-/HCO3- по уравнению Нернста, исходя из содержания этих ионов во внеклеточном и внутриклеточном растворах. При использовании внутриклеточного раствора с высоким содержанием ионов хлора (см. Материалы и методы: внутриклеточный раствор на основе CsCl) ТПСТ меняли направление при –0,2 ± 5 мВ (n=6), что соответствует ECl-/HCO3- (-1,15 мВ) (Рис. 3.1.7а1). При использовании внутриклеточного раствора с низким содержанием ионов хлора (см. Материалы и методы: внутриклеточный раствор на основе Cs глюконата) потенциал реверсии ТПСТ смещался в соответствии с изменением концентрации данных ионов в область более негативных значений (Рис. 3.1.7а2). Ионтофорез ГАМК (100 мМ) и CACA (100 мМ) также вызывал токи с потенциалом реверсии соответствующим рассчетному ECl-/HCO3- (Рис. 3.1.7 б,в). Кроме этого, характер I-V зависимостей ионтофоретических токов напоминал I-V кривую, полученную для ТПСТ при использовании идентичного внутриклеточного раствора. Этот факт свидетельствует в пользу того, что синаптические и ионтофоретические токи опосредованы одинаковыми ионами и, вероятно, одинаковыми рецепторами. Это наблюдение, позволяет в дальнейшем рассматривать данные, полученные по ТПСТ и по ионтофоретическим токам вместе, для описания свойств одних и тех же рецепторов.
Рис. 3.1.7 ТПСТ и токи в ответ на ионтофорез ГАМК и CACA в присутствии пикротоксина в интернейронах опосредованы Cl-/HCO3- а, ТПСТ в интернейронах полученные в присутствии D-APV (50 μM), NBQX (20 μM), CGP52432 (5 mM) и пикротоксина (100 µМ) при различных потенциалах фиксации с использованием внутриклеточного раствора с высоким (а1, n=6) и низким (а2, n=4) содержанием ионов хлора. Оригинальные записи, полученные с одного интернейрона для каждого раствора, показаны слева от ток-потенциал (I-V) зависимостей. Данные для I-V зависимостей усреднены по нескольким клеткам, в которых ТПСТ нормировались к ТПСТ при потенциале фиксации 80 мВ. Теоретически полученное по уравнению Нернста значение ECl‑HCO3- обозначено на графиках крестиком. Потенциал реверсии, полученный в данных экспериментах, был близок к расчетному потенциалу тока, опосредованного Cl-/HCO3-, и изменялся в соответствии с содержанием ионов хлора во внутриклеточном растворе. Токи в ответ на ионтофоретическую аппликацию 200 мМ ГАМК (б, n=4) и 200 мМ CACA (в, n=4) в тех же экспериментальных условиях при использовании внутриклеточного раствора с высоким содержанием ионов хлора в интернейронах при различных потенциалах фиксации изменялись сходным образом с ТПСТ, а их потенциал реверсии соответствовал Cl-/HCO3- току. Таким образом, данные результаты свидетельствуют в пользу того, что как синаптически высвобождаемая ГАМК, так и ионтофоретические апплицированные агонисты (ГАМК и CACA) активирует одни и те же устойчивые к пикротоксину ГАМКергические рецепторы, обладающие Cl-/HCO3- проводимостью. Разбросы указывают С.О.С.
3.1.7 Эффект аллостерических модуляторов ГАМКА рецепторов на устойчивые к пикротоксину токи, опосредованные ГАМКергическими рецепторами В предыдущем разделе мы показали, что ток, вызываемый в интернейронах генерализованной аппликацией CACA, чувствителен к пентобарбиталу. Мы решили проверить, каким образом аллостерические модуляторы ГАМКА рецепторов, такие как барбитураты и бензодиазепины, будут влиять на изолированные пикротоксином ТПСТ и ионтофоретические токи, вызываемые ГАМК и CACA. Если устойчивые к пикротоксину токи опосредованы ГАМКС рецепторами, то они не будут чувствительны к этим модуляторам. Все три тока были потенцированы при добавлении 100 mМ пентобарбитала: ТПСТ до 478 ± 76 % (n=4; p=0,015; Рис. 3.1.8а); ионтофоретический ГАМК ток до 220 ± 14 % (n=4; p=0,004; Рис. 3.1.8б) и ионтофоретический CACA ток до 288 ± 28 % (n=5; p=0,003; Рис. 3.1.8в). Эффект пентобарбитала на ТПСТ также состоял в увеличении константы затухания токов (tзатухания: 500 ± 67 % от базовых значений; n=4; p=0,009; Рис. 3.1.8а2), что указывает на увеличение времени открытого состояния каналов ГАМКергических рецепторов (Macdonald and Kelly 1994).
Когда мы провели исследование чувствительности ТПСТ и ионтофоретических токов к бензодиазепинам, выяснилось, что золпидем (0,2 mМ) производит сравнительно небольшой эффект на амплитуду ТПСТ, устойчивого к пикротоксину, по сравнению с эффектом на амплитуду ТПСТ без пикротоксина (ТПСТ при аппликации золпидема был 108 ± 12 % от базовых значений в присутствии пикротоксина и 158 ± 8 % без пикротоксина; p=0,002; Рис. 3.1.9). Эти данные указывают на то, что остаточный ТПСТ (в присутствии пикротоксина) относительно нечувствителен к
Рис. 3.1.8 Пентобарбитал (100 µМ) приводит к увеличению ТПСТ и ионтофоретических ГАМК и CACA токов в присутствии пикротоксина (100 µМ) (см. подписи на следующей странице) а, Эффект пентобарбитала (аллостерического модулятора ГАМКА рецепторов, 100 µМ) на ТПСТ записанные в присутствии D-APV (50 μM), NBQX (20 μM), CGP52432 (5 mM) и пикротоксина (100 µМ). а1, Оригинальные записи (усреднение по 10 последовательным регистрациям), полученные с одного интернейрона в ответ на синаптическую стимуляцию до (жирная линия) и во время (тонкая линия) аппликации пентобарбитала. а2, Пентобарбитал увеличивает константу затухания ТПСТ (данные получены по тем же токам что и на а1). Нормированные по амплитуде ТПСТ фазы затухания тока показаны до (контр) и во время (пент) добавления пентобарбитала в полулогарифмических координатах. Зависимости тока в фазе затухания от времени были моноэкспоненциально аппроксимированы: τзатух(пент)=500 ± 67 % от τзатух(контр); n=4; p=0,009 а3, Амплитуда ТПСТ (среднее ± С.О.С) была нормирована к средней амплитуде ТПСТ перед добавлением пентобарбитала. Пентобарбитал значительно увеличивал амплитуду ТПСТ (478 ± 76 % от базовых значений ТПСТ в присутствии пикротоксина; n=4; p=0,015), так же как и амплитуду токов на ионтофорез 200 мМ ГАМК (220 ± 14 % от базовых значений ГАМК тока в присутствии пикротоксина; n=4; p=0,004; б) и 200 мМ CACA (288 ± 28 % от базовых значений CACA тока в присутствии пикротоксина; n=5; p=0,003; в). Ионтофоретические токи были получены в присутствии тех же агонистов и нормированы таким же образом, что и ТПСТ. Оригинальные записи (каждая усреднена по 10 последовательным регистрациям), представленные над графиками, получены до, во время и после добавления пентобарбитала (пент, 100 µМ) с одного интернейрона при ионтофорезе ГАМК и с одного при ионтофорезе CACA. Разбросы указывают С.О.С.
бензодиазепинам, что является характерной чертой ГАМКС рецепторов. С другой стороны, известно, что ГАМКА рецепторы, в которых отсутствует α1 субъединица, также менее чувствительны к бензодиазепинам (Thomson et al. 2000). Таким образом, низкая чувствительность к золпидему может быть объяснена отсутствием данной субъединицы в ГАМКергических рецепторах, слабо чувствительных к пикротоксину. Еще одним объяснением может быть зависимость эффекта золпидема от занятости рецепторов агонистом. Чем выше занятость ГАМКергического рецептора синаптически высвобождаемой ГАМК, тем эффект золпидема меньше (Hajos et al. 2000; Perrais and Ropert 1999). Можно предположить, что ток, изолированный аппликацией пикротоксина, опосредован рецепторами с более высокой средней занятостью агонистом, чем средняя занятость чувствительных к пикротоксину ГАМКергических рецепторов, опосредующих ТПСТ. Это различие в занятости рецепторов агонистом может быть объяснено их локализацией на разном расстоянии
Рис. 3.1.9 ТПСТ в интернейронах, изолированные аппликацией 100 μМ пикротоксина, менее чувствительны к золпидему Мы исследовали эффект золпидема (аллостерического модулятора ГАМКА рецепторов, 200 нМ) на ТПСТ в отсутствие пикротоксина (D-APV (50 μM), NBQX (20 μM) и CGP52432 (5 mM) были добавлены) и в присутствии 100 µМ этого антагониста. а, Оригинальные записи (каждая среднее 10 последовательных регистраций), полученные с одного интернейрона в ответ на синаптическую стимуляцию до (жирная линия) и во время (тонкая линия) аппликации золпидема без пикротоксина. Золпидем вызывал значительное увеличение, как амплитуды, так и константы затухания (τзатух) этих ТПСТ. Нормированные фазы затухания в полулогарифмических координатах до (контр) и во время (злпм) аппликации золпидема показаны справа от оригинальных записей, из которых они получены. Зависимости тока в фазе затухания от времени были моноэкспоненциально аппроксимированы. б, Оригинальные записи (каждая среднее 10 последовательных регистраций) в ответ на синаптическую стимуляцию до (жирная линия) и во время (тонкая линия) аппликации золпидема в присутствии тех же антагонистов как в а и, дополнительно, пикротоксина (100 µМ). ТПСТ,изолированный аппликацией 100 μМ пикротоксина, подвергался эффекту золпидема в меньшей степени, чем базовый. Было показано меньшее увеличение константы затухания тока и отсутствие значительных изменений в амплитуде ТПСТ. в, Данные полученные в нескольких клетках обобщены в виде гистограмм изменения констант затухания и амплитуд базового (базов) и изолированного добавлением пикротоксина (пикр) ТПСТ при аппликации золпидема нормированных к средним значениям токов перед этой аппликацией.
от места высвобождения медиатора или локализацией в разных синапсах, где исходно наблюдается большая или меньшая занятость рецепторов. Таким образом, данные по эффекту золпидема не могут служить доказательством участия ρ-субъединиц в регистрируемых токах, хотя они четко указывают на гетерогенность популяции ионотропных ГАМКергических рецепторов в интернейронах. 3.1.8 Сравнение эффективности антагонистов ГАМКА и ГАМКС рецепторов на устойчивые к пикротоксину токи, опосредованные ГАМКергическими рецепторами Для подтверждения того, что ионотропные ГАМКергические рецепторы в интернейронах str.radiatum поля CA1 срезов гиппокампа обладают свойствами как ГАМКА, так и ГАМКС рецепторов, мы решили проверить эффект специфических антагонистов этих двух типов рецепторов на ТПСТ и ионтофоретически вызываемые токи в присутствии пикротоксина (100 μМ). В качестве антагониста ГАМКА рецепторов был выбран бикукуллин (10 μМ), а в качестве антагониста ГАМКС рецепторов - TPMPA (200 μМ). Если эти токи гетерогенны, то компонент, опосредуемый ГАМКС рецепторами, будет подавляться TPMPA, но будет нечувствительным к бикукуллину. Компонент, опосредованный ГАМКА рецепторами, должен подавляться бикукуллином, но быть нечувствительным к TPMPA. На рисунке
Рис. 3.1.10 ТПСТ и ионтофоретические ГАМК-, CACA- и изогувазин -токи в интернейронах, в присутствии 100 μМ пикротоксина, подавляются как антагонистом ГАМКС рецепторов TPMPA, так и ГАМКА – бикукуллином (см. подписи на следующей странице) Мы сравнили эффекты специфических антагонистов ГАМКС и ГАМКА рецепторов: TPMPA (200 µМ; буквы с индексом 1) и бикукуллина (10 µМ; буквы с индексом 2), соответственно. ТПСТ (а1, а2), ионтофоретические токи в ответ на аппликацию ГАМК (б1, б2), CACA (в1, в2) и изогувазин (г1, г2), полученные в присутствии пикротоксина 100 µМ, подавлялись в значительной степени обоими антагонистами. Данные показаны для одного интернейрона в каждом случае. Оригинальные токи (в каждом случае усреднение по 10 последовательным регистрациям) расположены над графиками динамики ответов и показывают ток до, во время и после добавления антагониста. д, Усредненные ответы, полученные по нескольким клеткам (статистические данные представлены в таблице 3.1.2). е, Относительная степень подавления ответов TPMPA и бикукуллином была сходной для всех четырех типов токов и могла быть линейно аппроксимирована.
3.1.10а,д показано, что ТПСТ в интернейронах, регистрируемые в присутствии пикротоксина, подавляются в значительной степени обоими антагонистами (23 ± 7 % от базовых значений; n=5; p=0,01 при аппликации TPMPA и 3 ± 3 %; n=4; p=0,002 при аппликации бикукуллина). Столь значительное подавление синаптических токов обоими антагонистами указывает на то, что они не могут состоять частично из ГАМКА и ГАМКС компонентов. Этот результат свидетельствует в пользу существования одной популяции рецепторов, обладающей свойствами обоих типов рецепторов. В подтверждение этому, токи, полученные в ответ на ионтофорез ГАМК или САСА, также в значительной степени подавлялись обоими антагонистами и (для ГАМК: 54 ± 3 % от базовых значений; n=4; p=0,02 при аппликации TPMPA и 15 ± 4 %; n=7; p=0,008 при аппликации бикукуллина; Рис. 3.1.10б,д; для САСА: 32 ± 4 % от базовых значений; n=4; p=0,015 при аппликации TPMPA; 8 ± 1 %; n=4; p=0,0007 при аппликации бикукуллина; Рис. 3.1.10в,д). Однако, ГАМК является эндогенным агонистом как ГАМКА, так и ГАМКС рецепторов. Для подтверждения фармакологического профиля ГАМКА рецепторов, мы использовали для ионтофореза специфический агонист этих рецепторов – изогувазин (100 мМ) (Kusama et al. 1993; Woodward et al. 1993). Ток, вызываемый изогувазином, также подавлялся как TPMPA,
так и бикукуллином (45 ± 8 % от базовых значений; n=5; p=0,02 при аппликации TPMPA и 12 ± 2 %; n=5; p=0,017 при аппликации бикукуллина; Рис. 3.1.10г,д). Относительная степень подавления всех вышеописанных токов (соотношение эффектов TPMPA/бикукуллин) была сходной (Рис. 3.1.10е и Таблица 3.1.2), что говорит о сходстве их природы. Таким образом, полученные данные указывают на наличие в интернейронах поля СА1 гиппокампа одной популяции ионотропных ГАМКергических рецепторов, но обладающей свойствами двух различных типов.
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2019-04-27; просмотров: 117; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.246.203 (0.028 с.) |

 ), при добавлении 10 μМ (пент 10,
), при добавлении 10 μМ (пент 10,  ). Добавление пентобарбитала в суперфузионный раствор приводило к концентрационно-зависимому сдвигу тока компенсации как в интернейронах (а, данные с одной клетки), так и в пирамидных клетках (б, данные с одной клетки). Причем, ток в ответ на аппликацию CACA (агониста ГАМКС рецепторов) усиливался в интернейронах и оставался неизменным в пирамидных клетках при добавлении пентобарбитала (аллостерического модулятора ГАМКА рецепторов). в, Гистограмма, показывающая усредненный эффект пентобарбитала на ток вызываемый CACA: в интернейронах в присутствии 10 μМ пентобарбитала ток достигал 120 ± 15 %; n=4; p=0,12 от тока при базовых условиях, а присутствии 100 μМ пентобарбитала 296 ± 38 %; n=4; p=0,008, тогда как в пирамидных нейронах эти значения были 96 ± 4 %; n=4; p=0,39 и 122 ± 41 %; n=4; p=0,62. Эти результаты указывают на наличие в пирамидных нейронах ГАМК рецепторов, фармакологически сходных с ГАМКС, тогда как в интернейронах фармакологический профиль рецепторов, активируемых CACA, не может быть отнесен ни к одному из известных типов рецепторов. *: p<0,05
). Добавление пентобарбитала в суперфузионный раствор приводило к концентрационно-зависимому сдвигу тока компенсации как в интернейронах (а, данные с одной клетки), так и в пирамидных клетках (б, данные с одной клетки). Причем, ток в ответ на аппликацию CACA (агониста ГАМКС рецепторов) усиливался в интернейронах и оставался неизменным в пирамидных клетках при добавлении пентобарбитала (аллостерического модулятора ГАМКА рецепторов). в, Гистограмма, показывающая усредненный эффект пентобарбитала на ток вызываемый CACA: в интернейронах в присутствии 10 μМ пентобарбитала ток достигал 120 ± 15 %; n=4; p=0,12 от тока при базовых условиях, а присутствии 100 μМ пентобарбитала 296 ± 38 %; n=4; p=0,008, тогда как в пирамидных нейронах эти значения были 96 ± 4 %; n=4; p=0,39 и 122 ± 41 %; n=4; p=0,62. Эти результаты указывают на наличие в пирамидных нейронах ГАМК рецепторов, фармакологически сходных с ГАМКС, тогда как в интернейронах фармакологический профиль рецепторов, активируемых CACA, не может быть отнесен ни к одному из известных типов рецепторов. *: p<0,05