
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вимоги до виконання рефератів індзСодержание книги
Поиск на нашем сайте
ОПИС НАВЧАЛЬНОЇ ДИСЦИПЛІНИ Розвиток сучасного машинобудування викликає необхідність широкого застосування нержавіючих, жароміцних, високоміцних і інших спеціальних сталей і сплавів. Оброблюваність різанням таких матеріалів у багато разів нижча оброблюваності звичайних конструкційних сталей, а деякі з них узагалі не піддаються різанню. Складність одержання деталей зі спеціальних матеріалів збільшується також безупинним підвищенням вимог до якості обробки по чистоті, точності і до фізико - механічних властивостей поверхневого шару. Для поліпшення оброблюваності спеціальних металевих матеріалів проводяться дослідження з удосконалення процесу різання і різальних інструментів. Однак такий шлях у багатьох випадках не вирішує в даний час проблеми розмірного формоутворення деталей. З появю нових марок сталей і сплавів труднощі обробки деталей різанням зростають. Одним з найбільш перспективних шляхів вирішення цих питань є впровадження і подальше удосконалювання електричних (електроерозійних і електрохімічних) та хімічних методів обробки металів, що значно розширюють можливості машинобудівних заводів і за останні роки усе більш успішно використовуються як в Україні, так і закордоном. 1.1 Мета викладання дисципліни. Сформувати уявлення та дати знання про електрофізичні та хімічні методи обробки матеріалів, про механізми, покладені в основу того, чи іншого методу, коло застосування, переваги (недоліки) кожного з методів. Предмет навчальної дисципліни. Фізичні основи взаємодії з оброблюваними матеріалами електричної енергії у вигляді електричного розряду, плазми, лазерного, електронного та іонного пучків, ультразвуку, імпульсних електромагних полів, а також технологічні операції і пристрої для проведення операцій по електрофізисній обробці матеріалів. Курс ”Електрофізичні та хімічні методи обробки матеріалів” базується на попередніх курсах, що вивчаються: ”Хімія”, ”Фізика”, ”Устаткування та технологія заготівельних виробництв”, ”Нарисна геометрія”, ”Електротехніка”, ”Матеріалознавство”. 1.2 Завдання вивчення дисципліни. Основними завданнями курсу являються: · ознайомлення із роллю і місцем дисципліни в розвиткові сучасної техніки і технології; · ознайомлення з фізичними основами електрофізичних і електрохімічних методів обробки матеріалів; · ознайомлення із сферами застосування електрофізичних і електрохімічних методів обробки матеріалів; · ознайомлення з устаткуванням, яке використовується при електрофізичних і електрохімічних методах обробки; · вивчення технологічних процесів виготовлення заготовок і деталей з використанням методів електротехнологій в умовах машинобудівного виробництва; · вивчення техніко-економічного обгрунтування застосування даних методів обробки. 1.3 Компетенції, які необхідно розвивати в результаті вивчення навчальної дисципліни: У результаті вивчення курсу студент має набути таких компетенцій: Студент повинен мати уявлення: · про роль і місце вивчаємої дисципліни в развиткові сучасної техніки і технології; · про фізичні основи взаємодії з оброблюваними матеріалами електричної енергії у вигляді електричного розряду, плазми, лазерного, електронного та іонного пучків, ультразвуку, імпульсних електромагних полів; · про області застосування електрофізичних і електрохімічних методів обробки матеріалів; · про критерії за якими визначають той чи інший спосіб обробки; · переваги та недоліки того чи іншого методу обробки; · можливості практичного застосування з використанням (модернізацією) типових верстатів для механічних методів обробки; · про основи техніко-економічного обгрунтування застосування електрофізичних і електрохімічних методів обробки. Вміти: · запропонувати (вибрати) методи і способи отримання деталей в залежності від вимог, які ставляться до їх якості та від фізико-технічних характеристик матеріалу; · провести порівняльну характеристику різних методів обробки; · призначити оптимальний вид обробки; · користуватися відповідними каталогами і довідковою літературою; · складати типові технологічні процеси виготовлення заготівок, деталей виробів і машин. Тематика ІНДЗ 1. Виробництво хлорату натрію (NaClO3).[14] 2. Виробництво хлорної кислоти (HClО4).[14] 3. Виробництво перманганату калію (KMnO4).[14] 4. Застосування електрохімічних процесів для регенерації відходів на виробництві (солей марганцю, хрому, травильних розчинів).[14] 5. Виробництво натрію шляхом електролізу розплавлених середовищ.[14] 6. Виробництво калію шляхом електролізу розплавлених середовищ.[14] 7. Виробництво фтору шляхом електролізу розплавлених середовищ.[14] 8. Виробництво алюмінію шляхом електролізу розплавлених середовищ.[14] 9. Виробництво магнію шляхом електролізу розплавлених середовищ.[14] 10. Отримання металів шляхом електрорафінування (Cu, Ag, Au, Ni, Pb, Sb, Sn).[14] 11. Електролітичне отримання металів (Zn, Mn, Fe, Co, Cr).[14] 12. Продуктивність і точність процесу електрохімічної розмірної обробки.[15] 13. Технологічні процеси електрохімічної розмірної обробки деталей.[15] 14. Вплив електрохімічної розмірної обробки на механічні властивості металів.[15] 15. Обладнання для електрохімічної розмірної обробки деталей машин.[15] 16. Генератори імпульсів електроерозійних станків.[22] 17. Автоматичні регулятори міжелектродного проміжку електроерозійних станків.[22] 18. Техніка безпеки і охорона праці при роботі на електроерозійних станках (висока напруга, пожежна безпека, проф.захворювання, травматизм).[22] 19. Формування шорсткості поверхні при електроерозійній обробці.[23] 20. Структура і властивості поверхневого шару, підданого дії електроерозійної обробки.[23] 21. Особливості технологічних процесів електроерозійної обробки.[23] 22. Фактори впливаючі на точність електроерозійної обробки.[23] 23. Особливості викотовлення типових деталей методом електроерозійної обробки (порожнин, валів, матриць, спряжених поверхонь).[23] 24. Розрахунок розмірів електрод-інструментів для електроерозійної обробки.[23] 25. Анодування алюмінію у водних розчинах електролітів.[27] 26. Анодування у низькотемпературній кисневовмістній плазмі.[27] 27. Анодування алюмінію, заліза і міді у розчинах солей.[27] 28. Контроль якості анодних окислів.[27] 29. Локальні види корозії.[28] 30. Методи дослідження матеріалів на стійкість проти корозії.[28] 31. Корозія металів у природних та технологічних середовищах.[28] 32. Захист металів від корозії нанесенням тонкошарових покриттів.[28] 33. Електрохімічні методи протикорозійного захисту металів.[28] Вимоги до рефератів ІНДЗ Вимоги до виконання рефератів ІНДЗ § індивідуальні завдання містять 10-15 сторінок машинописного тексту (основна частина); § мета і завдання реферату мають бути чіткими і відображати суть досліджуваної проблеми, вміст повинен відповідати темі завдання і відображати стан проблеми; § при розробці індивідуального завдання мають бути використані не менше 7 різних джерел; § робота повинна містити узагальнені висновки і рекомендації. Вимоги до структури рефератів Структура рефератів і контрольних робіт повинна містити: § Титульний лист (титульний лист є першою сторінкою реферату); § Зміст (зміст включає: вступ; найменування всіх розділів, підрозділів, пунктів і підпунктів основної частини завдання; висновки; список джерел інформації); § Вступ (у вступі коротко формулюється проблема, указується мета і завдання реферату); § Основна частина (складається з декількох розділів, в яких висловлюється суть реферату); § Висновки або Висновок (у висновках приводять оцінку отриманих результатів роботи, пропонуються рекомендації); § Список джерел інформації (містить перелік джерел, на які посилаються в основній частині реферату). Лекція 1. Вступна лекція Тема 1. Загальні відомості. 1. Особливості методів електротехнології. 2. Класифікація електрофізичних та електрохімічних методів обробки матеріалів. 3. Області застосування електрофізичних та електрохімічних методів обробки матеріалів. Тестові завдання до НЕ 1.1. Тест 1. Якою основною відмінністю електрофізичних і електрохімічних методів обробки від механічної обробки різанням або тиском є: 1. Безпосереднє використання в ролі оброблювального інструменту електрохімічної та електрофізичної енергії або специфічних фізичних явищ, що створюються цими енергіями. 2. Безпосереднє використання в ролі оброблювального інструменту атомної енергії або специфічних фізичних явищ, що створюються цією енергією. 3. Безпосереднє використання в ролі оброблювального інструменту теплової енергії або специфічних фізичних явищ, що створюються цією енергією. 4. Безпосереднє використання в ролі оброблювального інструменту хімічної енергії або специфічних фізичних явищ, що створюються цією енергією. 5. Безпосереднє використання в ролі оброблювального інструменту електричної енергії або специфічних фізичних явищ, що створюються цією енергією.
Тест 2. Які з цих особливостей електротехнологій відрізняють їх від інших методів обробки матеріалів? 1. Практична незалежність швидкості, якості і продуктивності обробки від фізико-механічних властивостей оброблюваних матеріалів. 2. Значне скорочення витрат матеріалів. 3. Скорочення числа переходів при обробці виробів складних форм. 4. Можливість повної механізації і автоматизації. 5. Поліпшення умов праці.
Навчальний елемент 1.2. "Хімічне травлення". Лекція 2. Тема 2. "Хімічне травлення". 1. Типи розчинення. 2. Кінетика процесу. 3. Застосування. 4. Операції технологічного процесу. Типи розчинення. По характеру взаємодії з речовиною хімічне травлення являється реакцією розчинення. реакція розчинення в свою чергу розподіляється реакції трьох типів. 1. Молекулярне розчинення. В цьому випадку взаємодія між розчиненою речовиною і розчинником сильніша, ніж сили, що діють між молекулами в кристалі, і хоча оточення молекули в розчині відрізняється від її оточення в кристалі, сама молекула залишається незмінною. 2. Іонне розчинення. У розчині відбувається розділення іонного кристалу на катіони і аніони, які оточені сольватаційними оболонками (у водних розчинах утвореними полярними молекулами води), які забезпечують стійкість таких розчинів. Проте, як і в разі молекулярних розчинів, після видалення розчинника розчинена речовина може бути виділена в хімічно незміненому вигляді, хоча з нею також можуть статися морфологічні зміни. Очевидно, що ці два типи розчинення характеризуються відсутністю взаємодії розчиненої речовини з розчинником. 3. Реактивне розчинення. Процес розчинення супроводжується хімічною взаємодією між розчиненою речовиною і розчинником (з утворенням хімічної сполуки). При цьому в розчині існують продукти, хімічно відмінні від початкового стану системи. Видалення залишків розчинника не дозволяє отримати розчинену речовину в початковому вигляді ні хімічно, ні морфологічно. Прикладом такого типа розчинення може служити реакція приготування паяльної кислоти Zn(тв)+ 2НСl(р) → ZnCl2(pозч) + Н2(г)
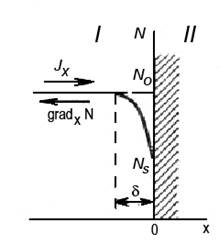
Кінетика процесу. При взаємодії поверхні з будь-яким травником спостерігається певна послідовність реакцій. В основному процес травлення можна розділити на п’ять стадій. Реагент повинен: а) досягти поверхні; б) увійти з нею в контакт (тобто адсорбуватися); в) прореагувати хімічно. Продукти реакції повинні: г) десорбуватися; д) віддалитися від поверхні. Розглянемо детальніше кінетику реактивних процесів, які відбуваються після занурення матеріалу (металевої пластини) в розчин травника (без проходження електричного струму). 1. Перенесення молекул (або іонів) травильника з об'єму розчину до поверхні матеріалу (Рис. 1.).
Рис. 1.Схема дифузії травника до поверхні пластини: І – розчин; II – матеріал.
У початковий момент після занурення пластини матеріалу в розчин поблизу її поверхні за рахунок інтенсивної реакції утворюється шар δ, збіднений молекулами травника, що приводить до виникнення градієнта концентрації травника gradx N і формуванню дифузійного потоку Jx цих молекул до поверхні матеріалу. Такий потік існує до встановлення рівноваги, час настання якої залежить від коефіцієнта дифузії компонентів травника в розчині, його в’язкості, температури і деяких інших чинників. Після закінчення цього часу концентрації молекул травника в об’ємі і біля поверхні металу вирівнюються: Ns = N 0. На цьому 1-а стадія процесу може вважатися завершеною. Застосування. 1. Зняття окислів і продуктів корозії. 2. Полірування. 3. Декоративне узорне травлення. 4. Вибіркове стравлювання. 5. Фрезерування. 6. Точіння і заточування. 7. Клеймування. 8. Зняття дефформованого шару.
Тестові завдання до НЕ 1.2. Тест 1. Якою реакцією по характеру взаємодії з речовиною являється хімічне травлення: 1. Реакцією розчинення. 2. Реакцією сполучення. 3.Реакцією перетворення 4.Реакцією виділення 5.Реакцією насичення Тест 2. На скільки типів розподіляється реакція розчинення: 1. на 2 2. на 3 3. на 4 4. на 5 5. на 6 Тест 3. Як називаються типи реакції розчинення: 1. Молекулярне, іонне, реактивне. 2. Молекулярне, іонне, фрактальне. 3. Іонне, реактивне, пасивуюче. 4. Молекулярне, іонне, реактивне, пасивуюче. 5. Молекулярне, іонне, реактивне, фрактальне. Тест 4. Скільки стадій процесу травлення? 1. 1. 2. 2. 3. 3. 4. 4. 5. 5. Тест 5. Який порядок проходженя процесу травлення? 1. досягти поверхні; адсорбуватися; прореагувати хімічно; десорбуватися; віддалитися від поверхні. 2. досягти поверхні; десорбуватися; прореагувати хімічно; адсорбуватися; віддалитися від поверхні. 3. досягти поверхні; адсорбуватися; прореагувати хімічно; віддалитися від поверхні; десорбуватися. 4. досягти поверхні; адсорбуватися; прореагувати хімічно; десорбуватися; анігілювати; віддалитися від поверхні. 5. адсорбуватися; досягти поверхні; прореагувати хімічно; десорбуватися; віддалитися від поверхні. Тест 6. Наведіть приклади застосування хімічного травлення. 1. Зняття окислів і продуктів корозії, 2. Полірування. 3. Декоративне узорне травлення. 4. Вибіркове стравлювання. 5. Фрезерування. 6. Точіння і заточування. 7. Клеймування. 8. Зняття дефформованого шару.
Тест 7. Назвіть послідовність виконання операцій хімічної розмірної обробки. 1. обезжирення, нанесення захистного покриття, травлення. 2. обезжирення, створення шорсткості, нанесення захистного покриття, травлення. 3. обезжирення, створення шорсткості, травлення. 4. Створення шорсткості, нанесення захистного покриття, травлення. 5. Нанесення захистного покриття, травлення, зняття захистного покриття.
Навчальний елемент 1.3. Лекція 3. Тема 3. "Хімічне нанесення металевих покриттів". 1. Типи реакцій. 2. Переваги і недоліки методу. 3. Підготовка поверхонь. 4. Області застосування (Ni, Cu, Co, Zn, Cd, Sn) Типи реакцій. 1. Некаталітичні реакції. Такі реакції мають місце коли деяка поверхня занурена у відновлюючий розчин. Наприклад нітрат срібла з формальдегідом. Цей метод використовують для створення срібних дзеркал. Забезпечує значну товщину 2. Каталітичні реакції. Це реакції в яких матеріал поверхні заготовки служить каталізатором реакції. Існує обмежена кількість металів на які можна нанести інший метал. Наприклад відновлення хлористого нікелю, гіпофосфату натрію можна здійснити на поверхні заліза, алюмінію, кобальту. 3. Каталітичні реакції у присутності активаторів. Оскільки існує обмежена кількість металів на які можна осаджувати металеве покриття, то необхідно спочатку активізувати поверхні металів які не являються каталізаторами. Наприклад хлористий паладій часто використовують при осадженні на мідь і нікель. 4. Каталітичні реакції у присутності активаторів і сенсибілізаторів. Цей метод використовується при осадженні на неметалеві поверхні, які перед активацією необхідно зробити чутливими до осаджуваного металу. Наприклад при осадженні нікелю треба полити поверхню 0,1 хлориду, а після промити водою.
Переваги і недоліки методу. Переваги: 1. Можливість осадження металів на діелектрики (кераміка, скло, пластмаса). 2. Металізацію можна здійснити локально на любих ділянках поверхні, в тому числі і в порожнинах (куди підвід струму утруднений). 3. Можна нанести металеві шари значної товщини з високою міцністю щеплення. 4. Можна нанести покриття однакової товщини на складно профільовані поверхні. 5. Осаджені шари володіють рядом покращених характеристик, які не можуть бути отриманими методом електроосадження. Недоліки: 1. Відносно дорогі і складні за компонентами реактиви. 2. Зниження швидкості осадження по мірі експлуатації розчину. 3. Необхідність частої заміни розчинів для металізації. 4. Високі температури проведення процесу. 5. Високі затрати на нейтралізацію і регенерацію відпрацьованих розчинів. 6. Процес вимагає суворого регулювання параметрів, температури, кислотності, часу промивки і витримки. 7. Розчини не достатньо стабільні в роботі.
Підготовка поверхонь. 1. Створення певної шорсткості поверхні механічним шляхом (піскоструйна, галтовка, шліфування, полірування, кранцювання), хімобробкою органічним розчинником чи нанесенням адгезійного шару. 2. Обезжирення в органічному розчиннику
3. Травлення. Як правило воно здійснюється у водних розчина кислот, можливі добавки окислювачів.
Області застосування. Нікель (Ni) − для підвищення стійкості до зношування, захисту від корозії, для заміни хрому при виготовленні інструментів. Примітка: після нанесення необхідна термообробка. Кобальт (Co) − іде в сполуках Co+P; Co+B володіють високими електромагнітними властивостями. Можуть використовуватись в елементах пам'яті магнітних носіїв інформації. Купрум (Cu) – металізація діелектриків (як із декоративною ціллю, так і в системах багатошарових покриттів, захист від електромагнітного випромінювання). Цинк (Zn) – підшар при осадженні гальванічних покриттів на легкі метали і сплави. Кадмій (Cd) – для дрібних деталей особливо складної конфігурації. Oлово (Sn) – використовується для пайки з безкислотним флюсом.
Самостійна робота НЕ 1.3 Області застосування (Ni-P, Ni-B, Co-P). Умови формування шарів, їх структура і властивості. Області застосування (Ag, Au, Pt) Умови формування шарів, їх структура і властивості. [11–С.201-227, 12]
Рекомендована література для НЕ 1.3: [11–С.201-227, 12].
Питання для поточного самоконтролю та контролю знань по НЕ 1.3: 1. Назвіть типи реакцій при хімічному нанесенні металевих покриттів. 2. Назвіть переваги і недоліки методу хімічного нанесення металевих покриттів. 3. Опишіть процес підготовки поверхонь до хімічного нанесення металевих покриттів. 4. Перелічіть області застосування хімічно нанесених металевих покриттів (Ni, Cu, Co, Zn, Cd, Sn)
Тестові завдання до НЕ 1.3. Тест 1. Перелічіть всі типи реакцій при хімічному нанесенні металевих покриттів. 1. Некаталітичні, каталітичні, каталітичні реакції у присутності активаторів, каталітичні реакції у присутності активаторів і сенсибілізаторів. 2. Некаталітичні, каталітичні, каталітичні реакції у присутності десенсибілізаторів, каталітичні реакції у присутності активаторів і сенсибілізаторів. 3. Каталітичні, каталітичні реакції у присутності активаторів, каталітичні реакції у присутності активаторів і сенсибілізаторів, каталітичні реакції у присутності активаторів і оптимізаторів. 4. Некаталітичні, каталітичні, каталітичні реакції у присутності активаторів, квазікаталітичні реакції у присутності активаторів і сенсибілізаторів.
Тест 2. Як називаються реакції при хімічному нанесенні металевих покриттів, коли деяка поверхня занурена у відновлюючий розчин? 1. Некаталітичні реакції. 2. Каталітичні реакції. 3. Каталітичні реакції у присутності активаторів. 4. Каталітичні реакції у присутності активаторів і сенсибілізаторів.
Тест 3. Як називаються реакції при хімічному нанесенні металевих покриттів, в яких матеріал поверхні заготовки служить каталізатором реакції.? 1. Некаталітичні реакції. 2. Каталітичні реакції. 3. Каталітичні реакції у присутності активаторів. 4. Каталітичні реакції у присутності активаторів і сенсибілізаторів.
Тест 4. Як називаються реакції при хімічному нанесенні металевих покриттів на поверхні металів, які не являються каталізаторами? 1. Некаталітичні реакції. 2. Каталітичні реакції. 3. Каталітичні реакції у присутності активаторів. 4. Каталітичні реакції у присутності активаторів і сенсибілізаторів. Тест 5. Як називаються реакції при хімічному нанесенні металевих покриттів на поверхні неметалів? 1. Некаталітичні реакції. 2. Каталітичні реакції. 3. Каталітичні реакції у присутності активаторів. 4. Каталітичні реакції у присутності активаторів і сенсибілізаторів.
Тест 6. Чи можна проводити металізацію хімічним методом в порожнинах (куди підвід струму утруднений)? 1. Так. 2. Ні. Тест 7. Чи можна проводити металізацію хімічним методом поверхонь кераміки, скла, пластмаси? 1. Так. 2. Ні. Тест 8. Чи можна хімічним методом нанести металеві шари значної товщини з високою міцністю щеплення? 1. Так. 2. Ні.
Тест 9. Чи можна хімічним методом нанести покриття однакової товщини на складно профільовані поверхні? 1. Так. 2. Ні.
Тест 10. Як змінюється швидкість осадження металу хімічним методом по мірі експлуатації розчину. 1. Знижується. 2. Підвищується.
Тест 11. Назвіть послідовність виконання операцій при хімічному осадженні металів. 1. Створення певної шорсткості поверхні механічним шляхом; обезжирення в органічному розчиннику; травлення; осадження металів. 2. Травлення; створення певної шорсткості поверхні механічним шляхом; обезжирення в органічному розчиннику; осадження металів. 3. Створення певної шорсткості поверхні механічним шляхом; травлення; обезжирення в органічному розчиннику; осадження металів. 4. Обезжирення в органічному розчиннику; створення певної шорсткості поверхні механічним шляхом; травлення; осадження металів. 5. Травлення; створення певної шорсткості поверхні механічним шляхом; осадження металіво; безжирення в органічному розчиннику.
Тест 12. Чи використовується кранцювання при хімічному осадженні металів. 1. Так. 2. Ні.
Тест 13. Чи використовується шліфування при хімічному осадженні металів. 1. Так. 2. Ні.
Тест 14. Чи використовується полірування при хімічному осадженні металів. 1. Так. 2. Ні.
Тест 15. Чи використовується галтовка при хімічному осадженні металів. 1. Так. 2. Ні.
Тест 16. Чи наноситься адгезійний шар при хімічному осадженні металів. 1. Так. 2. Ні.
Тест 17. По якому основному критерію підбирають розчинник при підготовці поверхні перед хімічним осадженням металів? 1. Розчинна здатність. 2. Температура експлуатації. 3. Ступінь токсичності. 4. Текучість. 5. Органічний чи не органічний.
Тест 18. В яких одиницях вимірюється розчинна здатність розчинників? 1. кг/м2·год. 2. кг/м2. 3. Н/м2 4. Па/м2 5. Дж·кг/м2
Тест 19. В чому переважно здійснюється травлення при підготовці поверхні перед хімічним осадженням металів? 1. У водних розчинах кислот. 2. У водних розчинах лугів. 3. У водних розчинах кислот і лугів. 4. У водних розчинах лугів і окислювачів. 5. У водних розчинах кислот і окислювачів.
Тест 20. Хімічно осаджений Ni використовується для: 1. Підвищення стійкості до зношування. 2. Захисту від корозії. 3. Заміни хрому при виготовленні інструментів. 4. Покращення електропровідності. 5. Зменшення тертя.
Тест 21. Хімічно осаджена Cu використовується для: 1. Металізації діелектриків. 2. Захисту від електромагнітного випромінювання. 3. Захисту від корозії. 4. Підвищення стійкості до зношування. 5. Зменшення тертя.
Навчальний елемент 1.4. Лекція 4. Тема 4. "Електроліз". 1. Процеси, протікаючі при електролізі води. 2. Приклади застосування електролізу. 3. Електроліз водних розчинів і розплавлених сполук. Електроліз в хімії. 4. Електроосмос і електрофорез. 5. Хемотроніка.
Приклади застосування. 1. Для отримання водню. (енергетично невигідний процес). 2. Для отримання важкої води D2O. 3. Обезсолення води. 4. Сріблення і міднення води. 1мг – Аg+ 10мг – Сu2+ Хімотроніка. Хімотроніка – область застосування електрохімічних реакцій для створення хімічних перетворювачів інформації. – електрохімічний інтегратор; – лічильник часу (товстостінний капіляр заповнений розірваним стовпчиком ртуті); – ел.хім. модулятор світлового потоку.
Самостійна робота НЕ 1.4. 1. Отримання водню і кисню шляхом електролізу води. 2. Електролітичне виробництво хлору. 3. Електролітичне виробництво лугів. 4. Отримання важкої води. [14–С.8-314]. Рекомендована література: [13–С.325-344, 14–С.8-314].
Питання для поточного самоконтролю та контролю знань по НЕ 1.4: 1. Опишіть процеси, протікаючі при електролізі води. 2. Наведіть приклади застосування електролізу. 3. Наведіть приклади астосування електролізу водних розчинів і розплавлених сполук. Електроліз в хімії. 4. Опишіть процес електроосмосу і електрофорезу. 5. Що таке хемотроніка.
Тестові завдання до НЕ 1.4. Тест 1. Електроліз це: 1. сукупність процесів які відбуваються при проходженні постійного електричного струму через електрохімічну комірку. 2. сукупність процесів які відбуваються при проходженні змінного електричного струму через електрохімічну комірку. 3. сукупність процесів які відбуваються при проходженні постійного електричного струму через водний розчин кислоти. 4. сукупність процесів які відбуваються при проходженні постійного електричного струму через водний розчин лугу. 5. сукупність процесів які відбуваються при проходженні постійного електричного струму через водний розчин солі.
Тест 2. Електрохімічна комірка складається з: 1. двох і більше електродів і розплаву чи розчину електроліту. 2. кількох електродів і розплаву чи розчину електроліту. 3. двох електродів і розчину електроліту. 4. двох електродів і розплаву електроліту. 5. джерела живлення, двох електродів і розплаву чи розчину електроліту.
Тест 3. Які гази виділяються в процесі електролізу на катоді (+)? 1. H2. 2. O2. 3. N2. 4. CO2. 5. H2 і O2.
Тест 4. Які гази виділяються в процесі електролізу на аноді (-)? 1. H2. 2. O2. 3. N2. 4. CO2. 5. H2 і O2.
Тест 5. Чи механізм процесу електролізу розрізняється для кислих і лужних розчинів. 1. Так. 2. Ні.
Тест 6. Якарізниця потенціалів необхідна для встановлення процесу електролізу води? 1. Eтеор = 1,23B 2. Еексп= 1,7B 3. Еексп= 1,27B 4. Еексп= 1,73B 5. Eтеор = 1,323B
Тест 7. Чи можна застосовувати процес електролізу для отримання водню? 1. Так. 2. Ні. Тест 8. Чи можна застосовувати процес електролізу для отримання важкої води D2O. 1. Так. 2. Ні. Тест 9. Чи можна застосовувати процес електролізу для обезсолення води. 1. Так. 2. Ні. Тест 10. Чи можна застосовувати процес електролізу для сріблення і міднення води. 1. Так. 2. Ні. Тест 11. Чи можна застосовувати процес електролізу для виробництва хлору. 1. Так. 2. Ні. Тест 12. Чи можна застосовувати процес електролізу для виробництво хлорного вапна (хлорки). 1. Так. 2. Ні. Тест 10. Чи можна застосовувати процес електролізу для виробництва хлоратів калію і натрію КСlO2 (бертолетова сіль) 1. Так. 2. Ні. Тест 10. Чи можна застосовувати процес електролізу для виробництва хлористого воденю (соляна кислота) HCl 1. Так. 2. Ні. Тест 10. Чи можна застосовувати процес електролізу для виробництва чотирьоххлористого вуглецю CCl4 (негорючий розчинник) та дихлоретиленгліколю. 1. Так. 2. Ні. Тест 10. Чи можна застосовувати процес електролізу водних розчинів для отримання металів (електроекстракції) і їх очистки (електрорафінування). 1. Так. 2. Ні.
Тест 11. Електроосмос це: 1. рух рідини в постійному електричному полі відносно нерухомої перегородки, що несе заряд. 2. рух рідини в постійному електричному полі відносно нерухомої перегородки, що не несе заряд. 3. рух рідини в змінному електричному полі відносно нерухомої перегородки, що несе заряд. 4. рух рідини в змінному електричному полі відносно нерухомої перегородки, що не несе заряд.
Тест 12. Електрофорез це: 1. рух заряджених частинок під дією зовнішнього електричного поля. 2. рух заряджених частинок під дією внутрішнього електричного поля. 3. коловий рух заряджених частинок під дією зовнішнього електричного поля. 4. поступально-зворотній рух заряджених частинок під дією зовнішнього електричного поля.
Тест 12. Хімотроніка це: 1. область застосування електрохімічних реакцій для створення хімічних перетворювачів інформації 2. область застосування електрохімічних реакцій при приходженні електричного струму. 3. область застосування енаправлених реакцій для створення хімічних перетворювачів інформації. 4. область застосування електрохімічних реакцій для створення механічних перетворювачів інформації.
Навчальний елемент 1.5. Лекція 5. Тема 5. "Електрохімічна розмірна обробка металів". 1. Сутність процесу (механізм процесу) загальні закономірності. 2. Розрахункові залежності. 3. Класифікація методів. 4. Особливості (переваги і недоліки) електрохімічної розмірної обробки металів. Навчальний елемент 1.5. Розрахункові залежності. Закон Ома I = Густина струму: j = R = ρ R = електричний опір ρ = питома електропровідність Закон Фарадея: m =kq = k Вихід по масі: η =
5.3. Класифікація методів електрохімічної обробки: А) Травлення: 1. Анодне (для очистки поверхні, видалення припуску). 2. Катодне (очистка і обезжирювання). 3. Реверсивне. Б) Обробка поверхні: 1. Безрозмірне шліфування. 2. Глянцування. 3. Полірування (як декоративне, так і технічне). В) Розмірна обробка: 1. В спокійному електроліті (профілювання, заточування, розмірна обробка), 2. В проточному електроліті (профілювання, різання).
5.4. Особливості (Переваги і недоліки розмірної обробки металів). Переваги: 1. Чистота обробки в межах 7-9кл. 2. Відсутність зношування електрод-інструментів. 3. Простота здійснення процесу. Недоліки: 1. Необхідність очистки електроліту (центрифугування чи відстоювання у баках). 2. Необхідність видалення водню (1кг заліза ≈ 0,5м3 водню). 3. Відносно велика електроємність процесу.(1000А·год ≈ 1кг знятого металу).
Лекція 6. Типові електроліти. 1. Для залізних сплавів: NaCl, NaNO3, KNO3 2. Для нікелевих і титанових сплавів, H2SO4 3. Для алюмінієвих сплавів: NaNO3 + NaCl. 4. Металокераміка: NaCl+NaOH 5. Неіржавіюча сталь: Na2SO4
Рекомендована література до НЕ1.5: [1–С.16-55, 2 – С.14-184, 3 – С.69-145, 5–С59-113, 15, 16–С.193-205]
Питання для поточного самоконтролю та контролю знань по НЕ 1.5: 1. Опишіть сутність процесу (механізм процесу) електрохімічної розмірної обробки металів. 2. Наведіть розрахункові залежності, які використовуються при плануванні процесу електрохімічної розмірної обробки. 3. Зробіть класифікацію методів електрохімічної обробки. 4. перелічіть всі особливості (переваги і недоліки) електрохімічної розмірної обробки металів. 5. Наведіть приклади операцій, що виконуються електрохімічною розмірною обробкою. 6. Які електроліти найчастіше застосовують для типових конструкційних матеріалів.
Тестові завдання до НЕ 1.5.
Тест 1. На поверхні позитивного електроду (анода) при електрохімічній обробці утворюється... 1. гідрат окислу заліза Fe(OH)3 2. гідрат закису заліза Fe(OH)2 3. окис заліза Fe2O3
Тест 2. На катоді при електрохімічній обробці відбувається виділення... 1. водню 2. кисню 3. вуглекислого газу 4. закису азоту
Тест 3. Які з формул використовуються при розрах
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 250; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.108.174 (0.014 с.) |

 год
год



 It (1), k =
It (1), k = 
 (2)
(2)



