
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Переваривание и всасывание углеводов в пищеварительном тракте. Механизмы транспорта глюкозы через клеточные мембраны.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Расщепление крахмала (и гликогена) начинается в полости рта под действием амилазы слюны. Известны три вида амилаз, которые различаются главным образом по конечным продуктам их ферментативного действия: α-амилаза, β-амилаза и γ-амилаза. α-Амилаза расщепляет в полисахаридах внутренние α-1,4-свя-зи, поэтому ее иногда называют эндоамилазой. Под действием β-амилазы от крахмала отщепляется дисахарид мальтоза, т.е. β-амилаза является экзоамилазой. γ-Амилаза отщепляет один за другим глюкозные остатки от конца полигликозидной цепочки. Различают кислые и нейтральные γ-амилазы в зависимости от того, в какой области рН они проявляют максимальную активность. Затем пища, смешанная со слюной, попадает в желудок. Желудочный сок не содержит ферментов, расщепляющих сложные углеводы. В желудке действие α-амилазы слюны прекращается, так как желудочное содержимое имеет резко кислую реакцию (рН 1,5–2,5). Однако в более глубоких слоях пищевого комка, куда не сразу проникает желудочный сок, действие амилазы некоторое время продолжается и происходит расщепление полисахаридов с образованием декстринов и мальтозы. Наиболее важная фаза распада крахмала (и гликогена) протекает в двенадцатиперстной кишке под действием α-амилазы поджелудочного сока. Здесь рН возрастает приблизительно до нейтральных значений, при этих условиях α-амилаза панкреатического сока обладает почти максимальной активностью. Этот фермент завершает превращение крахмала и гликогена в мальтозу, начатое амилазой слюны. Расщепление крахмала и гликогена до мальтозы происходит в кишечнике под действием трех ферментов: панкреатической α-амилазы, амило-1,6-глюкозидазы и олиго-1,6-глюкозидазы. Судьба всосавшихся моносахаридов. Более 90% всосавшихся моносахаридов (главным образом глюкоза) через капилляры кишечных ворсинок попадает в кровеносную систему и с током крови через воротную вену доставляется прежде всего в печень. Остальное количество моносахаридов поступает по лимфатическим путям в венозную систему. В печени значительная часть всосавшейся глюкозы превращается в гликоген, который откладывается в печеночных клетках в форме своеобразных, видимых под микроскопом блестящих гранул. Механизм транспорта глюкозы. Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться разными способами: путём облегчённой диффузии и активного транспорта. В случае активного транспорта глюкоза и Na+ проходят через мембраны с люминальной стороны, связываясь с разными участками белка-переносчика. При этом Na+ поступает в клетку по градиенту концентрации, и одновременно глюкоза транспортируется против градиента концентрации (вторично-активный транспорт, см. раздел 5). Следовательно, чем больше градиент Na+, тем больше поступление глюкозы в энтероциты. Градиент концентрации Na+, являющийся движущей силой активного сим-порта, создаётся работой Nа+,К+-АТФ-азы. При разной концентрации глюкозы в просвете кишечника "работают" различные механизмы транспорта. Благодаря активному транспорту эпителиальные клетки кишечника могут поглощать глюкозу при её очень низкой концентрации в просвете кишечника. Если же концентрация глюкозы в просвете кишечника велика, то она может транспортироваться в клетку путём облегчённой диффузии. Глюкозные транспортёры (ГЛЮТ) обнаружены во всех тканях. Существует несколько разновидностей ГЛЮТ. Структура белков семейства ГЛЮТ отличается от белков, транспортирующих глюкозу через мембрану в кишечнике и почках против градиента концентрации. Описанные 5 типов ГЛЮТ имеют сходные первичную структуру и доменную организацию. - ГЛЮТ-1 обеспечивает стабильный поток глюкозы в мозг; - ГЛЮТ-2 обнаружен в клетках органов, выделяющих глюкозу в кровь. Именно при участии ГЛЮТ-2 глюкоза переходит в кровь из энтероцитов и печени. ГЛЮТ-2 участвует в транспорте глюкозы в β-клетки поджелудочной железы; - ГЛЮТ-3 обладает большим, чем ГЛЮТ-1, сродством к глюкозе. Он также обеспечивает постоянный приток глюкозы к клеткам нервной и других тканей; - ГЛЮТ-4 - главный переносчик глюкозы в клетки мышц и жировой ткани; - ГЛЮТ-5 встречается, главным образом, в клетках тонкого кишечника. Его функции известны недостаточно. Все типы ГЛЮТ могут находиться как в плазматической мембране, так и в цитозольных везикулах. ГЛЮТ-4 (и в меньшей мере ГЛЮТ-1) почти полностью находятся в цитоплазме клеток. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ, к плазматической мембране, слиянию с ней и встраиванию транспортёров в мембрану. После чего возможен облегчённый транспорт глюкозы в эти клетки. После снижения концентрации инсулина в крови транспортёры глюкозы снова перемещаются в цитоплазму, и поступление глюкозы в клетку прекращается 2. ПФЦ: химизм реакций до образования фосфопентоз, биологическая роль, нарушения.
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования. Первая реакция дегидрирования - превращение глюкозо-6-фосфата в глюконолактон-6-фосфат - катализируется NАDР+зависимой глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента NADPH. Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы. Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NADPH. Восстановленный NADPH ингибирует первый фермент окислительного этапа пентозофосфатного пути - глюкозо-6-фосфатдегидрогеназу. Превращение NADPH в окисленное состояние NADP+ приводит к ослаблению ингибирования фермента. При этом скорость соответствующей реакции возрастает, и образуется большее количество NADPH.
Синтез жирных кислот из углеводов в печени является основным путём утилизации NADPH и обеспечивает регенерацию окисленной формы NADP+. В печени глюкозо-6-фосфатдегидрогеназа, как и ключевые ферменты гликолиза и биосинтеза жирных кислот, индуцируется при увеличении соотношения инсулин/глюкагон после приёма богатой углеводами пищи. Несмотря на то, что NADPH образуется также при окислении малата до пирувата и диоксида углерода (при участии НАDР+-зависимой малатдегидрогеназы) и дегидрировании изоцитрата (при участии НАВР+-зависимой изоцитратдегидрогеназы), в большинстве случаев потребности клеток в восстановительных эквивалентах удовлетворяются за счёт пентозофосфатного пути. Реакции окислительного пути протекают только в том случае, если восстановленный ко-фермент NADPH возвращается в исходное окисленное состояние NADP+ при участии NADPH-зависимых дегидрогеназ (т.е. при условии использования гидрированного NADPH в восстановительных процессах). Если потребности клетки в NADPH незначительны, рибо-зо-5-фосфат образуется в результате обратимых реакций неокислительного этапа пентозофосфатного пути, используя в качестве исходных веществ метаболиты гликолиза - глицеральдегид-3-фосфат и фруктозо-6-фосфат. 3. Гликонеогенез: определение понятия, биологическая роль, исходные субстраты, химизм обходных реакций, регуляция. Гликонеогенез – синтез углеводов (глюкозы) из неуглеводных компонентов: 1. Аминокислоты; 2. Глицерол; 3. Молочная кислота. Биологическая роль: При голодании в организме человека активно используются запасы питательных веществ (гликоген, жирные кислоты). Они расщепляются до аминокислот, кетокислот и других неуглеводных соединений. Большая часть этих соединений не выводится из организма, а подвергаются реутилизации. Вещества транспортируются кровью в печень из других тканей, и используются в глюконеогенезе для синтеза глюкозы — основного источника энергии в организме. Таким образом при истощении запасов организма, глюконеогенез является основным поставщиком энергетических субстратов.
Установлено, что в процессе образования фосфоенолпирувата участвуют ферменты цитозоля и митохондрий.
Превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат. Фосфоенолпируват, образовавшийся из пирувата, в результате ряда обратимых реакций гликолиза превращается во фруктозо-1,6-бисфосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идет в обход этой эндергонической реакции. Превращение фруктозо-1,6-бис-фосфата во фруктозо-6-фосфат катализируется специфической фруктозо -1,6- бифосфотазой. Образование глюкозы из глюкозо-6-фосфата. В последующей обратимой стадии биосинтеза глюкозы фруктозо-6-фосфат превращается в глюкозо-6-фосфат. Последний может дефосфорилироваться (т.е. реакция идет в обход гексокиназной реакции) под влиянием фермента глюкозо-6-фосфатазы. Регуляция глюконеогенеза. Важным моментом в регуляции глюконеогенеза является реакция, катализируемая пируваткарбоксилазой. Роль положительного аллостерического модулятора этого фермента выполняет ацетил-КоА. В отсутствие ацетил-КоА фермент почти полностью лишен активности. Когда в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается. Известно, что ацетил-КоА одновременно является отрицательным модулятором пируватдегидрогеназного комплекса. Следовательно, накопление ацетил-КоА замедляет окислительное декарбоксилирование пирувата, что также способствует превращению последнего в глюкозу. Другой важный момент в регуляции глюконеогенеза – реакция, катализируемая фруктозо-1,6-бисфосфатазой – ферментом, который ингибируется АМФ. Противоположное действие АМФ оказывает на фосфофруктокиназу, т. е. для этого фермента он является аллостерическим активатором. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина отношения АТФ/АМФ мала, в клетке наблюдается расщепление глюкозы. Билет №17
|
||||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 1684; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.73.149 (0.012 с.) |

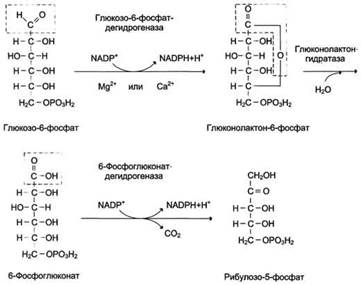 ПЕНТОЗОФОСФАТНЫЙ ЦИКЛ (пентозный путь, гексо-зомонофосфатный шунт, фосфоглюконатный путь), совокупность обратимых ферментативных реакций, в результате которых происходит окисление глюкозы до CO2 с образованием восстановленного никотинамидадениндинуклеотид-фосфата (НАДФН) и H +, а также синтез фосфорилир.
ПЕНТОЗОФОСФАТНЫЙ ЦИКЛ (пентозный путь, гексо-зомонофосфатный шунт, фосфоглюконатный путь), совокупность обратимых ферментативных реакций, в результате которых происходит окисление глюкозы до CO2 с образованием восстановленного никотинамидадениндинуклеотид-фосфата (НАДФН) и H +, а также синтез фосфорилир.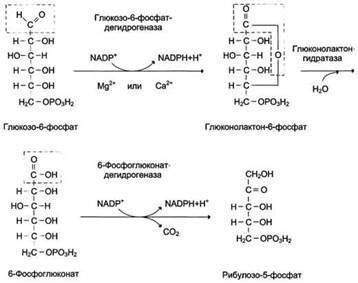 Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм кислорода.
Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм кислорода. Образование фосфоенолпирувата из пирувата. Первоначально пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата.
Образование фосфоенолпирувата из пирувата. Первоначально пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата.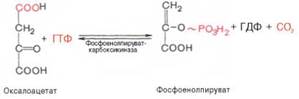 Затем оксалоацетат в результате декарбоксилирования и фосфорили-рования под влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ).
Затем оксалоацетат в результате декарбоксилирования и фосфорили-рования под влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ). Первый этап синтеза протекает в митохондриях. Так как оксалоацетат не может выйти в цитозоль для превращения в ФЕП, то он сначало превращается в малат под действием фермента митохондриальной малатдегидрогеназы. Малат выходит в цитозоль и обратно превращается в оксалоацетат под действием цитозольной малатдегидрогеназы. Оксалоацетат превращается в ФЕП.
Первый этап синтеза протекает в митохондриях. Так как оксалоацетат не может выйти в цитозоль для превращения в ФЕП, то он сначало превращается в малат под действием фермента митохондриальной малатдегидрогеназы. Малат выходит в цитозоль и обратно превращается в оксалоацетат под действием цитозольной малатдегидрогеназы. Оксалоацетат превращается в ФЕП.


