
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Осн положен теор ферм кинетики и общ теор действ фер-таСодержание книги
Поиск на нашем сайте
Предварительные эксперименты по изучению кинетики ферментативных реакций показали, что скорость реакции E + S ---> E + P, вопреки теоретическим ожиданиям, не зависит от концентрации фермента и субстрата так, как в случае обычной реакции второго порядка. Самая ранняя попытка математически описать ферментативные реакции была предпринята Дюкло в 1898 г. Браун (1902) и независимо от него Анри (1903) впервые выдвинули гипотезу об образовании в ходе реакции фермент-субстратного комплекса. Это предположение основывалось на трех экспериментальных фактах: 1. папаин образовывал нерастворимое соединение с фибрином 2. субстрат инвертазы - сахароза могла защищать фермент от тепловой денатурации 3. было показано, что ферменты являются стереохимически специфическими катализаторами Х-КА ДЕЙСТВИЯ ФЕРМ: 1. специфичность действия-способность ускорять протекание 1 или нескольких реакций (амилазная реакция расщепляет крахмал до глюкозы) а. абсолютная- определенный субстрат; б. относительная- ферменты, которые катализируют ращепление определенного типа связи. (пепсин) 2. ускорение протекания ферментативн. Реакций- каталитичность. Ферменты действуют в мыгких условиях (норм давление, pH, температура): гидролиз крахмала Амилаза = 37 градусов, pH7, скорость выше, чем при неорган.катализе. 2. регулируемость – есть факторы под воздействием которых скорость может увеличится или уменшаться
В 1913 году Михаэлис и Ментен опубликовали свою теорию общего механизма ферментативных реакций. Их уравнение стало фундаментальным принципом всех кинетических исследований ферментов вот уже почти целый век.
т.е. фермент Е вступает во взаимодействие с субстратом S с образованием промежуточного комплекса ES, который далее распадается на свободный фермент и продукт реакции Р. Математическая обработка на основе закона действующих масс дала возможность вывести уравнение, названное в честь авторов уравнением Михаэлиса–Ментен, выражающее количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции:
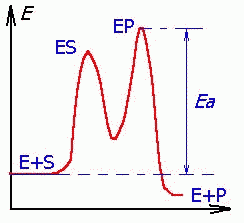
где v – наблюдаемая скорость реакции при данной концентрации субстрата [S]; KS– константа диссоциации фермент-субстратного комплекса, моль/л; Vmax– максимальная скорость реакции при полном насыщении фермента субстратом. Основной механизм действия ферментов-они снижают Е активации за счет образования фермент-субстрат копмлекса. Катализ приводит к ускорению достижения равновесия за счет снижения энергии активации (Еа), часто ступенчато.
ВЫВОД И АНАЛИЗ УР МИХАЭЛИСА-МЕНТЕН Михаэлис и Ментен предположили, что мех-м ферм р-й описывается моделью:
При формулировке кинетического выражения для скорости ферментативной реакции Михаэлис и Ментен сделали три допущения: 1) Стационарное состояние реакции в момент равновесия, когда скорости образования и расходования ES равны; 2) Весь фермент в условиях насыщающих концентраций субстрата превращается в энзимсубстратный комплекс ES; 3) Если весь фермент в виде ES, то скорость реакции максимальна и Vmax=k2[ES]. Образование ES: [ES]=k1[S][E] (I) Расходование ES: [ES]=k-1[ES]+k2[ES] (II) Приравнивая выражения (I) и (II) и сокращая обе части на k1 получаем: [S][E] = [ES](k-1 + k2)/k1 = [ES]Km, где Km = (k-1 + k2)/k1 Выразим равновесную концентрацию [E] через начальную [Eo]: [E] = [Eo] - [ES] [S]([Eo]-[ES])= [ES]Km, переносим [S] в правую часть выражения и делим обе части на [ES]: [Eo]/[ES]=Km/[S]+1= (Km+[S])/[S] (III) Поскольку трудно (если не невозможно) измерить [ES], произведем замену с учетом того, что в насыщающих концентрациях [S] весь [Eo] перейдет в [ES] и максимальная скорость при этом будет равна Vmax=k2[ES]=k2[Eo]. В это же время скорость реакции равна V=k2[ES]. Через отношение этих скоростей выразим [Eo]/[ES]: V/Vmax= [ES]/[Eo] В уравнении (III) произведем замену отношения [Eo]/[ES] на Vmax/V и получаем: V = Vmax[S]/(Km+[S]) Это и есть уравнение Михаэлиса-Ментен.
|
||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 394; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.156.91 (0.006 с.) |



 (2.1)
(2.1)


