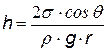Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос 1.Радиус-вектор.Вектор перемещения.Содержание книги Поиск на нашем сайте Вопрос 1.Радиус-вектор.Вектор перемещения.
,где Вопрос 2.Скорость перемещения. Средняя и мгновенная скорости. Скорость перемещения (вектор)-показывает, как изменяется перемещение в единицу времени.
Мгновенная скорость всегда направлена по касательной к траектории, а средняя – совпадает с вектором перемещения.
S – путь – это длина траектории (скалярная величина, > 0). S-площадь фигуры, ограниченной кривой v(t) и прямыми t1 и t2.
Вопрос 4.Ускорение.Модуль ускорения. Ускорение -по смыслу – показывает, как изменяется скорость в единицу времени.
Вопрос 5.Неравномерное движение точки по криволинейной траектории.
, где r - радиус кривизны. У точки, движущейся по криволинейной траектории, всегда есть нормальное ускорение, а тангенциальное – только тогда, когда скорость изменяется по величине. (2, 3)Тема 2. КИНЕМАТИЧНСКИЕ УРАВНЕНИЯ ДВИЖЕНИЯ. Вопрос 1.Получить кинематические уравнения движения r(t) и v(t). Два дифференциальных и связанных с ними двух интегральных векторных уравнениях:
→ Вопрос 2. Получить кинематические уравнения движения x(t),y(t),vx(t) и vy(t), для брошенного тела.
Вопрос 3. Получить кинемат. уравнения движения x(t),y(t),vx(t) и vy(t), для тела, брошенного под углом.
Вопрос 4. Получить уравнение движения для тела, брошенного под углом.
Тема 3. КИНЕМАТИКА ВРАЩЕНИЯ. Вопрос 1.Кинематические характеристики вращательного движения.
угловая скорость угловое ускорение Вопрос 2. Связь между линейными и угловыми характеристиками движения точки
Вопрос 3.Получите кинематическое уравнения w (t) и ф (t).
(4, 5, 6) Тема 4. КИНЕМАТИКА АТТ. Вопрос 1.Определение АТТ. Поступательные и вращательные движения АТТ. АТТ называется тело, деформациями которого можно пренебречь в условиях данной задачи. Все движения АТТ можно разложить на поступательное и вращательное, относительно некоторой мгновенной оси. Поступательное движение – это движение, при котором прямая, проведенная через любые две точки тела, перемещается параллельно самой себе. При поступательном движении все точки тела совершают одинаковые перемещения. Вращательное движение – это движение, при котором все точки тела движутся по окружностям, центры которых лежат на одной и той же прямой, называемой осью вращения. В качестве кинематического уравнения вращательного движения АТТ достаточно знать уравнение j (t) для угла поворота радиус-вектора, проведенного от оси вращения к какой-либо точке тела (если ось неподвижна). Т.е., принципиально кинематические уравнения движения для точки и АТТ не отличаются. Тема 5. ЗАКОНЫ НЬЮТОНА. Тема 6. ЗАКОН СОХРАНЕНИЯ ИМПУЛЬСА. Тема 7. РАБОТА. МОЩНОСТЬ. ЭНЕРГИЯ. Вопрос 7. Законы сохранения применительно к абсолютно упругому удару двух шаров. Абсолютно упругий удар – это такой удар, при котором сохраняется кинетическая энергия всей системы.
Тема 10. СИЛОВЫЕ ПОЛЯ Вопрос 3. Сокращение длины. l0 – длина стержня в системе, относительно которой он покоится (в нашем случае в К), l – длина этого отрезка в системе, относительно которой он движется (К¢). Таким образом, из СТО следует, что размеры движущихся тел должны сокращаться в направлении их движения, но реального сокращения нет, т.к. все ИСО равноправны. Вопрос 2.Идеальный газ Простейшей моделью реальных газов является идеальный газ. С м а кро скопической точки зрения – это газ, для которого выполняются газовые законы (pV = const, p/T = const, V/T = const). С м и кро скопической точки зрения – это газ, для которого можно пренебречь: 1) взаимодействием молекул между собой и 2) собственным объемом молекул газа по сравнению с объемом сосуда, в котором находится газ. Уравнение, связывающее между собой параметры состояния, называется уравнением состояния газа. Одно из простейших уравнений состояния - это
Тема 15. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ Вопрос 1. Основные понятия. Обратимые и необратимые процессы.
Величины, которые зависят только от состояния системы и не зависят от процессов, посредством которых система пришла в данное состояние, называются функциями состояния. Величины, значения которых в данном состоянии зависят от предшествующих процессов, называются функциями процессов - это теплота Q и работа A,их изменение обозначают часто как dQ, dA или Работа и теплота – это две формы передачи энергии от одних тел к другим. При совершении работы меняется относительное расположение тел или частей тела. Передача энергии в виде теплоты осуществляется при контакте тел – за счет теплового движения молекул. К внутренней энергии относят: 1)кинетическую энергию теплового движения молекул (но не кинетическую энергию всей системы в целом), 2)потенциальную энергию взаимодействия молекул между собой, 3)кинетическую и потенциальную энергию колебательного движения атомов в молекуле, 4)энергию связи электронов с ядром в атоме, 5)энергию взаимодействия протонов и нейтронов внутри ядра атома. Эти энергии по величине очень сильно отличаются друг от друга, например, энергия теплового движения молекул при 300 К ~ 0,04 эВ, энергия связи электрона в атоме ~ 20-50 эВ, а энергия взаимодействия нуклонов в ядре ~10 МэВ. Поэтому эти взаимодействия рассматривают по отдельности. Внутренняя энергия идеального газа – это кинетическая энергия теплового движения его молекул. Она зависит только от температуры газа. Ее изменение имеет одинаковое выражение для любых процессов в идеальных газах и зависит только от начальной и конечной температур газа. Тема 16. Вопрос 1. Энтропия II начало термодинамики, как и I начало, является обобщением большого числа опытных фактов и имеет несколько формулировок. Введем сначала понятие «энтропия», которое играет ключевую роль в термодинамике. Э нтропия - S – одна из важнейших термодинамических функций, характеризующая состояние или возможные изменения состояния вещества – это многогранное понятие.
Энтропия определяется следующим образом.
Для обратимых процессов в идеальных газах можно получить формулы для вычисления энтропии в различных процессах. Выразим dQ из I начала и подставим в выражение для dS.
общее выражение для изменения энтропии в обратимых процессах.
Интегрируя, получим выражения для изменения энтропии в различных изопроцессах в идеальных газах. Вопрос 2,3,4.изобарический, изохорический, изотермический
Во всех расчетах энтропии имеет значение только разность энтропий конечного и начального состояний системы
2) Энтропия мера рассеяния энергии.
3) Энтропия – мера беспорядка системы Введем понятие термодинамической вероятности.Пусть мы имеет ящик, разделенный на n отсеков. В ящике по всем отсекам свободно перемещается N молекул. В первом отсеке окажется N1 молекул, во втором отсеке N2 молекул,…, в n -ом отсеке - Nn молекул. Число способов w, которыми можно распределить N молекул по n состояниям (отсекам) называется термодинамической вероятностью. Иначе говоря, термодинамическая вероятность показывает, сколькими микро распределениями можно получить данное макро распределение Она вычисляется по формуле: [1]
Для примера вычисления w рассмотрим систему, состоящую из трех молекул 1, 2 и 3, которые свободно перемещаются в ящике с тремя отсеками. [2] В данном примере N = 3 (три молекулы) и n = 3 (три отсека), молекулы считаются различимыми. В первом случае макрораспределение – это равномерное распределение молекул по отсекам, оно может осуществиться 6-ью микрораспределениями. Вероятность такого распределение самая большая. Равномерное распределение можно назвать «беспорядком» (по аналогии с разбросанными вещами в комнате) В последнем случае, когда молекулы собираются только в одном отсеке вероятность наименьшая. Проще говоря, из повседневных наблюдений мы знаем, что молекулы воздуха более или менее равномерно распределяются в помещении, и практически совершенно невероятно, чтобы все молекулы собрались в одном углу комнаты. Однако теоретически такая вероятность существует. Больцман постулировал, что энтропия прямо пропорциональна натуральному логарифму термодинамической вероятности:
Следовательно, энтропию можно назвать мерой беспорядка системы.
Вопрос 6.Теперь мы можем сформулировать II начало термодинамики.
Вопрос 7. КРУГОВЫЕ ПРОЦЕССЫ (ЦИКЛЫ) Круговым процессом или циклом называется такой процесс, при котором система, пройдя ряд состояний, возвращается в исходное состояние. Если процесс осуществляется по часовой стрелке, он называется прямым, против часовой стрелки – обратным. Т.к. внутренняя энергия является функцией состояния, то в круговом процессе
Рассмотрим цикл Карно для идеальной тепловой машины. Предполагается, что рабочее тело – идеальный газ, трение отсутствует. Этот цикл, состоящий из двух изотерм и двух адиабат, реально не осуществим, но он сыграл огромную роль в развитии термодинамики и теплотехники и позволил проанализировать коэффициент полезного действия (КПД) тепловых машин.
Таким образом, за цикл газу было сообщено Q1 теплоты, холодильнику передано Q2 теплоты и получена работа А.
Из полученного выражения следует, что: 1) КПД всегда меньше единицы, 2)КПД не зависит от рода рабочего тела, а только от температуры нагревателя и холодильника, 3)чтобы повысить КПД нужно увеличить температуру нагревателя и уменьшить температуру холодильника. В современных двигателях в качестве нагревателя используются горючие смеси - бензин, керосин, дизельное топливо и др., имеющие определенные температуры горения. Холодильником служит чаще всего окружающая среда. Следовательно, реально увеличить КПД можно только за счет уменьшения трения в различных узлах двигателя и машины.
Тема 18.Вопрос 1.АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА
Кроме потенциальной, молекула обладает еще и кинетической энергией. Минимальная потенциальная энергия у каждого сорта молекул своя, а кинетическая энергия зависит от температуры вещества (Екин ~ кТ). В зависимости от соотношения между этими энергиями данное вещество может находиться в том или ином агрегатном состоянии. Например, вода может быть в твердом состоянии (лед), в жидком и в виде пара.
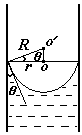
У инертных газов Umin невелики, поэтому они переходят в жидкое состояние при очень низких температурах. У металлов большие величины Umin поэтому они находятся в твердом состоянии вплоть до температуры плавления – это могут быть сотни и тысячи градусов. Вопрос 3. Смачивание приводит к тому, что на стенках сосуда жидкость как бы «ползет» по стенке, и ее поверхность искривляется. В широком сосуде это искривление практически незаметно. В узких трубках – капиллярах – этот эффект можно наблюдать визуально. За счет сил поверхностного натяжения создается дополнительное (по сравнению с атмосферным) давление Dр, направленное к центру кривизны поверхности жидкости.
Дополнительное давление вблизи искривленной поверхности жидкости D р приводит к подъему (при смачивании) или опусканию (при несмачивании) жидкости в капиллярах. При равновесии дополнительное давление равно гидростатическому давлению столбика жидкости. Из формулы Лапласа для капилляра круглого сечения D p = 2s / R, гидростатическое давление р = r g h. Приравнивая Dр = р, найдем h.
Из формулы видно, что чем меньше радиус капилляра, тем выше подъем (или опускание) жидкости. Явление капиллярности чрезвычайно распространено в природе и технике. Например, проникновение влаги из почвы в растения осуществляется посредством подъема ее по капиллярным каналам. К капиллярным явлениям относится также такое явление, как движение влаги по стенам помещения, приводящее к сырости. Очень большую роль капиллярность играет при добыче нефти. Размеры пор в породе, содержащей нефть, чрезвычайно малы. Если добываемая нефть окажется несмачивающей по отношению к породе, то она закупорит канальца, и извлечь ее будет очень трудно. Добавляя к жидкости некоторые вещества даже в очень малом количестве, можно существенно изменить ее поверхностное натяжение. Такие вещества называются поверхностно-активными веществами. [1] N! =1×2×3××× N - факториал – это произведение целых чисел [2] Термодинамические законы не применимы к 3 молекулам. Пример взят для простоты вычислений. [3] Фаза – это совокупность частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом состоянии. Вопрос 1.Радиус-вектор.Вектор перемещения.
,где
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 3349; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.014 с.) |

 - радиус-вектор - это вектор, проведенный от точки отсчета О к рассматриваемой точке М.
- радиус-вектор - это вектор, проведенный от точки отсчета О к рассматриваемой точке М.

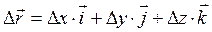
 - перемещение (или изменение радиус-вектора) – это вектор, соединяющий начало и конец траектории.
- перемещение (или изменение радиус-вектора) – это вектор, соединяющий начало и конец траектории.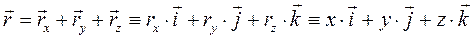
 радиус-вектор в прямоугольной системе декартовых координат:
радиус-вектор в прямоугольной системе декартовых координат: -называют координатами точки.
-называют координатами точки. Средняя:
Средняя: 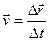 Мгновенная:
Мгновенная: 
 Проекция:
Проекция:  Модуль:
Модуль: 
 Вопрос 3.Путь.Его связь с модулем скорости.
Вопрос 3.Путь.Его связь с модулем скорости.
 Проекция:
Проекция:  Модуль:
Модуль:  Среднее значение:
Среднее значение: 
 Если точка движется по криволинейной траектории, то целесообразно разложить ускорение на составляющие, одна из которых направлена по касательной и называется тангенциальным или касательным ускорением, а другая направлена по нормали к касательной, т.е. по радиусу кривизны, к центру кривизны и называется нормальным ускорением.
Если точка движется по криволинейной траектории, то целесообразно разложить ускорение на составляющие, одна из которых направлена по касательной и называется тангенциальным или касательным ускорением, а другая направлена по нормали к касательной, т.е. по радиусу кривизны, к центру кривизны и называется нормальным ускорением. характеризует изменение скорости по направлению,
характеризует изменение скорости по направлению,  – по величине.
– по величине.







 и
и  - кинематические уравнения равнопеременного точки при
- кинематические уравнения равнопеременного точки при  .
.








 угловое перемещение
угловое перемещение  - угол поворота радиус-вектора.
- угол поворота радиус-вектора. - показывает, как изменяется угол поворота радиус-вектора.
- показывает, как изменяется угол поворота радиус-вектора. - показывает, как изменяется угловая скорость за единицу времени.
- показывает, как изменяется угловая скорость за единицу времени.






 - кин. уравнения равноускор.(+) и равнозамедл.(-) вращательного движения.
- кин. уравнения равноускор.(+) и равнозамедл.(-) вращательного движения.


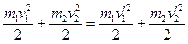




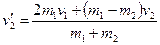

 т.к. и
т.к. и 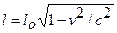 .
. (
( ;
;  ;
;  ) уравнение Менделеева – Клапейрона.
) уравнение Менделеева – Клапейрона. (n – концентрация, k – постоянная Больцмана) - уравнение состояния идеального газа в другой форме.
(n – концентрация, k – постоянная Больцмана) - уравнение состояния идеального газа в другой форме. Обратимый процесс -это такой процесс перехода системы из состояния А в состояние В, при котором возможен обратный переход от В к А через те же промежуточные состояния и при этом в окружающих телах не происходит никаких изменений. Система называется изолированной, если она не обменивается энергией с окружающей средой. На графике состояния обозначаются точками, а процессы – линиями.
Обратимый процесс -это такой процесс перехода системы из состояния А в состояние В, при котором возможен обратный переход от В к А через те же промежуточные состояния и при этом в окружающих телах не происходит никаких изменений. Система называется изолированной, если она не обменивается энергией с окружающей средой. На графике состояния обозначаются точками, а процессы – линиями. . (d - греческая буква - дельта)
. (d - греческая буква - дельта) - внутренняя энергия идеального газа.
- внутренняя энергия идеального газа. 1) Энтропия – это функция состояния. Введение таких величин ценно тем, что при любых процессах изменение функции состояния одинаково, поэтому сложный реальный процесс можно заменить «выдуманными» простыми процессами. Например, реальный процесс перехода системы из состояния А в состояние В (см. рис.) можно заменить на два процесса: изохорический А®С и изобарический С®В.
1) Энтропия – это функция состояния. Введение таких величин ценно тем, что при любых процессах изменение функции состояния одинаково, поэтому сложный реальный процесс можно заменить «выдуманными» простыми процессами. Например, реальный процесс перехода системы из состояния А в состояние В (см. рис.) можно заменить на два процесса: изохорический А®С и изобарический С®В.


 +
+ 



 называется свободной энергией
величина
называется свободной энергией
величина  называется связанной энергией
называется связанной энергией

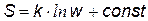

 , но передача теплоты в количестве 10-11 эрг =10-18 Дж дает уже отношение вероятностей @ 2,7.
, но передача теплоты в количестве 10-11 эрг =10-18 Дж дает уже отношение вероятностей @ 2,7.


 Устройство, в котором затрачивается теплота, а получается работа, называется тепловой машиной. Все тепловые машины работают по прямому циклу, состоящему из различных процессов. Устройство, работающее по обратному циклу, называется холодильной машиной. В холодильной машине затрачивается работа, а в результате от холодного тела отнимается теплота, т.е. происходит дополнительное охлаждение этого тела.
Устройство, в котором затрачивается теплота, а получается работа, называется тепловой машиной. Все тепловые машины работают по прямому циклу, состоящему из различных процессов. Устройство, работающее по обратному циклу, называется холодильной машиной. В холодильной машине затрачивается работа, а в результате от холодного тела отнимается теплота, т.е. происходит дополнительное охлаждение этого тела.





 (
( - из уравнений адиабат)
- из уравнений адиабат)

 Т1 – температура нагревателя
Т2 – температура холодильника
Т1 – температура нагревателя
Т2 – температура холодильника
 Молекулы представляют собой сложные системы электрически заряженных частиц. Основная масса молекулы и весь ее положительный заряд сосредоточены в ядрах, их размеры порядка 10-15 - 10-14 м, а размер самой молекулы, включая электронную оболочку, примерно 10-10 м. В целом молекула электрически нейтральна. Электрическое поле ее зарядов в основном сосредоточено внутри молекулы и за ее пределами резко убывает. При взаимодействии двух молекул одновременно проявляются и силы притяжения и силы отталкивания, они по-разному зависят от расстояния между молекулами (см рис.- пунктирные линии). Одновременное действие межмолекулярных сил дает зависимость силы F от расстояния r между молекулами, характерную и для двух молекул, и атомов, и ионов (сплошная кривая). На больших расстояния молекулы практически не взаимодействуют, на очень малых расстояния преобладают силы отталкивания. На расстояниях, равных нескольким диаметрам молекул действуют силы притяжения. Расстояние ro между центрами двух молекул, на котором F=0, - это положение равновесия. Так как сила связана с потенциальной энергией F=-dEпот /dr, то интегрирование даст зависимость потенциальной энергии от r (потенциальная кривая). Равновесное положение соответствует минимуму потенциальной энергии - Umin. Для различных молекул вид потенциальной кривой аналогичен, но числовые значения ro и Umin различны и определяются природой данных молекул.
Молекулы представляют собой сложные системы электрически заряженных частиц. Основная масса молекулы и весь ее положительный заряд сосредоточены в ядрах, их размеры порядка 10-15 - 10-14 м, а размер самой молекулы, включая электронную оболочку, примерно 10-10 м. В целом молекула электрически нейтральна. Электрическое поле ее зарядов в основном сосредоточено внутри молекулы и за ее пределами резко убывает. При взаимодействии двух молекул одновременно проявляются и силы притяжения и силы отталкивания, они по-разному зависят от расстояния между молекулами (см рис.- пунктирные линии). Одновременное действие межмолекулярных сил дает зависимость силы F от расстояния r между молекулами, характерную и для двух молекул, и атомов, и ионов (сплошная кривая). На больших расстояния молекулы практически не взаимодействуют, на очень малых расстояния преобладают силы отталкивания. На расстояниях, равных нескольким диаметрам молекул действуют силы притяжения. Расстояние ro между центрами двух молекул, на котором F=0, - это положение равновесия. Так как сила связана с потенциальной энергией F=-dEпот /dr, то интегрирование даст зависимость потенциальной энергии от r (потенциальная кривая). Равновесное положение соответствует минимуму потенциальной энергии - Umin. Для различных молекул вид потенциальной кривой аналогичен, но числовые значения ro и Umin различны и определяются природой данных молекул.