
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Белки как коллоидные растворы
Химические свойства белков нельзя непосредственно соотнести с химическим строением их полипептидной цепи. Они определяются структурной организацией макромолекул белков. Рассмотрим некоторые свойства белков как коллоидных растворов. Для белков характерен электрофорез (см. параграф 7.3). Способность белков к электрофорезу означает, что макромолекула белков образует двойной электрический слой (см. рис. 7.2). Заряд потенциалобразующего слоя определяется свойствами макромолекул белка как полиэлектролита. Длинная полипептидная цепь белка [в формуле (20.1) показаны только две полипептидные связи, фактически их сотни] на концах имеет только две ионизированные группы молекул. В боковых же группах полипептидных цепей макромолекул белков находится большое число ионогенных групп, которые способны диссоциировать в воде по следующей схеме:
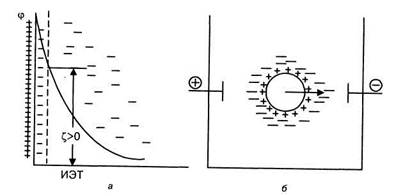
-R-COOH 7^ -R-COO +H+, ^1-r-nh;+oh\ (20.3) Именно боковые группы макромолекул создают условия для образования ДЭС. Знак и значение электрических (ф-потенциала и ^-потенциала будут определяться свойствами среды. При избытке кислоты, т.е. в кислой среде, подавляется диссоциация карбоксильных групп; равновесие реакции (20.2) смещается в левую, а равновесие реакции (20.3) — в правую сторону. Макромолекулы белка будут нести избыточный положительный заряд и становятся поликатионами, ^-потенциал становится больше нуля (£ > 0), а при электрофорезе макромолекулы белка будут двигаться к катоду (рис. 20.3). В щелочной среде, при избытке анионов ОН" подавляется диссоциация основных групп, равновесие реакции (20.3) смещается в левую сторону, а равновесие реакции (20.2) — в правую. Макромолекула белка приобретает отрицательный заряд (£ < 0) и превращается в полианион. Структура ДЭС будет соответствовать случаю, изображенному на рис. 7.3. При электрофорезе макромолекулы белков двигаются к аноду (см. рис. 7.5). Подобными свойствами обладают макромолекулы крахмала и гуммиарабика.
Рис. 20.3. Структура ДЭС (а) и электрофорез белка (б) в случае подавления диссоциации карбоксильных групп Макромолекулы различных белков отличаются друг от друга числом ионизированных групп, структурой двойного слоя, а следовательно, знаком и (или) значением С-потенциала. В связи с этим они обладают различной электрофоретической подвижностью (см. параграф 7.4), что и дает возможность разделять их между собой под действием внешнего электрического поля т е при помощи электрофореза.
Величина и знак заряда белков, находящихся в растворе, зависит от рН среды. Это обстоятельство обусловлено неодинаковым числом ионогенных групп -СООН и NH3. Так, например, у таких белков, как казеин, желатин, альбумин и некоторых других, в водных растворах кислотные группы превалируют над основными и рН раствора будет < 7. Преобладание щелочных групп (-NH3) и рН > 7 наблюдается в растворах таких белков, как глиадин пшеницы, проламин и др. При помощи рН среды можно изменять ионизирующую способность макромолекул белков. Константы диссоциации кислотных и основных групп белков не совпадают. По этой причине число диссоциированных основных и кислотных групп макромолекул белка может быть одним и тем же только при определенном значении рН среды. Такое состояние соответствует изо-электрической точке (ИЭТ), т.е. значению рН среды, при котором число ионизированных основных групп равно числу ионизированных кислотных групп. В ИЭТ противоионы полностью компенсируют заряд потенциалобразующего слоя (см. рис. 7.4), и ^-потенциал становится равным нулю. ИЭТ белков лежит в пределах рН от 2 (у пепсина) до 10,6 (у цитрохрома С), но преимущественно ИЭТ белков соответствует рН < 7. ИЭТ некоторых белков достигается при следующих значениях рНи; пепсина (фермент желудочного сока) — 2,0; казеина (белок, образующийся при свертывании молока) — 4,6: альбумина яйца — 4,8; карбоксигемоглобина - 6,87; химотрипсина (фермент сока поджелудочной железы) — 8,6.
c^i ^^^ j ков определяет конформа-ционное состояние их макромолекул, которое в свою очередь влияет на такие свойства этих растворов как вязкость и набухание. Обратимся к рис. 20.4.
При значении рН, равном или близком к ИЭТ, разноименно заряженные группы NH+3 и СОО~ могут притягиваться друг к другу и закручивать макромолекулу в клубок и даже в глобулу (ИЭТ рис. 20.4). При рН, смещенном по отношению к ИЭТ, подавляется диссоциация некоторых из функциональных групп; в кислой среде [см. уравнение (20.2)] — карбоксильных групп, а в щелочной среде — аминогрупп [см. уравнение (20.3)]. В результате остаются одноименно заряженные группы молекул, которые отталкиваются, вследствие чего макромолекулы выпрямляются (области /или II). В ИЭТ свойства растворов белков изменяются. Свертывание макромолекул в клубок снижает вязкость раствора до минимального значения (кривая 2). После выпрямления макромолекулы (области / или II) оказывают большее сопротивление течению жидкости и коэффициент вязкости г\, а следовательно и вязкость растут. Такую же зависимость от рН среды имеет и степень набухания а. В ИЭТ некоторые белки имеют наименьшую растворимость и максимальную способность к рассеянию света. Электрофоретическая подвижность, которая определяет скорость электрофореза и рассчитывается по формуле (7.16), зависит от заряда макромолекул и ^-потенциала. Изменяя свойства среды, можно регулировать ионизирующую способность белков, изменять отруктуру двойного слоя и значение ^-потенциала — тем самым регулировать скорость электрофореза; это создает дополнительные возможности для разделения смеси белков при помощи электрофореза. Для получения белков из их смеси необходимо прежде всего освободиться от низкомолекулярных соединений. Для этой цели используют диализ (см. рис. 12.7, в). Крупные макромолекулы белков остаются в емкости, а через полупроницаемую перегородку проходят низкомолекулярные примеси. Белки как ВМС Белки являются ВМС. Лпофильность (гидрофильность) белков определяет их способность к поглощению жидкости (воды), набуханию и образованию студней (см. параграфы 19.4 и 19.5). Набухший в воде белок пшеничной муки образует клейковину. Студни из клейковины обладают свойствами как твердого тела, так и жидкости. Набухание белков как и других ВМС, идет в две стадии (см. рис. 19.5). Проникновение воды в макромолекулы обусловлено выравниванием концентрации (концентрация воды в растворе значительно выше по сравнению с ее концентрацией в макромолекулах). Подобный процесс проникновения воды принято называть осмотическим. Поскольку обратный процесс исключен, т.е. переход воды из макромолекул белков в раствор, то поглощенная белком вода оказывается осмотически связанной, а ее доля достигает 75% по отношению к массе белка. Образование студня и его синерезис имеют место при свертывании крови. Под действием фермента растворимый фибриноген превращается в нерастворимый фибрин, одновременно расщепляются несколько пептидных связей и оголяются активные центры. В результате взаимодействия между ними образуются структура и студень, а затем быстро наступает синерезис. Протоплазма, в состав которой входят белки, является подвижным тиксотропным студнем, обладающим способностью к расслаиванию. На основании этих процессов реализуются функциональные свойства клеток. Белки способны образовывать пену. Их пенообразующая способность широко используется при изготовлении многих кондитерских изделий.
Растворы белков обладают теми же коллоидно-химическими свойствами, что и растворы ВМС (светорассеяние, осмос, диффузия и др.). Коэффициент диффузии белков колеблется в пределах (0,Ы0)10-п м2/с Белкам присущ ряд специфических коллоидно-химических свойств. Под действием различных физических и химических факторов происходит изменение структуры макромолекул белка и свойств его растворов. К числу таких изменений относится денатурация. Денатурация макромолекул белков (см. рис. 20.2), находящихся в нативном состоянии, связана с нарушением конформации полипептидной цепи и их внутримолекулярного взаимодействия без разрыва полипептидных связей. В результате снижается или даже утрачивается биологическая активность белка, может увеличиваться вязкость раствора белка и снижаться его растворимость. Особое практическое значение имеет денатурация белков при термической обработке. Типичным примером этого является денатурация белков яиц в кипящей воде и их дальнейшее затвердение. Тепловая денатурация белка наблюдается в хлебопечении, в процессе варки мяса и рыбы. Денатурация белка может достигаться механическим путем. Денатурация происходит также в процессе сбивания яичного белка со сливками и превращения его в пену (денатурация белков протекает на границе раздела фаз). Тонкие жидкие прослойки пены (см. рис. 16.2 и 16.3) нарушают укладку полипептидных цепей, происходит их развертывание, которое сопровождается разрывом водородных связей в процессе сбивания, т.е. в результате механического воздействия. Денатурация может быть кислотной; при скисании молока, например, образуются кислоты, которые разрушают слабые водородные связи внутри
Таким образом, несмотря на различие факторов воздействия, механизм денатурации один и тот же; он включает в себя разрыв слабых связей внутри макромолекул и разрушение нативной структуры белка. По этой причине денатурация проявляется в отношении глобулярных белков, макромолекулы которых имеют форму клубка или глобул (см. рис. 20.2). Образованию студней у глобулярных белков предшествуют денатурация и вытягивание макромолекул. Денатурация — не единственное характерное свойство белков. Растворы белков, как и растворы ВМС, являются лиофиль-ными, а следовательно, термодинамически устойчивыми системами. Под действием электролитов устойчивость растворов белков нарушается, и может происходить выпадение в осадок растворенного белка.
Заряд белков обусловлен химической природой макромолекул как полиэлектролитов ц свойствами жидкой среды, способной изменять величину и знак двойного электрического слоя (см. рис. 20.3). Процесс оседания растворенного белка называют высаливанием. Для высаливания белков необходимы более высокие концентрации электролитов по сравнению с коагуляцией золей (см. параграф 10.6). Так, яичный альбумин выпадает в осадок из раствора под действием полунасыщенного раствора сульфата аммония (NH4)2S03, а яичный глобулин — уже при полном насыщении этого раствора. В результате высаливания образуются волокна, хлопья или творожистый осадок. Вщсаливание связано с разрушением сольватной (гидратной) оболочки, окружающей макромолекулы ВМС (см. рис. 19.5 и 19.6). Полярные молекулы растворителя, образующие связанную воду, взаимодействуют с электролитами. Сольватная оболочка разрушается, и происходит процесс, обратный сольватации, называемый высаливанием, или десольватацией. Интенсивность процесса высаливания определяется степенью сольватации макромолекул ВМС, структурой сольватной оболочки белка и свойствами электролитов. По конечному результату высаливание похоже на денатурацию — и в том и в другом случае образуется осадок. Существенное отличие заключается в механизме процесса; денатурация необратима, а высаливание обратимо. Иногда эти процессы выступают в совокупности, что имеет место при дублении кожи. Дубление заключается в обработке кожи дубящими веществами, в состав которых входит таннин, диффузии их в кожу и в разрушении сольватной оболочки (высаливание) с разрывом слабых связей внутри макромолекул белков кожи (денатурация). В последующем между макромолекулами белка образуются новые прочные связи, под действием которых волокнистые макромолекулы кожи сшиваются дубителем, и образуется структура. Высаливание отличается от коагуляции. При коагуляции происходит сжатие диффузного слоя. Коагуляция происходит тогда, когда значение ^-потенциала золя равно нулю или близко к нему. Высаливание и выпадение осадка белка обусловлено снижением его растворимости в концентрированном растворе электролита. Высаливание в отличии от коагуляции не подчиняется теории ДЛФО и является обратимым процессом. Белки, выделяющиеся в качестве самостоятельной фазы в процессе высаливания, затем, после удаления электролитов, могут вновь образовать раствор. Высаливание наблюдается и для других ВМС, макромолекулы которых имеют сольватные (гидратные) оболочки. Высаливание из водных растворов ВМС может происходить не только в присутствии электролитов, но и под действием органических веществ (некоторых спиртов, ацетона и др.). Эти вещества при взаимодействии с водой гидролизуются, разрушают гидратную оболочку, снижают растворимость ВМС и способствуют образованию осадков, т.е. высаливанию. Путем добавления спирта к водному раствору, состоящему из смеси различных белков, можно осуществить их разделение. Сначала из смеси выпадают в осадок белки с относительно большой молекулярной массой в связи с тем, что белки с большей молекулярной массой, как и другие ВМС, растворяются хуже. По мере добавления новой порции спирта к водному раствору белков будут выпадать в осадок белки с относительно меньшей молекулярной массой.
При высаливании белков и других ВМС иногда наблюдается образование капель новой жидкой фазы, называемой коацерватом. Сам процесс выделения из раствора новой жидкой фазы, обогащенной ВМС, называется коацервацией. Причина коацервации заключается в способности некоторых ВМС (и белков в том числе) образовывать в растворе ассоциаты, состоящие из нескольких макромолекул. При достижении определенных размеров и достаточной стабильности эти ассоциаты затем могут формировать новую фазу. Коацервация может происходить при понижении температуры и не сопровождаться высаливанием. Впоследствии отдельные капли соединяются в более крупные агрегаты, и образуется слой с повышенным содержанием ВМС, способный к застудневанию. В заключение отметим, что уникальное значение белков в жизни всех организмов подчеркивается их называнием «протеины» (от греческого слова «первый»). Белки являются необходимым и неизменным компонентом пищи. Шелк и шерсть — это природные белковые волокна. С обработкой белков непосредственно связана технология производства желатина, медицинских препаратов (гормонов, антисывороток и др.), а косвенно — самых различных пищевых масс. Глава 21
Коллоидные ПАВ обладают комплексом уникальных поверхностных и объемных свойств. Растворы коллоидных ПАВ способны образовывать кристаллы и эмульсии, смачивать поверхности, удалять загрязнения, сообщать продукции необходимые технологические свойства, улучшать товарный вид и увеличивать сроки хранения. Причем их действие проявляется при небольших концентрациях, составляющих порой сотые доли про-
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 366; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.125.171 (0.026 с.) |

 /Л/\_ Рн рН водного раствора бел-
/Л/\_ Рн рН водного раствора бел-



 макромолекул белка. В результате макромолекулы распрямляются, изменяется их форма, а с нею и свойства белка.
макромолекул белка. В результате макромолекулы распрямляются, изменяется их форма, а с нею и свойства белка. КОЛЛОИДНЫЕ ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА
КОЛЛОИДНЫЕ ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА


 цента. Умелое применение коллоидных ПАВ в промышленности позволяет интенсифицировать технологические процессы, повышать качеств по выпускаемой продукции, экономить сырье и энергетические ресурсы.
цента. Умелое применение коллоидных ПАВ в промышленности позволяет интенсифицировать технологические процессы, повышать качеств по выпускаемой продукции, экономить сырье и энергетические ресурсы.


