Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетический и силовой аспекты поверхностного натяженияСодержание книги
Поиск на нашем сайте
Свойства поверхности раздела фаз дисперсных систем резко отличаются от свойств самой фазы; подобные отличия имеют место на границе раздела любых фаз. Энергетический аспект поверхностного натяжения определяется удельной свободной поверхностной энергией.
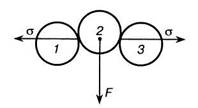
Для того чтобы понять, что собой представляет удельная поверхностная энергий, рассмотрим границу раздела фаз, одна из которых является жидкостью, другая — газом. Взаимодействие молекул жидкости схематически пока-
Рис. 2.2. Схема образования избытка поверхностной энергии: А, Б — молекулы в объеме и на поверхности жидкости; В — гребень на поверхности Рис. 2.3. Схема образования поверхностного натяжения 2—766 33 зано на рис. 2.2. В глубине жидкости молекула А окружена со всех сторон такими же молекулами, воздействие которых взаимно компенсируется. Молекулы на поверхности одновременно взаимодействуют с молекулами жидкости и газа. Молекула Б поверхностного слоя взаимодействует со своими соседями, находящимися в газовой среде и в жидкости. Воздействие молекул жидкой фазы на молекулу Б значительно превышает воздействие на нее со стороны молекул газовой фазы. У этой молекулы в отношении молекул газовой фазы сохраняется такая же способность к взаимодействию, как в отношении молекул жидкости. Для всех молекул поверхностного слоя нереализованная способность к взаимодействию со стороны одной из фаз (в данном случае газовой) и будет характеризовать свободную поверхностную энергию. Поверхность раздела фаз обладает избытком нескомпенсирован-ной энергии. Этот избыток в расчете на единицу поверхности и составляет удельную свободную поверхностную энергию. Удельная свободная поверхностная энергия не является особой формой энергии, а обусловлена самим положением молекул на границе раздела фаз. Энергетический аспект поверхностного натяжения определяется работой изотермического и обратимого изменения площади поверхностного слоя в расчете на 1м2. Жидкость всегда стремится к тому, чтобы площадь ее свободной поверхности была минимальной. Если на поверхности жидкости образуется гребень В (см. рис. 2.2), то в соответствии с условием минимальной поверхностной энергии [уравнение (2.1)] гребень изчезает и поверхность жидкости становится идеально гладкой. Нескомпенсированное межмолекулярное взаимодействие на границе раздела фаз и между молекулами внутри жидкости обусловливает возникновение тангенциальной силы. Такая сила, рассчитанная на единицу длины периметра, ограничивающего поверхность жидкости, определяет силовой аспект поверхностного натяжения. Поверхностное натяжение жидкости на границе с газовой средой обозначено на рис. 2.2 ажг. Рассмотрим, как возникает поверхностное натяжение (рис. 2.3). Для наглядности на рисунке показаны только три молекулы на поверхности раздела фаз. Молекула 2, которая первоначально может быть расположена несколько выше молекул 1 и 3, в результате взаимодействия с молекулами внутри жидкости будет расталкивать соседние молекулы с силой F. В результате возникает сила, направленная тангенциально поверхности раздела фаз а; эта сила есть поверхностное натяжение. Удельная свободная поверхностная энергия (энергетический аспект) и тангенциальная сила (силовой аспект поверхностного натяжения) вызваны одной и той же причиной - особым положением молекул на границе раздела фаз и нескомпенсирован-ностью межмолекулярного взаимодействия (см.рис.2.2). Для индивидуальных веществ, например для воды без примесей, когда межмолекулярное взаимодействие и формирование поверхностного слоя осуществляются одними и теми же моле- кулами, значения поверхностного натяжения в энергетическом и силовом выражении (их обозначают единым символом а) совпадают. В подстрочном индексе указывается, на границе каких фаз рассматривается поверхностное натяжение. Так, а^ означает, что речь идет о границе жидкости с газовой средой. Для растворов, в которых межмолекулярное взаимодействие их компонентов (растворенных веществ и растворителя) различно, значения поверхностного натяжения в виде энергии и силы не совпадают. Различие между двумя выражениями поверхностного натяжения для многокомпонентных систем, например водных растворов, можно проиллюстрировать на основе термодинамических представлений. В соответствии с условием (2.2) изменение энергии Гиббса рассматривают по отношению ко всей поверхности раздела фаз. Подобное изменение в расчете на единицу площади GB можно представить в виде (2.11) Дифференцируя равенство (2.11) с учетом условия (2.2), получим а = dGJdB = (GBdB + BdGB)/dB = GB + BidGJdB). (2.12) Для однокомпонентной жидкости энергия Гиббса не зависит от изменения площади поверхности раздела фаз, т. е. 3GB/dB = О, а а = GB = G/B, что соответствует соотношению (2.9). Таким образом, поверхностное натяжение индивидуальных веществ соответствует удельной свободной поверхностной энергии, которая, в свою очередь, равна энергии Гиббса в расчете на единицу площади поверхности раздела фаз. Для растворов, т.е. многокомпонентных систем, удельная энергия Гиббса GB зависит от поверхности раздела фаз, а поверхностное натяжение в виде энергии отличается от его силовой трактовки на величину B(dGJdB), т.е. на второй член уравнения (2.12). В большинстве случаев, особенно для разбавленных растворов, различие между двумя аспектами поверхностного натяжения незначительно. Поэтому две данные величины часто отождествляют и рассматривают как поверхностное натяжение. Величина а — это энергия, рассчитанная на единицу поверхности раздела фаз, и одновременно сила, отнесенная к единице длины контура, ограничивающего поверхность раздела фаз, в том числе жидкости. Размерности этих величин совпадают:
Обычно принято указывать размерность удельной свободной поверхностной энергии в Дж/м2, а поверхностного натяжения — в Н/м, однако для того, чтобы подчеркнуть энергетический аспект в образовании новой поверхности, часто размерность поверхностного натяжения указывают в Дж/м2. Поверхностное натяжение является одним из важнейших параметров, определяющих свойства поверхности раздела фаз. Когда воздействие на молекулы в поверхностном слое со стороны молекул пара будет таким же, как со стороны жидкости, поверхностное натяжение станет равным нулю. Молекулы на поверхности будут испытывать аналогичные воздействия со стороны соседних молекул. Скомпенсированность межмолекулярного взаимодействия означает, что граница раздела между фазами исчезла и система из гетерогенной превратилась в гомогенную. Чем ниже поверхностное натяжение, тем меньше нескомпенсированность молекулярного взаимодействия и тем больше влияние молекул соседних фаз. Поверхностное натяжение исчезает в критическом состоянии, когда две фазы находятся в термодинамическом равновесии и становятся тождественны по своим свойствам. Критическое состояние однокомпонентной системы в виде жидкость-пар характеризуется критическими значениями температуры, давления и плотности. Незначительное поверхностное натяжение наблюдается для сжиженных газов. Так, поверхностное натяжение сжиженного кислорода составляет 13,0 мДж/м2 (миллиджоуля на квадратный метр), водорода — 2,25 мДж/м2, а сжиженного гелия — всего 0,22 мДж/м2. При 293 К поверхностное натяжение воды составляет 72,75 мДж/м2. При этой же температуре поверхностное натяжение подсолнечного масла равно 33, сырого молока — 45—60, а сухих вин — 46—52 мДж/м2 что ниже поверхностного натяжения воды. Поверхностное натяжение ртути при 273 К составляет 480,3 а расплава железа при 1498 К — 826 мДж/м2. Поверхностное натяжение с увеличением температуры снижается [см формулу (2.18)]. Это связано с ростом давления насыщенного пара и уменьшением нескомпенсированности межмолекулярного взаимодействия. Поэтому при оценке значений поверхностного натяжения необходимо указывать температуру. Понятия о поверхностном натяжении и об удельной свободной поверхностной энергии справедливы для любых конденсированных тел в том числе и для твердого тела, граничащего с газом или с жидкостью. Образование новой поверхности можно условно представить в виде двух стадий. На первой стадии после образования поверхности молекулы на ней первоначально остаются в том положении, которое они занимали ранее в объеме. В процессе второй стадии молекулы на поверхности перегруппировываются и занимают равновесное положение. В жидкости обе эти стадии реализуются одновременно и быстро, а в твердом теле вторая стадия может идти очень медленно или не протекать совсем. В результате образующаяся поверхность твердого тела становится неоднородной; возникают неровности и различное расположение молекул на границе раздела фаз. Работа, затрачиваемая на образование новой поверхности, т.е. удельная свободная поверхностная энергия в различных местах будет неодинакова. Неоднородность поверхности твердого тела и ограниченная подвижность молекул этих тел сказываются на поверхностном натяжении. В связи с этим поверхностное натяжение твердых тел следует рассматривать в определенной точке поверхности или представлять в качестве усредненной величины. Поверхностное натяжение на границе двух конденсированных тел называют межфазовым. Оно образуется на поверхности раздела двух нерастворимых жидкостей, твердого тела с жидкостью и двух твердых тел и обозначается соответственно а^, сТЖ и а^.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 1234; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.86.104 (0.01 с.) |