Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обезвреживание биогенных аминовСодержание книги
Поиск на нашем сайте Накопление биогенных аминов может вызвать серьезные нарушения в организме, поэтому существуют специальные механизмы их обезвреживания. Один из путей обезвреживания биогенных аминов – их окислительное дезаминирование с помощью аминооксидаз: монооксидаза (МАО) и диаминооксидаза (ДАО)
Кофермент МАО – ФАД, кофермент ДАР – пиридоксальфосфат (В6) МАО связанна с митохондриями клеток, ДАО находится в цитоплазме. МАО инактивирует первичные, вторичные, третьичные амины, а ДАО – гистамин, путресцин, кадаверин. а) образовавшийся альдегид окисляется до органической кислоты
б) перекись водорода разлагается под действием специфического фермента каталазы:
Т.о. нами рассмотрены основные пути преобразования АК, которые образовались в результате протеолиза белков. Гниение белков в кишечнике При избыточном потреблении животных белков и ряде патологий в кишечнике возможно развитие гнилостных и бродильных процессов. При декарбоксилировании некоторых АК образуются ядовитые амины (путрисцин, кадаверин), а также ряд нетоксичных соединений – спиртов, ЖК и др. Процессы распада АК под действием микрофлоры кишечника называется гниением белков в кишечнике. Одним из основных условий декарбоксилирования АК бактериями является наличие кислой среды (рН 3,5-5,5). В кишечнике же при нормальном его функционировании рН слабощелочная. В результате инвазии некоторыми патогенными бактериями возникают диспепсии, при которых рН среды кишечника подкисляется, чаще всего локально до рН 3,0-5,0. Именно в этих участках активно развиваются процессы брожения. В основе гниения белков лежат реакции декарбоксилирования и дезаминирования. а) из лизина образуется кадаверин, из орнитина – путресцин. Е декарбоксилаза
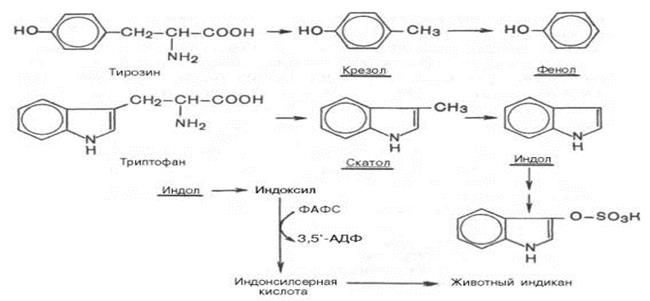
Ядовитость кадаверина и путресцина незначительна и при всасывании в кровь они выводятся с мочой в неизменном виде. б) При разрушении серосодержащих аминокислот (цистеин, метионин) образуется сероводород (H2S), метилмеркаптан (CH3SH) и другие соединения, содержащие серу, придающие калу неприятный запах. в) из ароматических АК (тирозина, триптофана) образуется соответственно фенол и n–крезол, скатол и индол:
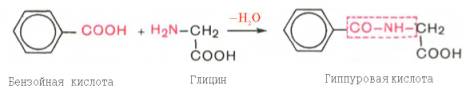
После высаливания эти продукты попадают в печень, где инактивируются путем образования неядовитых парных кислот – с серной либо глюкуроновой кислотами. Причем последняя взаимодействует с фенолом и n–крезолом, скатолом и индолом в активной форме в виде 3′-фосфоаденозин-5′-фосфосульфатом (ФАФС) и уридиндифосфоглюкуроновой кислотой. Обезвреженные продукты выводятся с мочой. Комплекс индола и ФАФС называется животным индиканом (ЖИ) По количеству ЖИ в моче судят по скорости гниения белков в кишечнике и функциональному состоянию печени. О состоянии печени судят и по другому показателю - пробе Квика. Это определение гиппуровой кислоты в моче, которая образуется в результате обезвреживания бензойной кислоты (продукта распада ароматических АК)
Количество веществ, образующихся из АК в результате гниения, а так же механизмы их обезвреживания не исчерпываются приведенными выше. Организм человека и животных приспособлен обезвреживать ядовитые продукты распада белков в кишечнике различными путями.
ОБМЕН БЕЛКОВ Обмен и обезвреживание аммиака. 1. Механизмы обезвреживания аммиака. Орнитиновый цикл. 2. Превращение углеродных скелетов. 3. Обмен глицина. 4. Обмен серина. 5. Обмен серосодержащих АК. 6. Обмен ароматических АК. 7. Обмен триптофана. 8. Обмен дикарбоновых АК.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 1526; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |

 a
a
 b
b
 + Н2О
+ Н2О
 Каталаза
Каталаза