
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема. Аритмии. Нарушение возбудимости, автоматизма и проводимости сердцаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Тема. Аритмии. Нарушение возбудимости, автоматизма и проводимости сердца Нарушение ритма сердца. Классификация аритмий. Нарушения автоматизма, виды, причины, ЭКГ-признаки. Аритмия — типовая форма патологии сердца, характеризующаяся нарушением частоты и периодичности генерации возбуждения или последовательности возбуждения предсердий и желудочков. Виды аритмий. В соответствии с механизмом возникновения аритмий (патогенезом) все нарушения сердечного ритма можно условно подразделить на три типа: 1. нарушения автоматизма; 2. нарушения возбудимости; Нарушения проводимости. Подобное деление в известном смысле условно, потому что в реальности часто приходится сталкиваться с аритмиями сочетанного характера. Например, при фибрилляции желудочков и предсердий могут иметь место, как нарушение возбудимости, так и патология проведения сердечного импульса. Этиология аритмий Все причины аритмий можно условно подразделить на четыре группы: 1. Нарушения нейроэндокринной регуляции электрофизиологических процессов в кардиомиоцитах и клетках проводящей системы сердца (стресс, неврозы и др.); 2. органические поражения миокарда, его аномалии, врожденные или наследственные дефекты с повреждением электрогенных мембран и клеточных структур (миокардиты, пороки седца, кардиосклероз и др.); 3. сочетание нарушений нейрогуморальной регуляции ритма и органических заболеваний сердца (ИБС, реперфузионный синдром, поражение электрическим током и др.); 4. интоксикации, в том числе лекарственными препаратами (алкоголь, никотин, побочное действие ЛС и др.). Нарушения нейроэндокринной регуляции электрофизиологических процессов в кардиомиоцитах и клетках проводящей системы сердца. Одной из основных причин аритмий является изменение физиологического соотношения между тонической активностью симпатических и парасимпатических элементов, иннервирующих сердце. Одним из примеров нарушений ритма, обусловленных дисбалансом симпатического и парасимпатического звеньев вегетативной нервной системы, является снижение электрической стабильности сердца при психоэмоциональном стрессе. Известно, что высокие концентрации адреналина в крови, активируя β-адренорецепторы почечных канальцев, способствуют усилению экскреции К+ и развитию гипокалиемии. Гипокалиемия вызывает нарушения процессов реполяризации миокарда, создавая условия для развития аритмий.
Роль эндокринных нарушений в патогенезе аритмий. Избыточная продукция тиреоидных гормонов способствует увеличению количества адренорецепторов в миокарде и повышению их чувствительности к эндогенным катехоламинам. По этой причине у больных тиреотоксикозом, как правило, наблюдаются тахикардия и нарушения сердечного ритма, обусловленные повышением адренореактивности сердца. Одной из частых «эндокринных» причин нарушений электрической стабильности сердца является избыточное образование минералокортикоидов в коре надпочечников (первичный и вторичный альдостеронизм). Реже аритмии возникают при гиперсекреции глюкокортикоидных гормонов (болезнь Иценко-Кушинга) или длительном приеме их фармакологических аналогов. Механизм аритмогенного эффекта минералокортикоидов (прежде всего, наиболее активного из них – альдостерона) связан с дисбалансом Na+/K+ в организме. Альдостерон, действуя на почечные канальцы, вызывает задержку в организме Na+ и усиление экскреции К+, в результате чего возникает гипокалиемия, которая способствует нарушению процессов реполяризации миокарда и возникновению аритмий. Аритмии, вызванные лекарственными препаратами. Часто причиной аритмий являются лекарственные препараты, обладающие собственной аритмогенной активностью. В первую очередь это относится к сердечным гликозидам и диуретикам. Мочегонные препараты, усиливая экскрецию калия, способствуют возникновению гипокалиемии. Сердечные гликозиды (дигиталис и др.) имеют свойство накапливаться в организме, ингибируя при этом Na+/K+-АТФазу, локализованную на сарколемме кардиомиоцитов. Снижение активности этого фермента сопровождается снижением уровня К+ и увеличением концентрации Na+ в саркоплазме. Накопление натрия в цитоплазме кардиомиоцитов приводит к усилению Na+/Ca2+-обмена, что сопровождается активным поступлением Са2+ в клетки миокарда и способствует усилению насосной функции сердца. Однако при этом формируется Са2+-перегрузка кардиомиоцитов. Кроме того, снижение внутриклеточной концентрации К+ вызывает замедление процессов реполяризации и тем самым способствует возникновению ранних деполяризаций и аритмий по механизму триггерного автоматизма.
Внутрижелудочковые блокады. Последствия аритмий
Нарушение автоматизма Автоматизм — способность ткани сердца спонтанно генерировать потенциал действия (ПД). Нарушение автоматизма: 1. Нарушения нормального автоматизма – нарушение автоматизма СА-узла. 2. Появление аномального автоматизма – автоматизма, который обусловлен активацией пейсмекерной функции в клетках проводящей системы, не являющихся в норме водителями ритма (АВ-узел, ножки пучка Гиса, волокна Пуркинье). Клетки сердца по своим электрофизиологическим свойствам подразделяются на: клетки рабочего миокарда и клетки пейсмекера. Пейсмекер (от англ. pacemaker – водитель ритма) — клетки сердца, способные к спонтанной генерации импульса возбуждения. Наибольшей способностью к автоматии обладает синоатриальный узел (СА-узел). В условиях физиологической нормы в нем возникает возбуждение, которое благодаря проводящей системе сердца, последовательно охватывает предсердия и желудочки. Поэтому СА-узел называют водителем ритма сердца (I порядка), или пейсмекером. Пейсмекер может генерировать большую частоту возбуждений, чем другие участки проводящей системы. Он подавляет автоматию остальных волокон этой системы. Если СА-узел блокирован по каким-то причинам, то водителем ритма становится атриовентрикулярный узел (АВ-узел), который генерирует частоту возбуждений 40-50 в мин. Если водителем ритма станет пучок Гиса, то максимум частоты его возбуждений составляет 30-40 в мин. При такой частоте сокращений сердца даже в состоянии покоя у человека будут проявляться симптомы недостаточности кровообращения. Волокна Пуркинье могут генерировать до 20 импульсов в мин. Клетки пейсмекера обладают автоматизмом, то есть способностью к спонтанной деполяризации (рис. 1). Автоматизм клеток пейсмекера обусловлен особенностями проницаемости мембраны этих клеток и поляризации: 1. низким уровнем трансмембранного потенциала (МП= -60 мВ), 2. наличием спонтанной деполяризации.
Рис. 1. Потенциал действия пейсмекерной клетки.
Эти свойства во многом определяются особенностями ионных каналов в мембранах клеток пейсмекера. Фаза 4 потенциала действия пейсмекерной клетки характеризуется постепенной, спонтанной деполяризацией (медленная спонтанная диастолическая деполяризация), вызванной пейсмекерным током (If). Пейсмекерный ток переносится преимущественно ионами Na+. Ионные каналы, через которые проходит пейсмекерный ток, отличаются от быстрых Na+ каналов, ответственных за фазу 0 деполяризации клеток рабочего миокарда. Пейсмекерные каналы открываются в период реполяризации клетки, когда МП достигает своего максимального отрицательного значения. Ток ионов Na+ через пейсмекерные каналы способствует тому, что мембранный потенциал (МП) во время фазы 4 становится все менее отрицательным и, при достижении порогового потенциала (~ -40 мВ), происходит возбуждение ПД (фаза 0).
Фаза 0 пейсмекерной клетки наступает менее быстро, чем в кардиомиоцитах, так как она обусловлена током ионов Са2+ внутрь клетки через относительно медленные кальциевые каналы. Реполяризация пейсмекерных клеток развивается так же, как и клеток рабочего миокарда – происходит инактивация Са2+-каналов, активация К+-каналов, усиленный выход ионов К+ из клетки. Скорость медленной спонтанной диастолической деполяризации во многом определяет частоту генерации импульсов клетками-пейсмекерами: чем больше скорость спонтанной диастолической деполяризации, тем выше скорость генерации импульсов. Симпатические волокна выделяют норадреналин, который через β-адренорецепторы и систему посредников увеличивает содержания в клетке цАМФ, что приводит к возрастанию скорости диастолической деполяризации и тахикардии. Это влияние опосредуется через увеличение проницаемости мембран кардиомиоцитов для ионов Na+ и Са2+. Парасимпатические волокна посредством медиатора ацетилхолина и М2-рецепторы сердца оказывают обратный эффект – приводят к уменьшению скорости диастолической деполяризации, вызывают брадикардию. Под влиянием ацетилхолина увеличивается проницаемость мембран кардиомиоцитов для ионов К+ и снижается проницаемость их для Са2+. Происходит усиление выхода К+ из клеток и снижение входа Са2+. Это ведет к гиперполяризации мембран и снижению их возбудимости.
Нарушения нормального автоматизма. Известно, что в основе автоматизма лежит медленная спонтанная диастолическая деполяризация, постепенно понижающая МП до порогового уровня, с которого начинается быстрая деполяризация мембраны (фаза 0 ПД). На продолжительность спонтанной деполяризации и, следовательно, на частоту сердечной деятельности оказывают влияние следующие механизмы. 1. Скорость спонтанной диастолической деполяризации. При ее возрастании пороговый потенциал возбуждения достигается быстрее и происходит учащение синусового ритма. Замедление спонтанной диастолической деполяризации, ведет к замедлению синусового ритма. 2. Изменение величины мембранного потенциала покоя СА-узла. Когда мембранный потенциал становится более отрицательным (при гиперполяризации клеточной мембраны, например при действии ацетилхолина), требуется больше времени для достижения порогового потенциала возбуждения, если, разумеется, скорость спонтанной диастолической деполяризации остается неизменной. Следствием такого сдвига будет уменьшение частоты сердечных сокращений (ЧСС). При увеличении мембранного потенциала покоя, когда он становится менее отрицательным, частота сердечных сокращений, напротив, возрастает.
3. Изменение порогового потенциала возбуждения. Его уменьшение (более отрицательный) способствует учащению синусового ритма, а увеличение (менее отрицательный) - брадикардии. Величина порогового потенциала возбуждения кардиомиоцитов определяется свойствами Na+- каналов, а клеток проводящей системы – Ca2+- каналов. В связи с этим следует напомнить, что в основе фазы быстрой деполяризации в клетках рабочего миокарда лежит активация быстрых Na+- каналов, а в клетках специализированной ткани сердца - Ca2+- каналов. 4. Различные комбинации 3-х основных электрофизиологических механизмов, регулирующих автоматизм СА-узла. Аномальный автоматизм (эктопический автоматизм)– это появление пейсмекерной активности в клетках сердца, не являющихся водителями сердечного ритма. В норме эктопическая активность подавляется импульсами, поступающими из СА-узла, но при блокаде проведения импульса по предсердиям главным водителем ритма сердца может стать АВ-узел. Способность к спонтанной деполяризации клеток АВ-узла менее выражена, чем в клетках СА-узла, поэтому в условиях поперечной блокады обычно развивается брадикардия. Еще менее выражена способность к автоматизму у волокон Пуркинье. Однако эти волокна, как и другие клетки проводящей системы, более устойчивы к гипоксии, чем сократительные кардиомиоциты, в связи с чем, не всегда погибают в зоне ишемии. Электрофизиологические свойства ишемизированных волокон Пуркинье существенно отличаются от параметров интактных волокон тем, что у них появляется пейсмекерная активность, а способность к проведению импульса существенно снижается. Кроме того, пейсмекерная активность, возникающая в волокнах Пуркинье, в условиях патологии (например, при ишемии) перестает подавляться импульсами, поступающими из СА-узла, и может быть причиной возникновения желудочковых экстрасистол. Нарушение возбудимости Повышение возбудимости кардиомиоцитов наиболее часто обусловливает возникновение аритмий по механизму триггерной (наведенной, пусковой) активности (от англ. trigger – спусковой крючок). В некоторых случаях нормальный потенциал действия (ПД) может вызывать дополнительные деполяризации, что сопровождается увеличением ЧСС. Это явление, называемое постдеполяризацией, наблюдается тогда, когда первый ПД приводит к быстрым колебаниям трансмембранного потенциала кардиомиоцитов. В отличие от спонтанной активности, которая проявляется при усилении автоматизма, эта дополнительная деполяризация вызывается предсуществующим ПД. В зависимости от времени наступления по отношению к возбуждающему ПД различают два типа постдеполяризации: ранняя и поздняя постдеполяризации (рис. 2). В обоих случаях (ранняя, поздняя постдеполяризации), если постдеполяризация достигает величины порогового потенциала, то клетки генерируют дополнительные ПД.
Потенциал действия, возникающий во время постдеполяризаций, является самоподдерживающимся, вызывая серии последовательных деполяризаций мембраны, что приводит к возникновению тахикардии.
 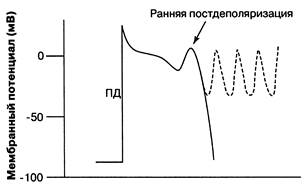
Рис. 2. Триггерная активность.
Номотопные аритмии. Синусовая тахикардия — увеличение в покое частоты генерации импульсов возбуждения в СА-узле более 90 в мин с одинаковыми интервалами между ними (рис. 4). Электрофизиологический механизм: ускорение спонтанной диастолической деполяризации мембран клеток СА-узла. Причины: 1. Активация влияния на сердце симпатикоадреналовой системы: стрессы, физические нагрузки, острая артериальная гипотензия, сердечной недостаточности, гипертермии, лихорадка. 2. Снижение влияния на сердце парасимпатической нервной системы: повреждения парасимпатических нервных образований или холинорецепторов миокарда. 3. Прямое действие повреждающих факторов различной природы на клетки CА-узла (миокардиты, перикардиты и т.д.).
Рис. 4. Синусовая тахикардия. Нормальные зубцы Р и комплексы QRS; ЧСС больше 100 уд/мин.
Значение синусовой тахикардии. С одной стороны является компенсаторно-приспособительной реакцией, направленной на поддержание адекватного потребностям организма МОК в условиях стресса, острой кровопотери, гипоксии и др. С другой стороны тахикардия способствует увеличению потребности миокарда в кислороде и уменьшению продолжительности диастолы сердца (длительная выраженная синусовая тахикардия может привести к недостаточности коронарных артерий и ишемическому повреждению миокарда). Синусовая брадикардия — уменьшение в покое частоты генерации импульсов возбуждения СА-узлом ниже 60 в минуту с одинаковыми интервалами между ними (рис.5). Электрофизиологический механизм: замедление спонтанной диастолической деполяризации мембран клеток СА-узла. Причины:
Гемодинамические нарушения при выраженной синусовой брадикардии обусловлены уменьшением сердечного выброса.
Рис. 5. Синусовая брадикардия. Нормальные зубцы Р и комплексы QRS; сниженная ЧСС < 60 уд/мин. Синусовая аритмия — нарушение сердечного ритма, характеризующееся неравномерными интервалами между отдельными импульсами возбуждения, исходящими из СА-узла (рис.6). Электрофизиологический механизм: колебания скорости (увеличение / снижение) медленной спонтанной диастолической деполяризации пейсмейкерных клеток. Причины: флуктуация или нарушение соотношения симпатикоадреналовых и парасимпатических воздействий на сердце. Синусовая аритмия, связанная с фазами дыхания, называется дыхательной аритмией, наблюдается у новорожденных, у здоровых людей молодого возраста.
Рис. 6. Синусовая аритмия. Нормальные зубцы Р и комплексы QRS.
Синдром слабости СА-узла (синдром брадикардии–тахикардии) — неспособность СА-узла обеспечивать ритм сердца, адекватный уровню жизнедеятельности организма. Электрофизиологические механизмы: нарушение автоматизма СА-узла, особенно фаз реполяризации и спонтанной диастолической деполяризации, возникновение на этом фоне гетеротопных (эктопических) очагов ритмической активности. Причины: нарушение сбалансированности симпатикоадреналовых и парасимпатических влияний на сердце с преобладанием последних (например, при невротических состояниях), а также гибель или дистрофия клеток СА-узла (например, при инфаркте, воспалении). Проявляется периодической или постоянной синусовой брадикардией, сменяющейся синусовой тахикардией, трепетанием или фибрилляцией предсердий, медленным восстановлением синусового ритма после прекращения синусовой тахикардии, эпизодами остановки СА-узла (рис. 7).
Рис. 7. Синдром слабости СА-узла. Эпизод остановки СА-узла.
Синусовая брадикардия сопровождается понижением величины сердечного выброса, снижением АД и потерей сознания в связи с ишемией мозга при частоте сердечных сокращений менее 35 ударов в минуту. Прекращение генерации импульсов СА-узлом (синдром остановки СА-узла) более чем на 10-20 секунд вызывает потерю сознания. Значительное уменьшение сердечного выброса при выраженной брадикардии может обусловить снижение перфузионного давления в венечных артериях и развитие коронарной недостаточности. Гетеротопные аритмии. Эктопические аритмии(гетеротопные ритмы) возникают вне СА-узла, обусловлены преобладанием автоматизма нижележащих центров ритмогенеза. Снижение активности или прекращение деятельности СА-узла в результате его функционального или органического повреждения создаёт условия для включения автоматических центров второго и третьего порядков. Эктопический (по отношению к СА-узлу) очаг с его более редким ритмом принимает на себя функцию пейсмекера. В связи с этим нарушения ритма такого типа носят название гетеротопных или замещающих (синусовый ритм) аритмий. Гетеротопные аритмии: предсердный медленный ритм, узловой ритм (АВ ритм), идиовентрикулярный ритм. Узловой ритм – это нарушение, при котором роль водителя ритма берет на себя атриовентрикулярный узел (рис. 8). При этой патологии частота сердечных сокращений снижается до 40-60 уд./мин. Причинами подобного нарушения автоматизма наиболее часто являются интоксикация, которая приводит к слабости синусового узла, или блокада внутрипредсердного проведения импульса. Степень возникающей брадикардии зависит от того, какая часть АВ-узла (верхняя, средняя или нижняя) становится генератором импульсов: чем ниже генерируются импульсы, тем реже их частота. Нарушается и общая гемодинамика, для которой редкий атриовентрикулярный ритм может оказаться недостаточным.
Рис. 8. Атриовентрикулярный ритм. Инверсия зубца Р, ЧСС 40-60 уд/мин. Идиовентрикулярный ритм (желудочковый, рис. 9) – это нарушение, при котором роль водителя ритма берут на себя ножки пучка Гиса или волокна Пуркинье. Ритм урежается до 10-30 уд./мин. Такое нарушение автоматизма развивается при повреждении синусового и атриовентрикулярного узлов и ведет к нарушению центральной гемодинамики, что может закончиться гибелью пациента.
Рис. 9. Идиовентрикулярный ритм. Отсутствие зубца Р, интервала PQ; ЧСС 10-30 уд/мин. Рис. 14. Трепетание предсердий.
Фибрилляция (мерцание) предсердий и желудочков представляет нерегулярную, беспорядочную электрическую активность предсердий и желудочков, сопровождающуюся прекращением эффективной насосной функции сердца. Фибрилляция предсердий (рис. 15) развивается при частоте эктопических импульсов более 400–500 в минуту, фибрилляция желудочков более 300–500 (рис. 16). При такой частоте возбуждения клетки миокарда не могут ответить синхронным, координированным сокращением, охватывающим весь миокард.
Рис. 15. Фибрилляция предсердий.
Рис. 16. Фибрилляция желудочков.
Фибрилляция желудочков — наиболее опасная форма аритмий, характеризующаяся быстрым хаотичным возбуждением желудочков при полном отсутствии координированных сокращений сердца. Полагают, что в основе фибрилляции желудочков лежит механизм re-entry с образованием многочисленных коротких цепей, по которым распространяются повторные волны возбуждения. На ЭКГ регистрируют хаотичные, быстрые нерегулярные волны разной формы и амплитуды, комплексы QRS не определяются (рис. 25). В результате сердце перестает выполнять свою гемодинамическую функцию. Это настолько тяжелое состояние, что получило образное название delirium cordis («бред сердца»). Единственный эффективный способ прерывания фибрилляции желудочков — кратковременная остановка сердца с тем, чтобы после нее естественный водитель ритма (СА-узел), вновь бы «запустил» сердце как синхронно работающую систему. Именно на этом принципе основана электрическая дефибрилляция сердца, при которой через сердце пропускают кратковременный, очень мощный электрический разряд, который не повреждает сердечную мыщцу, но на короткий период подавляет активность всех кардиомиоцитов, прекращает тем самым фибрилляцию, дает возможность СА-узлу стать водителем ритма. Тема. Аритмии. Нарушение возбудимости, автоматизма и проводимости сердца
|
|||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 1053; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.104.175 (0.017 с.) |













