Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Специфичность действия ферментов.Содержание книги
Поиск на нашем сайте
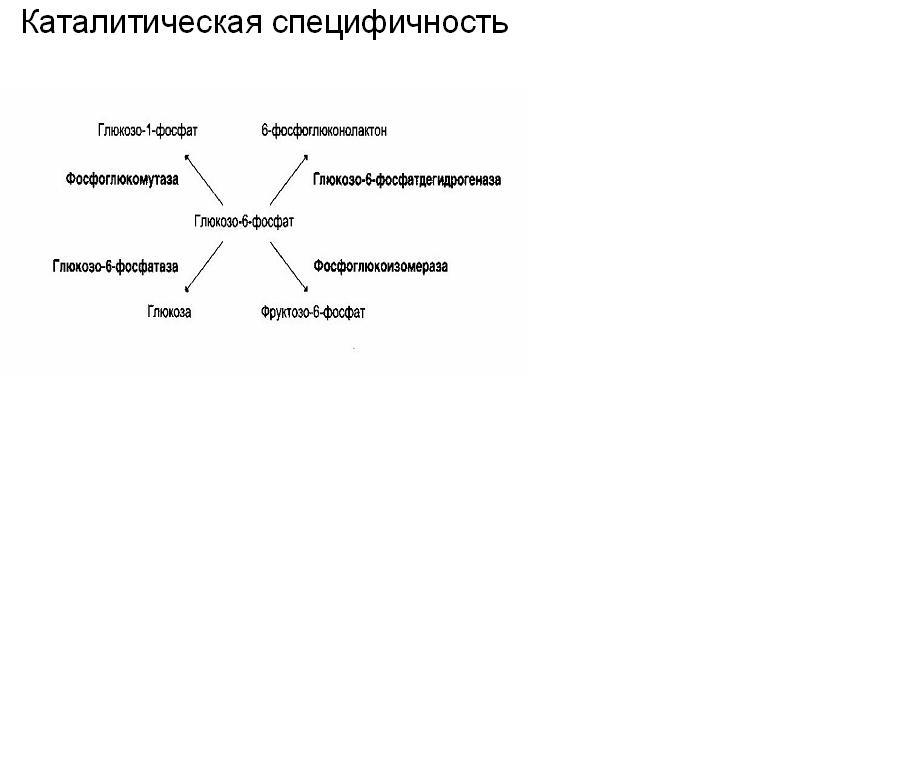
Субстратная специфичность 1. Абсолютная специфичность. Ей обладают ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты. Уреаза катализирует гидролиз мочевины.
Аргиназа расщепляет аргинин. Фумараза ускоряет гидратацию фумаровой кислоты. 2. Стереоспецифичность. Ей обладают ферменты, действующие на пространственные или стереоизомеры. Цис- и транс- изомеры; оптические изомеры. 3. Групповая специфичность. Ей обладают ферменты, которые катализируют однотипные реакции сходных по строению субстратов, т.е. эти субстраты могут содержать в своём составе одинаковые группы атомов.
Номенклатура ферментов Номенклатура ферментов. 1. Тривиальная номенклатура. Пример: пепсин, трипсин. 2. Рабочая номенклатура: название S + тип превращения + окончание «аза». пример: лактатдегидрогеназа. 3. Систематическая номенклатура. Название всех субстратов участвующих в реакции + название класса ферментов. L-лактат: НАД – оксидоредуктаза. 4. Каждый фермент имеет четырехзначный шифр 1.1.1.27 ЛДГ (обозначается класс, подкласс, подподкласс, порядковый номер фермента, соответственно) ?
Классификация ферментов
Классификация ферментов
В основе лежит тип катализируемой реакции Классы ферментов
Оксидоредуктазы Трансферазы Гидролазы Лиазы Изомеразы Синтетазы
?
Механизм действия ферментов Согласно современным представлениям при взаимодействии фермента с субстратом условно можно выделить 3 стадии: 1 стадия характеризуется диффузией субстрата к ферменту и их стерическимм взаимодействием с образованием фермент-субстратного комплекса. Эта стадия непродолжительна. Её скорость зависит от концентрации субстрата и скорости диффузии его к активному центру фермента. На этой стадии практически не происходит понижения энергии активации. Е + S > ЕS На второй стадии происходит преобразование Е-S комплекса в один, или несколько, активированных комплексов. Е + S > ЕS > ЕS*> ЕS** > ЕР Эта стадия является наиболее продолжительной по времени. При этом происходит разрыв связей в молекуле субстрата, образование новых связей, т.е. образуются продукты реакции. Энергия активации снижается значительно. На третьей стадии происходит освобождение продуктов реакции от фермента и поступление их в окружающую среду. ЕР > Е + Р
|
|||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 337; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |