Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ферменты и неорганические катализаторы
ПОНЯТИЕ О ФЕРМЕНТАХ. Ферменты - это биологические катализаторы в основном белковой природы. Роль ферментов в организме огромна. В каждой клетке организма находится до 10000 молекул ферментов, которые катализируют более 2000 различных химических реакций. Ферменты начинают своё каталитическое действие в ЖКТ, продолжают его в тканях, на этапе выведения и образования конечных продуктов. Энзимология (ферменты - энзимы) - раздел науки, изучающий ферменты. ОБЩИЕ ЧЕРТЫ ФЕРМЕНТОВ И НЕБИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ. 1. Повышают скорость реакции. 2. В реакциях они не расходуются. 3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом.
ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ ФЕРМЕНТОВ. 1.Ферменты обладают более высокой эффективностью действия (повышают скорость реакции в большее число раз, чем неорганические катализаторы). 2.Ферменты чувствительны к температуре (термолабильны) 3.Ферменты чувствительны к значениям рН среды. 4.Ферменты, в отличие от неорганических катализаторов, обладают высокой специфичностью действия. 5.Ферменты - это катализаторы с регулируемой активностью.
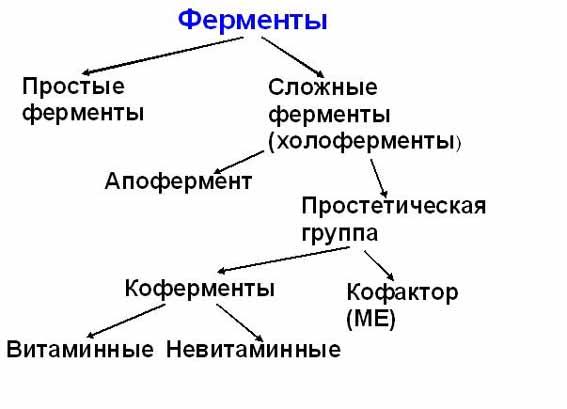
Строение ферментов Ферменты, являясь белками, повторяют все особенности структуры и состава белков (состоят из аминокислот, имеют 4 уровня структурной организации), физико-химические свойства белков. Ферменты, как и все функциональные белки, могут быть простыми и сложными. Простые ферменты представлены только белковой частью (состоят из аминокислот) - пепсин, трипсин, фосфатазы. Сложные ферменты представлены: 1.Белковой частью (состоит из аминокислот) - апофермент; 2.Небелковой частью. Небелковая часть может быть представлена: · ионами металлов (К, Na, Ca, Mg, Mn); · коферментами - низкомолекулярные органические вещества. Для многих ферментов его апофермент вместе с небелковой частью образуют каталитически активную молекулу, которая называется холоферментом.
В роли биокатализаторов могут выступать и небелковые соединения. Рибозимы - биокатализаторы, которые по химической природе являются РНК. Рибозимы катализируют разрыв фосфодиэфирных связей нуклеиновых кислот. В пространственной структуре фермента можно выделить отдельные участки, которые выполняют те или иные функции (активный центр, контактный участок, каталитический участок, аллостерический центр).
Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. Активный центр обычно располагается в гидрофобном углублении (недоступном для молекул воды), изолируя субстрат от воды. В образовании активного центра, участвуют боковые группы АК (12-20 АК), причём эти АК могут находиться на разных участках полипептидной цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы боковых цепей АК: – NH2 (арг, лиз); – СООН (асп, глу); – SH (цис); – ОН (сер, тре); – имидазольное кольцо (гис); – гуанидиновая группа (арг); – фенольное кольцо (тир). Остальные АК поддерживают пространственную конфигурацию активного центра фермента и обеспечивают его реакционную способность. Контактный (субстрат-связывающий) участок - это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту. Каталитический участок - место, где проходит сама каталитическая реакция. Аллостерический центр - участок в молекуле фермента, пространственно удаленный от активного центра. К аллостерическому центру могут присоединяться различные вещества, которые отличаются по структуре от молекул субстрата. Эти вещества называются аллостерические эффекторы. Они могут влиять на конформацию активного центра фермента, изменяя её, т.е. могут или повышать скорость реакции, или тормозить её.
рис. Активный центр фермента
?
Коферменты КОФЕРМЕНТЫ Коферменты – небелковая часть сложных ферментов. Их делят на две группы: 1.Витаминные. 2.Невитаминные. Витаминные коферменты: 1.Тиаминовые коферменты содержат в своём составе витамин В1 (тиамин). – ТДФ – тиаминдифосфат;
ТДФ связан с ферментами - декарбоксилазами альфа – кетокислот (входит в состав пируватдегидрогеназного и альфа-кетоглутаратдегидрогеназного комплексов); Является коферментом трансктолаз. 2.Флавиновые коферменты содержат в своём составе витамин В 2. – ФМН – флавинмононуклеотид; – ФАД - флавинадениндинуклеотид.
ФМН и ФАД связаны с ферментами дегидрогеназами. Участвуют в реакциях дегидрирования. 3. Пантотеновые коферменты содержат в своём составе витамин ВЗ (пантотеновая кислота). Представитель – кофермент А. Участвует в: 1. Переносе ацильных радикалов; 2. Активации жирных кислот; 3. Синтезе холестерола и кетоновых тел; 4. Обезвреживании ксенобиотиков. 4. Никотинамидные коферменты содержат в своём составе витамин РР (никотинамид). – НАД (никотинамидадениндинуклеотид); – НАДФ (никотинамидадениндинуклеотидфосфат). Кофермент могут быть в окисленной и восстановленной форме. НАД и НАДФ связаны с ферментами дегидрогеназами, которые ускоряют окислительно-восстановительные реакции.
5. Пиридоксиновые коферменты содержат в своём составе витамин В6. Кофермент – пиридоксальфосфат (ПФ). Участвует в реакциях превращения АК: 1.Реакции переаминирования (трансаминирование). Связан с ферментами аминотрансферазами. 2.Реакции декарбоксилирования аминокислот. НЕВИТАМИНЫЕ КОФЕРМЕНТЫ Не содержат в своём составе витаминов, но участвуют в каталитических превращениях. 1. Нуклеотиды: АТФ, ЦТФ (участвуют в синтезе фосфолипидов); УДФ, УТФ, ГТФ (участвуют в синтезе гликогена). 2. Производные порфирина: гем, цитохромы, каталаза. 3. Пептиды: Глутатион - трипептид, содержащий ГЛУ-ЦИС-ГЛИ. Он связан с ферментами оксидоредуктазами. Участвует в окислительно-восстановительных реакциях.
?
Свойства ферментов СВОЙСТВА ФЕРМЕНТОВ. 1.Высокая каталитическая активность. 2.Ферменты, являясь белками, проявляют термолабильные свойства - чувствительность к изменению температуры. При повышении температуры на каждые 10 градусов Цельсия, скорость ферментативных реакций повышает в 1,5 - 2 раза (правило Вант - Гоффа). Это правило применимо для ферментов в очень узком интервале температуры, т.к. уже при 50-60 градусах наблюдается денатурация, а при 100 градусов Цельсия - полная денатурация с потерей активности. При 1-3 градусов Цельсия Активность фермента также понижается, но при понижении температуры структура его сохраняется, поэтому при последующем повышении температуры активность восстанавливается. Это свойство используется в клинической практике при проведении оперативных вмешательств. Температура, при которой фермент проявляет максимальную активность, называется оптимальной.
3.Ферменты чувствительны к изменениям рН среды. Для большинства ферментов оптимальные значения РН лежат в нейтральной среде (для каталазы рН = 7). Есть ферменты, для которых оптимальные значения рН лежат в кислой среде (пепсин рН = 1,5-2,5). Некоторые ферменты проявляют активность в щелочной среде (аргиназа рН = 10 - 11). Изменения рН приводит к изменению степени ионизации кислых и основных групп в активном центре фермента, т.к. эти группы участвуют в связывании субстрата и его превращении. Изменение рН приводит к конформационной перестройке не только активного центра фермента, но и всей молекулы фермента. Это может сопровождаться нарушением третичной структуры фермента. При оптимальном значении рН функциональные группы активного центра находятся в наиболее реакционно-способном состоянии, и это обеспечивает образование фермент-субстратного комплекса.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 447; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.159.195 (0.013 с.) |