
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общее понятие об обмене веществ.Содержание книги
Поиск на нашем сайте
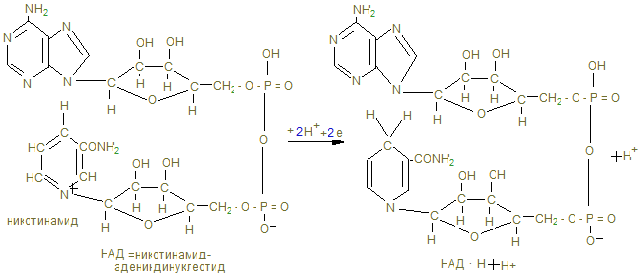
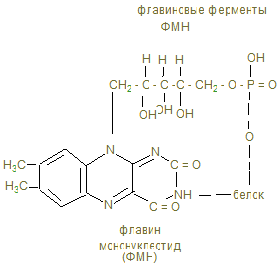
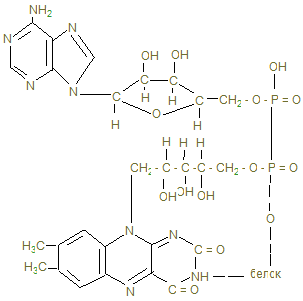
Общее понятие об обмене веществ. Биологическое окисление I. Цель изучения. Знать функции метаболизма в организме человека, иметь понятие об особенностях энергетического обмена в организме человека. Знать сущность окислительного фосфорилирования АДФ и биосинтеза АТФ, изучить токсичность кислорода и антиоксидантные системы. Знать сущность окислительного фосфорилирования АДФ и биосинтеза АТФ, изучить токсичность кислорода и антиоксидантные системы. II. Уметь определить каталазное число крови и его клинико-диагностическое значение. III. Ответить на контрольные вопросы к теме и заполнить контурные карты по структуре НАД-а и флавиновым ферментам (ФМН и ФАД).
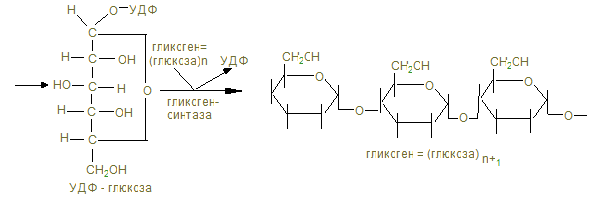
IV. Содержание темы. 1. Живые организмы находятся в неразрывной связи с окружающей средой, которая осуществляется в процессе обмена веществ и энергии (метаболизм). Функции метаболизма: снабжение организма энергией при расщеплении пищевых веществ – белков, жиров и углеводов в катаболических реакциях; использование энергии для синтеза молекул со специфическими функциями; образование и сборку строительных белков для формирования клеточных компонентов и обновления тканей (анаболические реакции). 2. Основная энергия в процессе метаболических реакций выделяется в реакциях окисления белков (1г – 17 кДж), углеводов (1г – 17 кДж) и жиров (1 г - 39 кДж) в норме употребляемым человеком в соответствии 1:4:1. Среднесуточное употребление этих веществ достаточно в количестве 80 г: 400г: 100г. 3. Замечательной особенностью живого организма является постепенное освобождение энергии химических связей пищевых веществ и накопление её в макроэргических связях (~), высокоэнергетических связях целого ряда метаболитов, например 1,3-дифосфоглицерата, фосфоенолпирувата, креатинфосфата. Центральное место в ряду макроэргических соединений занимает молекула аденозинтрифосфата (АТФ), которая содержит две макроэргические связи и при гидролизе её на АДФ+Н3РО4 уровень свободной энергии падает с выделением 30,51 кДж, а при гидролизе АТФ ® АМФ + Н4Р2О7 выделяется 37,4 кДж. Эта энергия используется нашим организмом для произведения механических работ, осмоса, передачи нервных импульсов, активации химических реакций. Частично энергия распада АТФ рассеивается в виде тепла. 4. Основной путь биосинтеза АТФ – окислительное фосфорилирование идет в митохондриях, где в матриксе происходит окисление промежуточных метаболитов - пирувата, глутамата, гидроксипроизводных жирных кислот в результате действия НАД – зависимых дегидрогеназ, где катаболитическим центром является витамин РР, способный присоединить гидрид-ион и восстанавливать кофермент до НАДН + Н+. 5. Во внутренней мембране митохондрий содержатся сложные белковые комплексы, содержащие ряд веществ, расположенных векторно с определенными редокс-потенциалами по мере их возрастания, переносящие электроны от субстрата вплоть до кислорода с общим изменением редокс-потенциала из I комплекса от - 0,32 в до + 0,82 в к кислороду. Эти комплексы переносят протоны (Н+) в межмембранное пространство, создавая в нем электрохимический потенциал ионов водорода DmН+. 6. I комплекс – НАДН-дегидрогеназа содержит в качестве кофермента флавинмононуклеотид (ФМН), содержащий рибофлавин (витамин В2), способный присоединить 2Н ковалентной связью от НАДН + Н+ и при помощи специальных железосерных белков (F2S2, Fe4S4) переносить Н+ в межмембранное пространство, а электроны (2ē - на низкомолекулярное липофильное вещество убихинон (Q), способное восстанавливаться до Q × H2, черпая Н+ из матрикса или из II комплекса. 7. Комплекс II – сукцинатдегидрогеназа расположена на границе с матриксом, дегидрирует субстраты с помощью кофермента флавинадениндинуклеотида (ФАД), который отщепляет 2Н от янтарной кислоты (сукцината), радикалов жирных кислот, глицерина и переносят 2Н+ и 2ē тоже на убихинон с образованием Q ×Н2. 8. Q ×Н2, способное к латеральной диффузии, перемещается к комплексу III. В составе комплекса III - Q ×Н2 –дегидрогеназы передает Н+ (протоны) в межмембранное пространство митохондрий, а 2 ē принимают цитохромы (в1, в2, с), которые являются трансэлектроназами, благодаря гемовому железу, способному менять степень окисления с Fe3+ + ē ® Fe2+. 9. IV комплекс-цитохромоксидаза содержит кроме цитохромов а1 а3, отличающихся своей белковой структурой и радикалами гемов, еще и атомы меди, способные иметь разную степень окисления и тоже способные переносить электроны уже на О + 2ē ® О- - в матрикс: Сu2+ + ē ® Cu+. Благодаря меди и помощи еще одной петли Q, IV комплекс обладает способностью также переносить протоны в межмембранное пространство и с другой стороны способствовать присоединению 2Н+ + О- - ® Н2О -конечного продукта окисления. 10. Между I и III комплексом благодаря разности потенциалов (-0,32в) I и III (~0,4в), а также между III и IV (+0,25в) и IV и О2 (+0,82в) возникает разность» 0,2 -0,3 в, что позволяет перемещаться электроном вдоль мембраны вплоть до кислорода в матриксе. С другой стороны благодаря переносу протонов в межмембранное пространство происходит его закисление, т.е. рН по сравнению с матриксом уменьшается на DрН = 1,4. 11. Большая разница в редокс-потенциалах приводит к падению уровня свободной энергии перемещающихся вдоль мембраны электронов и при переходе от I к III комплексу выделяется 51 кДж, от III к IV – 36 кДж, от IV к 02 – 44 кДж, что достаточно для формирования 3 АТФ и даже для рассеивания некоторого количества тепла. В этом состоит суть сопряжения окисления с биосинтезом АТФ (фосфорилированием АДФ). 12. Движущая сила биосинтеза АТФ обеспечивается созданием протонного потенциала в результате накопления протонов в межмембранном пространства, которые могут вернуться в матрикс только через канал F0 грибовидной АТФ-синтазы, где проходя через F0, 2Н+ отщепляют О- - от Н3РО4, переводя ее в супероксидное состояние 13. Принято считать, что если на субстрат действуют NАД-зависимые дегидрогеназы, протоны стимулируют синтез 3 АТФ, если ФАД-зависимые, то при прохождении электронов через 2 энергосоставляющих участка синтезируются 2 АТФ, а в случае действия оксидаз на уровне IV-го комплекса, возможен синтез только 1 АТФ. 14. Некоторые вещества могут переносить протоны из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ- синтазы. В результате этого исчезает электрохимический потенциал и хотя скорость окисления НАДН и ФАДН2 высока, синтез АТФ не идет и энергия выделяется в виде теплоты. Эти вещества – разобщители дыхания и фосфорилирования: динитрофенол, свободные жирные кислоты бурого жира, гормон тироксин. 15. Дыхательными ядами являются ингибиторы цепи переноса электронов (ЦПЭ), блокирующие определенные этапы этого процесса. Ингибиторы НАДН-дегидрогеназы – ротенон из яда рыб, амитол из группы барбитуратов, ингибитор QН2 –дегидрогеназы – антимицин А - токсичный антибиотик; ингибиторы цитохромоксидазы – цианид, СО, Н2S. Все они блокируют перенос электронов к кислороду. 16. Необходимый кислород для функционирования ЦПЭ может быть и токсичным, если произойдет утечка 1ē при неполном окислении кофермента Q + Н+ + 1ē ® QН¯. Тогда О2 может присоединить ē и превратится в супероксидный ион О2-. Постепенное восстановление О2 идет через ряд токсичных соединений 17. Свободнорадикальное окисление нарушает структуру, во-первых, сопряженной системы двойных связей жирных кислот клеточных мембран, азотистые основания нуклеиновых кислот, некоторые аминокислоты, что ведет к активации протеолитических ферментов, разрушающих поврежденные белки. Это причина многих патологий: болезнь Паркинсона, дистрофия мышц, атеросклероз, развитие опухолей, образование тромбов. 18. В нашем организме существует антиоксидантная система, защищающая клетки от радикального окисления. 1) Супероксиддисмутаза (СОД) превращает супероксидный ион О2¯ в пероксид водорода: О2¯ + 2Н+ ® Н2О2. Это предотвращает утечку электронов дыхательной цепи в митохондриях. 2) Каталаза, в больших количествах, содержащаяся в эритроцитах, переносящих кислород, разрушает пероксид водорода 2Н2О2 ® 2Н2О + О2. 3) Глутатионпероксидаза - важнейший фермент, разрушающий как пероксид водорода, так и гидроперекиси липидов с помощью глутатиона, содержащего тиоловую группу-SH (полную формулу см. в лекции «Структура белков»): 2G –SH + H2O2 ® 2 H2O + G –S – S – G. Глутатион восстанавливается глутатионредуктазой с коферментом НАДРН + Н+: G - S – S – G + NAДPH + H+ ® 2GSH + NAДР+. 4) Антиоксидантами могут быть многие витамины: Е, С, липоевая кислота, b-каротин, флавоноиды (vit. Р). 19. Витамин Е содержит - ОН, которая может отдать свой водород на ликвидацию пероксида липида (lОО°) сам же токоферол превращается в неактивную, стабильную форму токоферолхинона. 20. В фагоцитирующих лейкоцитах (гранулоцитах, макрофагах, эозинофилах) образуются активные формы кислорода, инициируя «респираторный взрыв», которые уничтожают чужеродные бактерии. При хроническом дефекте ферментов, образующих активные формы кислорода (в том числе и НО·), больные страдают повышенной восприимчивостью к бактериальной инфекции (грануломатоз). Обмен углеводов Переваривание углеводов. Анаэробный распад углеводов I. Цель изучения: Знать классификацию, строение, физико-химические свойства, биологические функции углеводов. Знать процессы переваривания пищевых углеводов, всасывание моносахаридов, химизм биосинтеза и распада гликогена, процесс анаэробного гликолиза, его биологическое значение, регуляцию гормонами, распада и биосинтеза гликогена. II. Уметь исследовать перевариваемость углеводов в желудочно - кишечном тракте. Провести обнаружение молочной кислоты и анаэробных дегидрогеназ в мышцах III. Заполнить контурные карты; 1) Распад гликогена в печени. 2) Биосинтез гликогена в печени. 3) Гликолиз в двух частях. IV. Содержание темы: 1. Важнейшие функции углеводов – энергетическая (1г – 4,1 ккал), метаболическая (промежуточные метаболиты используются для синтеза веществ других классов), строительная (межклеточный матрикс), защитная (в антителах), регуляторная (гормоны, группы крови). 2. Пищевыми углеводами являются крахмал, сахароза, лактоза, моносахариды. 3. Процесс переваривания начинается в ротовой полости амилолизом крахмала, который продолжается в двенадцатиперстной кишке. Дисахариды гидролизуются соответствующими дисахаридазами в тощей кишке до свободных моноз. 4. Всасывание моносахаридов из кишечника в кровь происходит: а) облегченной диффузией; б) вторичным активным транспортом с Nа+. 5. Потребление глюкозы клетками из кровотока происходит путем облегченной диффузии по градиенту концентрации. Транспортеры глюкозы (ГЛЮТ) обнаружены во всех тканях: ГЛЮТ – 1 обеспечивает поток глюкозы в мозг, ГЛЮТ – 2 транспортирует глюкозу в b - клетки поджелудочной железы, ГЛЮТ – 3 обеспечивает приток глюкозы к клеткам нервной ткани, ГЛЮТ – 5 встречается в клетках тонкого кишечника. Исключение составляют ГЛЮТ – 4, активируемые инсулином, которые переносят глюкозу в мышечную и жировую ткань. Нарушения их работы могут быть причиной инсулинонезависимого диабета. 6. Нарушения переваривания и всасывания углеводов связаны с нарушениями в первичной структуре соответствующих ферментов: a- амилазы, лактазы, сахаразы или белков переносчиков. 7. Всасываемые моносахариды в процессе метаболизма сливаются с общим обменом глюкозы – преобладающего продукта переваривания углеводов, содержание которого при нормальном рационе здорового человека составляет 3,3 – 5,5 ммоль/л крови. 8. Внутриклеточный обмен глюкозы начинается с ее фосфорилирования глюкокиназой в печени (Км = 10 ммоль/л) или гексокиназой в других тканях (Км<0,1 ммоль/л). Продукт реакции – глюкозо-6-фосфат образуются при затрате АТФ, которая активирует глюкозу, открывая несколько метаболических путей превращения глюкозы в гликоген, лактат, СО2 + Н2О, другие монозы. 9. Многие ткани (печень, мышцы и др.) могут создать резерв глюкозы в виде полисахарида гликогена в пищеварительный период через 1 – 2 часа после приема углеводной пищи. Для активации полуацетального гидроксила с целью образовать гликозидную связь, глюкоза-6-фосфат под действием фосфоглюкомутазы превращается в глюкозо-1-фосфат и после активации УТФ в УДФ-глюкозу, которая под действием гликогенсинтазы переносит глюкозный остаток на нередуцирующий конец гликогеновой затравки (праймера). Синтез гликогена в печени
10. «Ветвящий фактор» способствует переносу концевых блоков на внутренний остаток глюкозы с образованием a-1,6гликозидной связи. 11. В постабсорбтивном периоде в ответ на повышение потребности организма, гликоген распадается фосфоролитическим путем с образованием глюкозо-1-фосфата и превращающегося в глюкозо-6-фосфат и далее фрукто-6-фосфат и фруктозо-1-6-дифосфата.
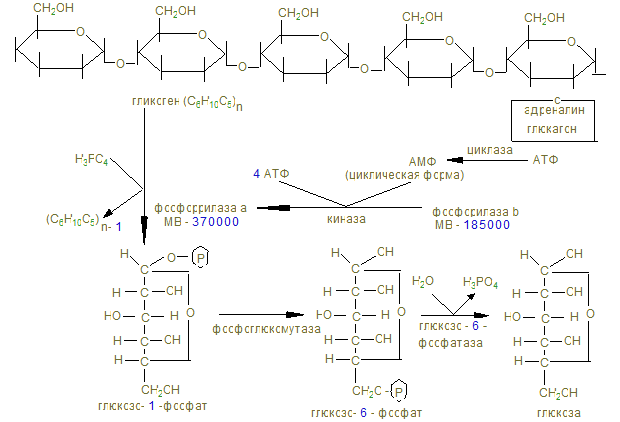
Распад гликогена в печени
Гликолиз
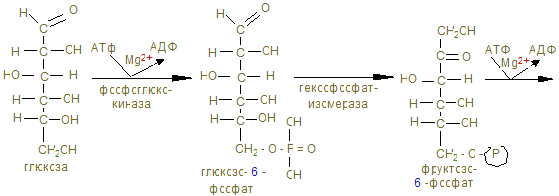
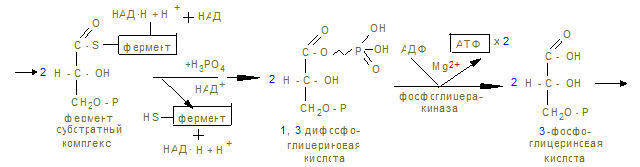
На этом заканчивается активация глюкозы, которая идет с затратой 1 (из гликогена) или 2 молекул АТФ (из свободной глюкозы). 12. Альдолаза расщепляет гексозу на две триозы с образованием 2-х молекул глицеринового альдегида, который окисляется дегидрогеназой в 3-фосфоглицерат. При этом в анаэробных условиях субстратным фосфорилированием образуется АТФ´2 (учитывая коэффициент 2). 13. В дальнейшем глицериновая кислота превращается в пируват с энергетическим выигрышем 2 молекулы АТФ.
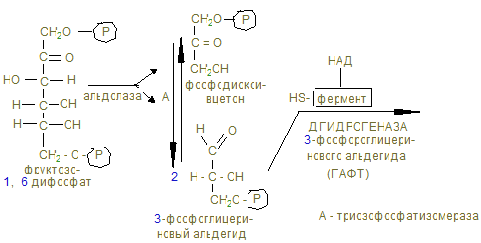
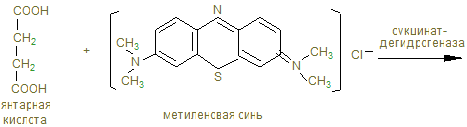
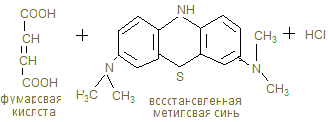
14. В анаэробных условиях восстановленный НАДН + Н+, образованный при окислении глицеринового альдегида восстанавливает ПВК в лактат. Это анаэробный гликолиз, обеспечивающий организм энергией при нехватке кислорода, в первую минуту мышечной работы. 15. Распад гликогена и его синтез одновременно в клетке не идет, а зависит от ритма питания и инсулин/глюкагон – индекса. При гипергликемии секретируется инсулин, активирующий фосфатазы, отщепляющие остатки фосфорной кислоты от гликогенсинтазы (активирует), и фосфорилазы (пассивирует). При снижении глюкозы в крови секретируется из a - клеток поджелудочной железы глюкагон, который по аденилат-циклазной системе фосфорилирует фосфорилазу, активируя ее и гликогенсинтазу, которая становится неактивной. 16. Гликогенозы и агликогенозы – проявления недостаточности распада или синтеза гликогена, как результат дефектов соответствующих ферментов. Лабораторная работа Открытие дегидрогеназы янтарной кислоты в мышцах Дегидрогеназа янтарной кислоты относится к анаэробным дегидрогеназам. Анаэробные дегидрогеназы переносят водород от окисляемого вещества на другое, но не кислород. В состав простейшей группировки дегидрогеназ нередко входят витамины. Дегидрогеназа янтарной кислоты окисляет янтарную кислоту в фумаровую при условии, что имеется соответствующий акцептор водорода. Акцептором водорода может быть метиленовая синь. Дегидрогеназа янтарной кислоты имеет название сукцинатдегидрогеназа.
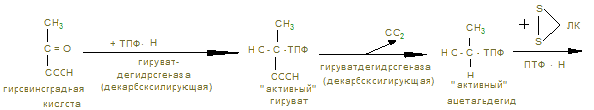
Ход работы. В 2 пробирки приливают по 1 мл дистиллированной воды и в каждую помещают по 100 мг мышечной кашицы, предварительно промытой водой. В первую пробирку приливают 2 мл 0,1 н раствора янтарной кислоты, во вторую – 2 мл дистиллированной воды. В каждую пробирку прибавляют по 2 мл 0,02% раствора метиленовой сини, перемешивают и заливают 3-5 капелями растительного масла. Обе пробирки помещают в термостат или водяную баню на 30 минут, после чего наблюдают окрашивание. Контрольные вопросы по теме 1. Определение углеводов. 2. Классификация углеводов. 3. Моносахариды. Определение. Напишите формулы: глюкозы, фруктозы, галактозы, маннозы, дезоксикарбозы. 4. Строение и биологическая роль производных моносахаридов: многоатомных спиртов, альдоновых и альдуроновых кислот, гликозидов, аминосахаридов, сернокислых и фосфорнокислых эфиров, дезоксисахаров. 5. Что такое гомо- и гетерополисахариды? Приведите примеры. 6. Дисахариды. Их биологическая роль. Напишите формулы сахарозы, лактозы, мальтозы. Укажите наличие восстановительных свойств. 7. Полисахариды. Определение. Изобразите фрагмент молекулы амилозы, амилопектина, гликогена, целлюлозы. Биологическая роль этих полисахаридов. 8. Перечислите углеводы, имеющие пищевое значение. 9. Назовите суточные нормы углеводов в питании. Отметьте возрастные особенности. 10. Какие ткани организма особенно остро нуждаются в углеводах как источнике энергии. 11. Назовите ферменты амилолитического действия. 12. Где на протяжении ЖКТ человека происходит переваривание углеводов? 13. Переваривание углеводов: в ротовой полости, кишечнике. 14. Напишите реакции катализируемые амилазой, лактазой, сахаразой, мальтазой. 15. Какой фермент разрывает 1,4 гликозидные связи? 1,6-гликозидные связи? 16. Как происходит всасывание продуктов переваривания углеводов? 17. Наследственные нарушения переваривания углеводов. 18. Что такое анаболизм, катаболизм и метаболизм углеводов. 19. Напишите реакции синтеза гликогена из глюкозы. 20. Напишите схемы основных этапов синтеза гликогена. 21. Объясните роль УТФ в процессе биосинтеза гликогена. 22. Какие органы и ткани наиболее богаты гликогеном и где его меньше всего? 23. Как происходит образование глюкозы из гликогена? Напишите уравнения реакции. Аэробный распад углеводов I. Цель изучения: Знать реакции окислительного декарбоксилирования пировиноградной кислоты до ацетил-КоА и его биологического окисления до СО2 и Н2О в цикле трикарбоновых кислот. Пентозофосфатный путь окисления глюкозы и его значение. II. Уметь провести количественное определение ПВК в моче для диагностики гипоксии. III. Заполнить контурные карты: 1) Окислительное декарбоксилирование пирувата. 2) Коферменты окислительного декарбоксилирования a-кетокислот. 3) Реакция цикла ди- и трикарбоновых кислот. 4) Реакции окислительной стадии пентозного цикла окисления глюкозы. IV. Ответить на контрольные вопросы (см. методичку определения ПВК). V. Содержание темы. 1. Пировиноградная кислота – промежуточный продукт анаэробного гликолиза, в аэробных условиях подвергается действию пируватдегидрогеназного мультиферментного комплекса в митохондриях эукариот.
2. В объединенном процессе дегидрирования и декарбоксилирования пирувата участвуют три фермента: пируватдегидрогеназа (декарбоксилирующая) с коферментами – ТПФ и липоевой кислотой; дигидролипоилацетилтрансфераза с коферментом А; дигидролипоилдегидрогеназа с коферментом ФАД, который через НАД открывает ЦПЭ внутренней мембраны митохондрий. Пентозный цикл I –cтадия – образование из 6 гексоз (глюкоз) → 6 пентоз
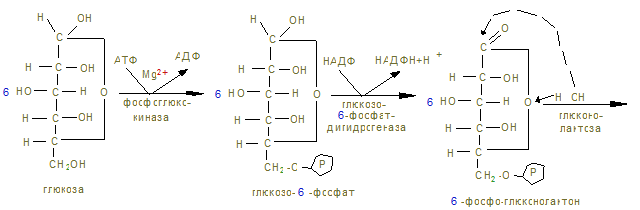
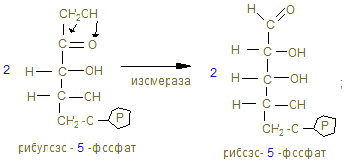
15. Процесс имеет циклический характер, т.к. при образовании 6СО2 образуется 6 пентоз, превращающихся в неокислительной (II фазе) в 5 молекул гексоз.
16. НАДФН+Н+ предотвращает гемолиз эритроцитов, восстанавливая затраченный глутатион в ликвидации Н2О2, могущей привести к нарушению мембран эритроцитов. 17. При генетическом дефекте глюкозо6-фосфатдегидрогеназы (дефектный ген особенно распространен в окружении Средиземного моря), количество НАДФН+Н+ уменьшается, ухудшается регенерация окислительного глутатиона, увеличивается количество активных форм О2. В этом случае – SН гемоглобина окисляются с образованием перекрестных дисульфидных связей и агрегации протомеров гемоглобина с образованием крупных телец Хайнца. Некоторые лекарства (антибиотики, анальгетики, антипиретики) при своем окислении образуют много Н2О2 и при недостаточности глюкозо-6-фосфатдегидрогеназы проявляется непереносимость их в виде развития гемолитической желтухи. Лабораторная работа Нарушения обмена углеводов Определение сахара крови I. Цель изучения: Контроль и закрепление теоретических и практических знаний по обмену углеводов. Помимо рассмотренных на предыдущих занятиях вопросов, знать – основные реакции синтеза глюкозы из неуглеводных предшественников (глюконеогенез), челночные механизмы переноса восстановленных эквивалентов в митохондрии, патологические состояния, связанные с нарушениями обмена углеводов. II. Уметь определить уровень сахара в крови и использовать состояние гипер- и гипогликемии как диагностический тест при ряде заболеваний, связанных с нарушением функции желез внутренней секреции, печени, почек и др. III. Ответить на контрольные вопросы к итоговой работе по теме «Обмен углеводов». IV. Содержание темы: 1. Глюконеогенез – процесс синтеза глюкозы из веществ неуглеводной природы. Синтез глюкозы de novo начинается, когда падает уровень глюкозы крови (N-3,3 – 5,5 ммоль/л) в случае использования запасов гликогена в период голодания, интенсивных физических нагрузок, гормональных нарушениях обмена глюкозы. 2. Процесс протекает в основном в печени, менее интенсивно в корковом веществе почек, в слизистой оболочке кишечника. Эти ткани могут обеспечить синтез глюкозы 80-100г в сутки, которая обеспечивает энергетические затраты мозга, эритроцитов, мозгового слоя надпочечников, где не обеспечивают энергией жирные кислоты (мозг) или недостаточен аэробный путь окисления (эритроциты, лишенные митохондрий). 3. Субстратами для глюконеогенеза являются: лактат – продукт анаэробного гликолиза, глицерол, образовавшийся при гидролизе жиров, аминокислоты – результат распада тканевых белков. 4. Большинство реакций глюконеогенеза протекает за счет обратимых реакций гликолиза (см. карточки 1 и 2), однако 3 реакции термодинамически необратимы: образование фосфоенолпирувата (ФЕП), фруктозо-6-фосфата и свободной глюкозы. Эти вещества образуются при действии других ферментов. 5. ФЕП из пирувата образуется в митохондрии, где карбоксилируется до оксалатацетата (ЩУК) витамином «Н» с использованием АТФ (1-я). Процесс идет под действием пируваткарбоксилазы, синтез которой индуцируется кортизолом (стероидным гормоном), активируещим глюконеогенез в печени. 6. Оксалоацитат не способен проходить через митохондриальную мембрану, поэтому восстанавливается в малат (см. реакции ЦТК), который возвращается в цитозоль, где снова окисляется НАД+-ом в ЩУК. В цитозоле под действием фосфоенолпируваткарбоксилазы с участием ГТФ«АТФ (2-я) оксалоацетат декарбоксилируется (-СО2) и превращается в ФЕП (фосфоенолпируват). 7. Следующие реакции превращения фосфоенолпирувата катализируются гликолитическими ферментами в обратном направлении через образование 1,3 дифосфосфоглицерата, где затрачивается опять молекула АТФ (3-я) вплоть до фруктозо1,6дифосфата. Здесь идет вторая необратимая реакция под действием фосфатазы с образованием фруктозо6-фосфата и изомерезацией в глюкозо-6 фосфат. Последняя необратимая реакция – потеря Н3PO4 и образование под действием глюкозо-6фосфатазы чистой глюкозы. 8. Т.о. для синтеза одного моля глюкозы используется 2 моля ПВК и 6 молей АТФ (3´2). 9. Лактат, образовавшийся при интенсивной мышечной работе, с кровью поступает в печень, где превратившись в пируват в результате глюконеогенеза превращаются в глюкозу, которая с кровью поступает в мышцы. Этот цикл – «глюкозно-лактатный» идет при любых состояниях, используется постоянно и называется Циклом Кори. 10. При длительной физической нагрузке, когда идет усиленный липолиз, глюконеогенез начинается с глицерина, который сразу преобразуется в глицериновый альдегид и далее через последние 2 необратимые реакции превращается в глюкозу. 11. При распаде тканевых белков до аминокислот, стероидные гормоны индуцирует синтез ферментов, превращающих аминокислоты в щавелевоуксусную кислоту, которая по вышеуказанному механизму, превращается в глюкозу. 12. Челночные механизмы переноса восстановленных эквивалентов в митохондрию существуют для утилизации НАДН+Н+ образованного в аэробном гликолизе при окислении глицеринового альдегида в цитозоле. Митохондриальная мембрана непроницаема для НАДН+Н+, поэтому в цитозоле восстанавливает фосфодигидроксиацетон в липофильный фосфоглицерин, проходящий через мембрану, а в митохондрии идет его окисление но не НАД+-ом, а ФАД-ом, поэтому в энергетическом выигрыше теряется 1 молекула АТФ, чего не происходит в сердечной мышце где работает не глицеро-фосфатный, а малат-аспартатный челнок, связанный с участием аспартата. Это будет рассмотрено в обмене аминокислот. 13. В результате нарушения переваривания углеводов (см. занятие 10), всасывания, патологии ферментов (см. занятие 11) гормональной регуляции, патологически изменяется уровень глюкозы крови, сопровождающейся гипер- или гипогликемией. 14. Гипергликемия возникает при: а) недостаточной продукции инсулина (инсулинзависимый диабет) или понижении его секреции, а также деффектости инсулиновых рецепторов, ускоренном разрушении инсулина (инсулин- независимый диабет) характеризующийся полидепсией, полиурией и полифагией. Поздние осложнения диабета будут рассмотрены в главе «Гормоны». б) при повышенной секреции соматропного гормона, аденокортикотропина, который стимулирует синтез кортикоидов. в) при гиперфункции щитовидной железы, усиливающий катаболизм гликогена. 15. Гипогликемия возникает при: а) передозировке инсулина или сульфанилмочевины, активирующей рецепторы инсулина; б) аденоме или карциноме островковых клеток, продуцирующих инсулин; в) нарушении всасывания сахаров и понижение сахарного порога в почках; г) гликогенозах; д) недостаточности надпочечников; д) голодании. 16. Гипоксия нарушает обмен углеводов, т.к. идет анаэробный распад глюкозы и накопление лактата, дефицит АТФ, нарушение работы, Na+- К+-АТФ-азы, кальциевой АТФ-азы, повышением перекисного окисления липидов, нарушением мембран и гибелью клеток. Глюкозооксидазным методом Принцип метода. Метод основан на специфичности действия фермента глюкозооксидазы. Этот фермент окисляет глюкозу в присутствии молекулярного кислорода с образованием глюконолактона, спонтанно гидролизирующегося до глюконовой кислоты. Глюкозооксидаза окисляет глюкозу с образованием пероксида водорода (Н2О2), который под действием пероксидазы реагирует с 4-аминоантипирином и фенолом. В результате образуется окрашенное в розовый цвет соединение, оптическая плотность которого при 510 нм пропорциональна концентрации глюкозы в образце. глюкоза +О2 +Н2О 2 Н2О2 + 4-аминоантипирин + фенол Оборудование: КФК, центрифуга, термостат, штативы, пробирки, пипетки, биологический материал, реактивы содержащиеся в рабочем растворе. Ход работы.
Пробирки инкубируют в термостате при 37оС 15 минут, затем колориметрируют на КФК при зелёном светофильтре в кюветах с толщиной слоя 5 мм против холостой пробы (Н2О). Розовая окраска устойчива в течение 1 часа после инкубации. Расчет содержания глюкозы производят по формуле: С= С – содержание глюкозы в опытной пробе, моль/л; Еоп – оптическая плотность пробы; Ест – оптическая плотность калибровочной пробы; С стандарт – содержание в калибровочном растворе, моль/л. Нормальные величины: · новорожденные – 2,8-4,4 ммоль/л · дети - 3,9 -5,8 ммоль/л · взрослые - 3,9 - 6,2 ммоль/л Клинико-диагностическое значение. Гипогликемия (ГГК). Повышение уровня глюкозы в крови обусловлено множеством причин, в соответствии с которыми различают две группы гипергликемии. 1. Инсулярные – связанные с недостаточным содержанием в организме инсулина или обусловленные неэффективностью его действия. 2. Экстраинсулярные (внеинсулярные) – не зависят от влияния инсулина. Наиболее существенное значение в формировании ГГК имеют следующие процессы: усиленный распад гликогена; повышенный неоглюкогенез; торможение синтеза гликогена; снижение утилизации глюкозы тканями под влиянием гормональных антагонистов инсулина: соматотропина, глюкортикоидов, тироксина, тиреотропина. Алиментарные гипергликемии отмечают при избыточном поступлении глюкозы в кровь (например, гипергликемия при сахарной нагрузке). «Печеночные» гипергликемии встречаются при диффузных поражениях печени. Стойкая и выраженная гипергликемия чаще всего сопровождает сахарный диабет. Принято выделять инсулинзависимый сахарный диабет и инсулиннезависимый сахарный диабет, или, соответственно, сахарный диабет I типа и сахарный диабет II типа. Формирование сахарного диабета I типа связано, прежде всего, с нарушениями синтеза и обмена инсулина. Вторая группа гипергликемий связана, прежде всего, с гиперфункцией эндокринных желез, продуцирующих гормоны – антагонисты инсулина. Она наблюдается при таких заболеваниях, как синдром и болезнь Иценко-Кушинга, акромегалия, тиреотоксикоз, феохромоцитома, глюкоганома. Уровень глюкозы в крови повышается и при некоторых заболеваниях печени (в частности, у 10-30% больных циррозом печени), гемохроматозе (пигментном циррозе печени, бронзовом диабете). Гипогликемия (ГПГ) - снижение содержания глюкозы в крови – чаще всего связана с абсолютным или относительным повышением уровня инсулина в крови. Внепанкреатическая гипогликемия отмечается в результате нарушения баланса между выраженностью процессов гликогенолиза и гликонеогенеза в печени при острых и хронических гепатитах, циррозах, острой и подострой дистрофии печени, алкогольной интоксикации, отравлениях мышьяком, фосфором, при длительной механической желтухе, застойной печени, первичном или метастатическом раке печени. Снижение концентрации глюкозы в крови часто наблюдается у больных, страдающих раком пищевода и другими злокачественными опухолями внепанкреатической локализации (фиброма, фибросаркома, нейрома), а также при неукротимой рвоте, анорексии, печеночном диабете, уремии, обильной лактации и глюкозурии у беременных. Гипогликемия может быть центрального происхождения вследствие перенесенных психических травм, энцефалита, субарахноидального кровоизлияния, опухоли мозга. Контрольные вопросы 1. Наследственные нарушения переваривания углеводов. 2. Какие виды гиперглюкоземии вам известны? 3. Каковы причины патологической гиперглюкоземии? 4. В чем причина возникновения инсулинзависимого сахарного диабета? 5. Каковы биохимические причины возникновения наследственных заболеваний: а)гликогенозов? б)агликогенозов? в)фруктоземии? г)галактоземии? 6. Каковы биохимические изменения углеводного обмена при голодании? 7. Принцип метода определения толерантности к глюкозе.
Обмен жиров Цель изучения: I. Знать классификацию, строение, физико–химические свойства, биологические функции жиров. Знать процессы переваривания и всасывания жиров, реакции β-окисления и биосинтеза жирных кислот, образование и использование кетоновых тел, регуляцию биосинтеза и распада жиров. II. Уметь определять содержание триглицеридов в сыворотке крови и обнаружить кетоновые тела в биологических жидкостях. III. Заполнить контурные карты: 1) Важнейшие жирные кислоты. Насыщенные жирные кислоты Общая формула насыщенных кислот СnН2n+1COOH Пальмитиновая: С15Н31СООН или СН3(СН2)14СООН Стеариновая: С17Н35СООН или СН3(СН2)16СООН Ненасыщенные жирные кислоты Производные стеариновой кислоты: олеиновая, линолевая, линоленовая. Олеиновая(с одной двойной связью С17Н33СООН или СН3 – (СН2)7 – СН = СН – (СН2)7- СООН Линолевая (с двумя двойными связями С17Н31СООН или СН3 – (СН2)4 – СН = СН – СН2 – СН = СН - (СН2)7- СООН Линоленовая (с тремя двойными связями С17Н29СООН или
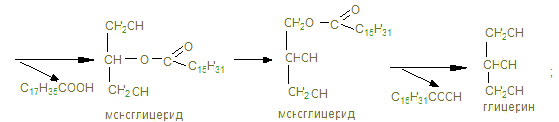
2) Гидролиз триглицеридов.
+ R –COOH Жирные кислоты: С17Н35СООН стеариновая; С15Н31СООН пальмитиновая; С17Н29СООН линоленовая.
3) Распад глицерина.
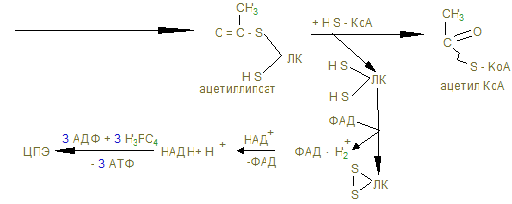
4) β-окисление жирных кислот.
5) Биосинтез жирных кислот. 1.
2.
|

 , а она атакуя АДФ в «шляпке гриба» F1-частицы синтезирует молекулу АТФ.
, а она атакуя АДФ в «шляпке гриба» F1-частицы синтезирует молекулу АТФ. , среди них наиболее токсичен ×ОН, который образуется из Н2О2 при встрече с Fe2+ (например, гем) Fe2+ + H2O2 ® Fe3+ + OH¯ + OH·.
, среди них наиболее токсичен ×ОН, который образуется из Н2О2 при встрече с Fe2+ (например, гем) Fe2+ + H2O2 ® Fe3+ + OH¯ + OH·.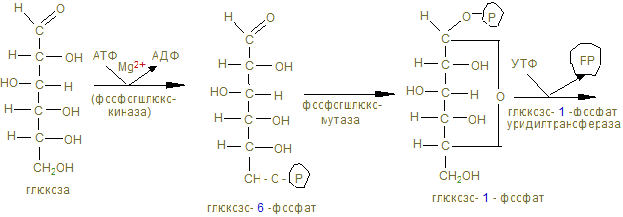
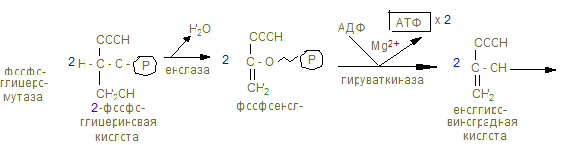



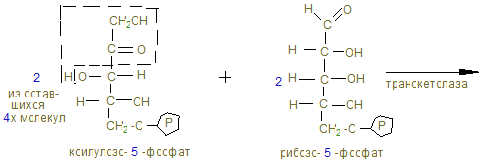




 → глюконовая кислота + Н2О2
→ глюконовая кислота + Н2О2 → хинонимин + 4Н2О
→ хинонимин + 4Н2О х С стандарт, где
х С стандарт, где 9-10):
9-10):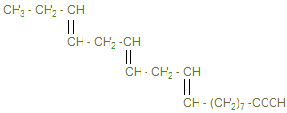



 дегидроацил-КоА β-оксиацил-КоА β-кетоацил-КоА
дегидроацил-КоА β-оксиацил-КоА β-кетоацил-КоА




