
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оптические методы исследования коллоидных растворов
На явлении рассеяния света коллоидными частицами основан ряд важнейших методов их исследования. Ультрамикроскопия. При использовании видимого света обычный микроскоп позволяет рассмотреть частицы размером не менее 200 нм. Ультрамикроскоп увеличивает в то же количество раз, что и обычный, но разрешающая способность его составляет 3 нм, что достигается наблюдением света, рассеянного отдельными частицами. При применении бокового освещения свет не попадает в объектив микроскопа и в глаз наблюдателя, фон поля зрения остается темным. На темном фоне становится заметным слабый свет, рассеиваемый коллоидными частицами. Они представляются наблюдателю в виде отдельных светящихся точек. Размер и форма частиц дисперсной фазы могут быть определены косвенным путем. Для этого подсчитываю число частиц n в определенном объеме раствора V 0 и находят частичную концентрацию: ν ч = n / V 0. Другим методом (например, измеряя оптическую плотность коллоидного раствора) определяют массовую концентрацию, которая связана с частичной концентрацией уравнением:
Находим объем частицы, а, зная объем, можно найти радиус частицы:
Метод ультрамикроскопии позволяет исследовать коллоидные растворы с размером частиц дисперсной фазы 2-3 нм. Электронная микроскопия. В электронном микроскопе вместо световых лучей применяются пучки электронов с длиной волны всего 0,002 – 0,005 нм, что резко увеличивает его разрешающую способность и дает возможность непосредственно видеть и фотографировать коллоидные частицы. Внутри электронного микроскопа поддерживается глубокий вакуум. Поэтому образцы исследуемых материалов должны быть тщательно высушены, что может приводить к существенным изменениям свойств изучаемых систем. Это является недостатком метода. Раздел VI. молекулярно-кинетические свойства Дисперсных систем Молекулярно-кинетические свойства обусловлены хаотическим тепловым движением частиц и проявляются в броуновском движении, диффузии и осмосе. Все молекулярно-кинетические свойства наиболее ярко выражены у высокодисперсных систем. Броуновское движение Броуновским движением называют хаотическое равновероятное для всех направлений движение мелких частиц, взвешенных в жидкости или газе за счет воздействия молекул дисперсионной среды.
Броуновское движение обусловлено столкновениями молекул среды, находящимися в непрерывном тепловом движении с взвешенными в ней частицами микроскопических или коллоидных размеров. Количественной характеристикой броуновского движения является средний сдвиг частицы
где k – константа Больцмана; Т – температура; μ – вязкость дисперсионной среды; r – радиус частиц. Из уравнения следует, что броуновское движение тем интенсивнее, чем выше температура и чем меньше масса частицы и вязкость дисперсионной среды. Средний сдвиг частиц коллоидных растворов, размер которых находится в пределах 1-100 нм может достигать нескольких миллиметров. Диффузия Диффузия – самопроизвольное распространение вещества из области с большей концентрацией в область с меньшей концентрацией. В случае коллоидных растворов идет диффузия частиц дисперсной фазы. Процесс диффузии является необратимым и протекает до полного выравнивания концентраций. Для количественного описания диффузии применяют закон Фика:
где m – количество продиффундировавшего вещества; D – коэффициент диффузии; dc/dx – градиент концентрации; S – площадь поперечного сечения, через которое проходит диффузия; τ – время диффузии. Так как масса диффундирующего вещества положительна, а градиент концентрации отрицателен, перед правой частью уравнения стоит знак «–». Физический смысл коэффициента диффузии: это количество вещества, диффундирующего через единицу площади в единицу времени при градиенте концентрации, равном единице. Согласно формуле Эйнштейна коэффициент диффузии равен:
Коллоидные частицы характеризуются минимальным по сравнению с ионами и молекулами коэффициентом диффузии. Процесс диффузии применяется в пищевой промышленности при извлечении сахара из сахарной свеклы. Осмос При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от раствора с меньшей концентрацией к раствору с большей концентрацией, приводящий к выравниванию концентраций (рис. 49). Этот процесс называется осмосом.
Осмотическое давление – это избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану. Для расчета осмотического давления коллоидных растворов применяется уравнение:
где νч – численная концентрация частиц. Осмотическое давление коллоидных растворов намного меньше осмотического давления истинных растворов, так как при одной и той же весовой концентрации численная концентрация коллоидного раствора всегда меньше истинного раствора. Раздел VII. Виды дисперсных систем
|
||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 583; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.216.36 (0.006 с.) |
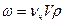
 ;
; .
. за время τ, т.е. отрезок прямой, соединяющий начальную точку движения (при τ = 0) с положением частицы в момент времени τ:
за время τ, т.е. отрезок прямой, соединяющий начальную точку движения (при τ = 0) с положением частицы в момент времени τ: ,
, ,
,
 Осмос характерен не только для истинных растворов, но и для коллоидных растворов. Молекулы растворителя переходят через полупроницаемую мембрану в сосуд с коллоидным раствором. В результате в нем создается избыточное давление π, называемое осмотическим.
Осмос характерен не только для истинных растворов, но и для коллоидных растворов. Молекулы растворителя переходят через полупроницаемую мембрану в сосуд с коллоидным раствором. В результате в нем создается избыточное давление π, называемое осмотическим. ,
,


