Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Схема синтеза белка на рибосомах⇐ ПредыдущаяСтр 15 из 15
Трансляцией (от слова «перевод») называется синтез полипептидных цепей белка по матрице иРНК. Синтез иРНК, которая несет к рибосомам сведенья о первичной структуре белка, происходит в ядре клеток. Затем иРНК, пройдя через поры ядерной оболочки, направляется к рибосомам, где и происходит расшифровка генетической информации (перевод с языка нуклеотидов на язык аминокислот). Функция рибосомы заключается в том, чтобы удержать в нужном положении иРНК и комплекс тРНК с аминокислотой до тех пор, пока между соседними аминокислотами не образуется пептидная связь. При этом малая часть рибосомы фиксирует положение иРНК и тРНК, а большая – катализирует образование пептидной связи. Таким образом, на рибосоме имеются 3 различных участка: один для иРНК и два – для тРНК. Из двух последних один участок донорный Р-участок (пептидил-тРНК-связывающий), который держит молекулу тРНК, присоединенную к растущему концу полипептидной цепи, а другой – акцепторный А-участок (аминоацил-тРНК-связывающий), с которым соединяется только что прибывшая тРНК с аминокислотой. Как и в других реакциях полимеризации, протекающих по цепному механизму, в биосинтезе белков можно выделить три стадии: инициирование, рост цепи и обрыв цепи. Как показывает генетический код, существует только один кодон инициирования AUG, кодирующий начало полипептидной цепи с метионина. начала цепи. Цепь начинается не с самого начала иРНК, а после какого-то участка переменной длины, потому что инициирующий кодон часто кодирует реакцию не со свободным метионином, а с формил-метионином, специально этерифицированным для инициирования иРНК, которая несет антикодон. Интересно, что аминогруппа метонина, которая становится N-концевой группой белка, защищена в виде амида так же, как защищается аминогруппа от вступления в реакцию, если эта реакция проводится в пробирке. Таким образом, на стадии инициирования иРНК, N-формилметионил-тРНК и рибосома связываются между собой. Это происходит в следующей последовательности: сначала иРНК, выйдя в цитозоль, прикрепляется к малой субчастице рибосомы с помощью ионов магния; затем к ней, к ее стартовому кодону АUG присоединяется первая (инициаторная) тРНК, несущая метионин, и только после этого к ним присоединяется большая субъединица рибосомы, на которой теперь может идти синтез белка (для включения метионина во внутренние участки полипептидной цепи используются другие тРНК).
Поскольку рост белковой молекулы – это процесс удлинения (элонгации) белковой цепи за счет образования пептидных связей между аминокислотами, то эта реакция должна повторяться столько раз, сколько аминокислотных остатков входит в состав белковой молекулы. Таким образом, синтез любого белка, то есть стадию роста цепи, можно представить в виде циклов, каждый из которых делят на три этапа: 1) Присоединение комплекса «аа-тРНК» к свободному участку рибосомы (А-участок) за счет спаривания оснований антикодона тРНК с основаниями кодона иРНК. 2) Образование пептидной связи между С-концом (карбоксильной группой) полипептидной цепи и аминогруппой аминокислоты, присоединенной к молекуле тРНК, находящейся на А-участке. 3) Передвижение рибосомы вдоль молекулы иРНК на три нуклеотида в направлении 51 – 31. Этот процесс называется транслокацией, при котором тРНК, к которой теперь присоединен растущий белок перемещается вместе с кодоном иРНК в донорный участок (Р-участок), освобождая тРНК-1 и акцепторный участок для новой тРНК-2. На новую тРНК-2, связанную с аминокислотой, которая шифруется очередным кодоном на иРНК, переносится с донорного участка оторвавшаяся полипептидная цепь, которая удлиняется еще на одно звено. Каждая новая аминокислота, входя в цепь, присоединяется к С-концу белковой цепи. Этим биосинтез белков отличается от синтеза белков в лаборатории, когда белковая цепь удлиняется по N-концевой группе. Обрыв цепи в реакции синтеза белка происходит в тот момент, когда в него включаются один из трех терминирующих кодонов. Это своеобразный знак препинания между генами. Дело в том, что не существует антикодонов, комплементарных нуклеотидам знаков препинания. Полипептидная цепь, оторвавшаяся в донорном участке, в этом случае уже ни к чему не присоединяется в акцепторном участке и покидает рибосому. Затем этерифицированная на конце длинная белковая цепь гидролизуется до кислоты, а инициирующий N-формилметионин удаляется. Рибосомы, иРНК и Трнк диссоциируют и готовы вновь соединиться для нового синтеза. Высокая слаженность всех «служб комбината» по по производству белков позволяет в течение нескольких секунд синтезировать полипептидные цепи, состоящие из сотен аминокислот.
Для увеличения производства белков иРНК часто присоединяется не к одной, а к нескольким рибосомам. Такая структура – одна иРНК и несколько рибосом – называется полисомой. На каждой рибосоме этом, похожем на нитку бус конвейере, синтезируются одинаковые белки. Итак, весь процесс трансляции (синтеза полипептидной цепи на иРНК) можно разделить на следующие этапы: 1) Присоединение иРНК к рибосоме. 2) Активация аминокислоты и присоединение ее к тРНК с образованием комплекса (аминоацил-тРНК). 3) Транспорт этого комплекса к рибосоме и инициация синтеза полипептидной цепи. 4) Удлинение (элонгация) полипептидной цепи. 5) Окончание роста полипептидной цепи (терминация) и освобождение белковой молекулы от рибосомы.
Биосинтез углеводов
Биосинтез глюкозы (глюконеогенез) – это синтез глюкозы из веществ не углеводной природы − аминокислот, лактата, пирувата, субстратов цикла Кребса и глицерина. Гликонеогенез обеспечивает потребность организма в глюкозе в тех случаях, когда нехватка в глюкозе не компенсируется гликогеном печени. Ниже рассмотрен процесс образования глюкозы из пирувата, так как в него легко превращается такая аминокислота как аланин, а также молочная кислота, которая поступает в значительных количествах в кровь из мышц после физической нагрузки, и в печени она под действием лактатдегидрогеназы превращается в пируват:
О Пируват в печени частично окисляется, а частично превращается в глюкозу (цикл Кори) или глюкозно-лактатный цикл.

Глюконеогенез в основном протекает по такому же пути, что и гликолиз, но в обратном направлении. Однако, поскольку 3 реакции гликолиза необратимы −стадии I, II, III (схема), то на этих стадиях реакции гликонеогенеза отличаются от реакций гликолиза По сравнению с гликолизом процесс гликонеогенеза имеет 3 обходных пути. Необратимая стадия III - превращение пирувата в фосфоенолпируват существляется в 2 стадии.через промежуточное образование оксалоацетата (ЩУК). Стадия «а» происходит при участии фермента пируваткарбоксилазы, а стадия «б» − карбоксикиназы:
COOH COOH
CH3 CH2
COOH
COOH COOH
COOH
Две другие необратимые стадии (II, I) –реакции 14, 15, представляют собой реакции гидролиза, которые катализируются фосфатазой фруктозо-1,6- дифосфата и фосфатазой глюкозо-6-фосфата, ведут к высвобождению фосфорной кислоты и образованию глюкозы: фруктозо-1,6- дифосфат + Н2О→ фруктозо-6- фосфат + Н3РО4 глюкозо-6-фосфат + Н2О→ глюкоза + Н3РО4 На каждую молекулу лактата при глюконеогенезе расходуется 3 молекулы АТФ (точнее две молекулы АТФ и одна ГТФ), и поскольку для образования глюкозы (С6) необходимо 2 молекулы лактата (С3), то суммарный процесс глюконеогенеза можно записать таким образом:
2 лактата + 6 АТФ + 6Н2О → глюкоза + 6 АДФ + 6 Н3РО4
Образовавшаяся глюкоза может вновь поступать в мышцы и там превращаться в молочную кислоту. Если записать в общем виде реакцию гликолиза:
глюкоза + 2 АДФ + 2 Н3РО4 → 2 лактата + 2 АТФ + 2 Н2О
и сопоставить эту реакцию с реакцией глюконеогенеза, то видно, что в результате цикла Кори работающие мышцы добывают 2 молекулы АТФ за счёт расходования 6 молекул АТФ в печени. Вся имеющаяся в организме глюкоза, как поступающая в пищу, так и синтезирующиеся внутри организма, в конечном итоге окисляется до СО2 и Н2О аэробным путём. Анаэробный распад служит вспомогательным путём использования энергии глюкозы, имеющим либо локальное (например, в эритроцитах) или временное ситуационное (в работающей мышце) значение; и продукт анаэробного распада − молочная кислота − в конечном итоге тоже может окислятся аэробным путём. В организме человека за сутки может синтезироваться около 80г глюкозы, главным образом в печени, а также в корковом веществе почек и слизистой оболочке кишечника. Биологическое значение гликонеогенеза заключается не только в возвращении лактата в метаболический фонд углеводов, но и в обеспечение глюкозой мозга при недостатке углеводов в организме.
Биосинтез гликогена
Значительная часть глюкозы, поступающей в клетки при пищеварении превращается в гликоген – животный крахмал −запасной полисахарид, который используется в интервалах между приёмами пищи. Он сходен по строению с крахмалом. Непосредственным донором глюкозных остатков при синтезе гликогена служит уридиндифосфатглюкоза (УДФ-глюкоза)−продукт взаимодействия глюкозо-1-фосфата и УТФ.

При синтезе гликогена роль акцептора глюкозных остатков выполняют олигосахариды из 2-х и более глюкозных остатков, связанные 1,4-гликозидной связью, или уже имеющиеся молекулы гликогена:
Реакцию катализирует гликогенсинтетаза, при этом образуются 1,4-гликозидные связи в линейных участках молекулы гликоген. Ответвления возникают в результате действия фермента ветвления (амило-1,4-1,6-гликозилтрансферазы). Этот фермент переносит фрагмент из пяти-семи мономеров с конца линейного участка ближе к его середине, который присоединяется 1,6-гликозидной связью. Затем оба конца удлиняются при участии гликогенсинтазы, и на них вновь возникают ветвления.
Таким путем синтезируются огромные молекулы с молекулярной массой от 1млн до 200млн, содержащие до 1 млн глюкозных остатков. В клетке гликоген находится не в растворённом состоянии, а в виде гранул диаметром 40- 200 нм, включающих одну или несколько молекул. Необходимость превращения глюкозы в гликоген при запасании энергетического материала обусловлено тем, что накопление легко растворимой глюкозы в клетках могло бы привести к осмотическому шоку и разрушению клеточной мембраны. Запасание гликогена связано с расходом 2-х молекул АТФ на каждую молекулу глюкозы, которая включается в гликоген.
  Глюкозо-1-фосфат Глюкозо-1-фосфат
Гликоген образуется практически во всех клетках организма, однако наибольшая концентрация обнаруживается в печени − от 2 до 6 % и в мышцах − от 0,5 до 2 %. Поскольку общая масса мышц велика, больше всего по массе гликогена содержится в мышцах. Глюкоза, которая депонирована в форме гликогена, освобождается при помощи фермента гликогенфосфорилазы. Голодание в течениеи24 часов приводит к почти полному исчезновению гликогена в клетках печени. Однако при ритмичном питании каждая молекула гликогена может существовать неопределенно много времени.
Биосинтез жиров
Включает в себя биосинтез жирных кислот и триацилглицеридов (собственно, жиров). Биосинтез жирных кислот. Биосинтез жирных кислот происходит при высокой концентрации глюкозы в крови в основном в печени и в жировой ткани. В этот период активируется гликолиз, в результате которого образуются субстраты для синтеза жирных кислот: ацетил КоА, АТФ, (НАДФ·Н + Н+) и другие. Основным строительным блоком для биосинтеза жирных кислот служит ацетил КоА, а главным конечным продуктом является пальмитиновая кислота С15Н31СООН. Другие жирные кислоты образуются, как правило, путём модификации молекулы пальмитиновой кислоты – наращиванием цепи и дегидрированием. В последнем случае образуются непредельные кислоты. Синтез пальмитиновой кислоты происходит не в митохондриях, где происходит катаболизм жирных кислот, а в цитозоле. Основным ферментом этого биосинтеза служит мультиферментный комплекс пальметилсинтетаза. Так как мембрана митохондрии непроницаема для ацетил КоА, то начальным этапом биосинтеза является перенос ацетил КоА через митохондриальную мембрану с помощью цитратпируватного челночного механизма. Известно, что первой реакцией цикла Кребса является конденсация ацетил КоА с щавелевоуксусной кислотой (оксалоацетатом) с образованием цитрата (лимонной кислоты). Часть образовавшихся цитрат-ионов не вовлекается в дальнейшие реакции цикла Кребса, а переносятся через митохондриальную мембрану в цитозоль, где в присутствии цитратлиазы и при участии АТФ и HS-KoA вновь образует ацетил-КоА и ЩУК:
Цитрат + HS-KoA + АТФ → Оксалоацетат + Ацетил-КоА + АДФ + Н3РО4
Возвращение оксалоацетата в митохондрии осуществляется с помощью двух посредников − малата и пирувата Восстановление оксалоацетата в малат в цитозоле является частью малатаспартатного челночного механизма переноса восстановленного (НАД∙Н + Н+) из цитозоля в митохондрии: Оксалоацетат + НАД∙Н + Н+ ↔ Малат + НАД
Однако образовавшийся малат не переносится с\через мембрану, а сразу окисляется с одновременным декарбоксилированием в пируват:
Малат + НАДФ+ → Пируват + СО2 + НАДФ∙Н + Н+
Все описанные превращения изображены на схеме:
Таким образом, перенос одной молекулы ацетил КоА из митохондрии в цитозоль сопровождается образованием одной молекулы восстановленной формы (НАДФ·Н + Н+), который необходим для многих биосинтезов, а пируват, который дифундирует в митохондрии, затем карбоксилируется с образованием оксалоацетата.
Собственно синтез пальмитиновой кислоты начинается с карбоксилирования ацетил КоА. Эта реакция протекает в присутствии фермента, простетической группой которого является биотин:
Эта реакция является ключевой в синтезе жирных кислот. Дальнейшие превращения объединяются в циклы по шесть реакций, и в результате завершения каждого цикла углеродная цепь будущей молекулы удлиняется на два углеродных атома. Рассмотрим реакции, протекающие в первом цикле синтеза жирных кислот. В первых двух реакциях происходит перенос ацетильного и малонильного фрагментов на ацилпереносящий белок (АПБ). АПБ представляет собой полипептидную цепь, состоящую из 77 аминокислотных остатков и бокового ответвления, повторяющую по существу структуру кофермента А:
Реакции переноса ацетильного и малонильного фрагментов с ацетил-КоА (1) и малонил-КоА (2) катализируются ацилтрансферазами. 3-ья реакция состоит в образовании ацетоацетил-АПБ из ацетил-АПБ и маонил-АПБ с одновременным декарбоксилированием.
В дальнейшем в три этапа (реакции 4-6) происходит восстановление образовавшегося ацетоацетил-АПБ. В ходе 4-ой реакции одна из двух карбонильных групп восстанавливается до гидроксильной и образуется дегидроксибутерил-АПБ. Эта реакция является НАДФ–зависимой, т.е. восстановителем служит восстановленная форма НАДФ:
5-ая реакции - реакция дегидратации, ферментом этой реакции является гидроксиацил-АПБ-дегидратаза:
Следующая реакция восстановления (6) – реакция гидрирования – также требует участия НАДФ∙Н + Н+. Катализируется она еноил-АПБ-редуктазой, продуктом реакции являетотся бутирилАПБ:
Все реакции цикла элонгации (удлинения) цепи жирных кислот катализируются мультиферментным комплексом. Он состоит из двух полипептидных цепей. Одна из них (субъединица А) включает АПБ, оксоацил-АПБ-синтазу и оксоацил-редуктазу. В составе субъединицы Б находятся 4 других фермента. Согласованная работа мультиферментного комплекса обусловлена наличием в молекуле АПБ большого рычага – гибкой и достаточно длинной цепочки атомов, соединяющей «якорную» HS-группу с полипептидной цепью Синтез пальмитиновой кислоты включает 7 циклов. Во второй цикл вместо ацетил-АПБ вступает уже бутирил-АПБ (С4-ацил), и в результате образуется каприл-АПБ (С6-ацил) и т.д. (схема):
1-ый цикл: малонил-АПБ + ацетил_АПБ ↓
2-ой цикл: малонил-АПБ + бутирил-АПБ ↓
3-ий цикл: малонил-АПБ + каприл-АПБ ↓ 4-ый цикл: малонил-АПБ + С8-ацил-АПБ ↓ 5-ый цикл: малонил-АПБ + С10-ацил-АПБ ↓ 6-ой цикл: малонил-АПБ + С12-ацил-АПБ ↓ 7-ой цикл: малонил-АПБ + С14-ацил-АПБ ↓ пальмитил-АПБ
Суммарное уравнение биосинтеза пальмитиновой кислоты из ацетил-КоА в результате реакций семи циклов записывается следующим образом: 8 ацетил-Коа + 7 АТФ + 14 (НАДФ∙Н + Н+) → пальмитат + 14 НАДФ+ + 8 НS-КоА + 7 АДФ + 7 Н3РО4
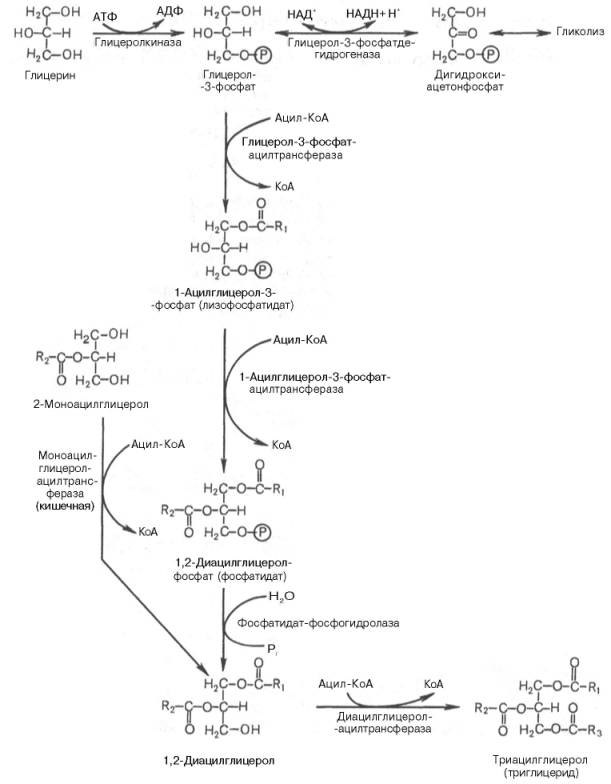
Из пальмитиновой кислоты путем присоединения дополнительно одной или нескольких молекул ацетил-КоА синтезируюся молекулы с более длинными цепями, а путем дегидрирования – ненасыщенные кислоты. «Доработка» молекул пальмитиновой кислоты осуществляется с помощью ферментов эндоплазматической сети, но может проходить и в митохондриях. Дегидрирование насыщенной жирной кислоты происходит параллельно с окислением НАДФ под действием молекулярного кислорода: С15Н31СОО-S-КоА + НАДФ∙Н + Н+ + О2 →СН3-(СН2)5-СН=СН-(СН2)7-СОО-S-КоА +НАДФ+ + 2 Н2О Дегидрирование насыщенных жирных кислот происходит в клетках печени и жировой ткани. В организме человека отсутствуют ферменты, позволяющие дегидрировать фрагменты –СН2-СН2-, находящиеся дальше С9, поэтому диеновая линолевая кислота С18Н32СООН и триеновая линоленовая кислота С18Н30СООН в организме не синтезируются. БИОСИНТЕЗ ТРИАЦИЛГЛИЦЕРИДОВ Известно, что скорость биосинтеза жирных кислот во многом определяется скоростью образования триацилглицеридов и фосфолипидов, так как свободные жирные кислоты присутствуют в тканяхи плазме крови в небольших количествах и в норме не накапливаются. Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование α-глицерофосфата (глицерол-3-фосфата) как промежуточного соединения. В почках, а также в стенке кишечника, где активность фермента глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза. Известно, что в процессе гли-колитического распада глюкозы образуется дигидроксиацетонфосфат (см. главу 10). Последний в присутствии цитоплазматической глицерол-3-фос-фатдегидрогеназы способен превращаться в глицерол-3-фосфат:
Отмечено, что если содержание глюкозы в жировой ткани понижено (например, при голодании), то образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы для ресинтеза триглицеридов, поэтому жирные кислоты покидают жировую ткань. Напротив, активация гликолиза в жировой ткани способствует накоплению в ней триглицеридов, а также входящих в их состав жирных кислот. В печени наблюдаются оба пути образования глицерол-3-фосфата. Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат):
Как отмечалось, ацилирование глицерол-3-фосфата протекает последовательно, т.е. в 2 этапа. Сначала глицерол-3-фосфат-ацилтрансфераза катализирует образование лизофосфатидата (1-ацилглицерол-3-фосфата, а затем 1-ацилглицерол-3-фосфат-ацилтрансфераза катализирует образование фосфатидата (1,2-диацилглицерол-3-фосфата). Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидро-лазой до 1,2-диглицерида (1,2-диацилглицерола):
Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой:
Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из β-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров. На рис. 11.6 представлены глицерофосфатный, дигидроксиацетон-фосфатный и β-моноглицеридный (моноацилглицероловый) пути синтеза триглицеридов.
Рис. 11.6. Биосинтез триглицеридов (триацилглицеролов). Установлено, что большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,– в митохондриях.
Оглавление Биохимия. 1 Химический состав живых организмов. 4 Химические вещества в живых организмах. 5 Неорганические вещества клетки. 5 Вода. 5 Функции воды. 5 Неорганические соли. 6 Роль солей в организме. 6 Органические вещества клетки. 7 Углеводы. 7 Химические свойства моносахаридов. 11 Реакции по карбонильной группе. 11 Реакции по гидроксильным группам.. 13 Реакции брожения. 14 Олигосахариды. Полисахариды. 14 Дисахариды.. 14 Строение дисахаридов. 15 Полисахариды. 16 Крахмал. 16 Амилаза. 16 Химические свойства полисахаридов: 17 Целлюлоза. 17 Химические свойства целлюлозы: 17 Хитин. 18 Липиды. 18 Простагландины. 21 Физические свойства липидов. 21 Функции жиров в организме: 21 Нуклеиновые кислоты.. 22 Биологически важные гетероциклические соединения. 22 Кислотно-основные свойства гетероциклов. 24 Строение мононуклеотидов. 27 Название нуклеозидов и мононуклеотидов. 29 Первичная структура ДНК – структура белков. 29 Вторичная структура ДНК.. 30 Структура РНК.. 30 СТРУКТУРЫ БЕЛКОВ.. 30 ПЕРВИЧНАЯ.. 30 ВТОРИЧНАЯ.. 30 ТРЕТИЧНАЯ.. 30 ЧЕТВЕРТИЧНАЯ.. 30 СВОЙСТВА БЕЛКОВ.. 30 ЭЛЕКТРИЧЕСКИЕ. 30 ДЕНАТУРАЦИЯ БЕЛКА.. 30 ФУНКЦИИ БЕЛКОВ В КЛЕТКЕ. 30 ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА.. 30 ХИМИЧЕСКИЙ СВОЙСТВА.. 30 ОСАЖДЕНИЕ БЕЛКОВ.. 30 БИОКАТАЛИЗ. 30 ВОДОРАСТВОРИМЫЕ. 30 ЖИРОРАСТВОРИМЫЕ. 30 Типичные реакции метаболизма. 30 и классификация ферментов. 30 Основные классы.. 30 1 класс (Оксиредуктазы) 30 2 класс (Тансферазы) 30 3 класс (Гидролазы) 30 4 класс (Лиазы) 30 5 класс (Изомеразы) 30 6 класс Лигазы (Синтетазы) 30 Номенклатура. 30 Коферменты дегидрогеназ. 30 Фловиновые дегидрогеназы.. 30 Коферменты переноса групп (трансферазы) 30 Аминотрансферазы. 30 Ацилтрансферазы.. 30 II. Влияние температуры на скорость ферментативной реакции. 30 III. Влияние pH среды на скорость ферментативной реакции. 30 IV. Ингибирование ферментов. 30 ДИНАМИЧЕСКАЯ БИОХИМИЯ.. 30 КАТАБОЛИЗМ.. 30 Специфические и общие пути катаболизма. 30 Катаболизм углеводов. 30 КАТАБОЛИЗМ ЛИПИДОВ.. 30 КАТАБОЛИЗМ БЕЛКОВ.. 30 Катаболизм аминокислот. 30 Общий путь катаболизма. 30 Окислительное фосфорилирование. Тканевое дыхание. ЦПЭ. 30 Биосинтезы.. 30 Биосинтез ДНК-репликаций. 30 Биосинтез РНК.. 30 рРНК.. 30 тРНК.. 30 Трансляция (биосинтез белка) 30 Биосинтез углеводов. 30 Биосинтез гликогена. 30 Биосинтез жиров. 30 Биосинтез жирных кислот. 30
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 347; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.100.42 (0.176 с.) |

 CH3-CH-COOH + НАД+ CH3-C-COOH + НАДН Н+
CH3-CH-COOH + НАД+ CH3-C-COOH + НАДН Н+




 а) C=O + CO2 + АТФ + H2O C=O + АТФ + H3PO4
а) C=O + CO2 + АТФ + H2O C=O + АТФ + H3PO4





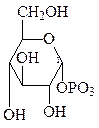
 УДФ-глюкоза + (глюкоза)n УДФ + (глюкоза)n+1
УДФ-глюкоза + (глюкоза)n УДФ + (глюкоза)n+1
 Глюкоза
Глюкоза Глюкозо-6-фосфат
Глюкозо-6-фосфат УДФ-глюкоза
УДФ-глюкоза