
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительное фосфорилирование.
После завершения цикла Кребса водород, отобранный от окисленных субстратов, находится в форме НАДН+Н+, то есть связан с коферментами дегидрогеназ. На следующем этапе происходит окисление восстановленных коферментов путем дегидрирования до воды, одновременно с этим за счет энергии окисления образуется АТФ. Эти окислительные процессы можно представить следующим образом: S*Н2 + ½ О2 → S + H2О Очевидно, что этот процесс по конечному результату сходен с реакцией горения водорода в кислороде:
За счет этой энергии происходит синтез АТФ. Известно, что максимально полезная работа получается при полностью обратимом процессе, реальные же процессы всегда не обратимы, поэтому величина полезной работы будет тем больше, чем в большей степени процесс приближается к равновесному. Организм превращает в полезную работу приблизительно 40% той энергии, которая выделяется при окислении субстратов и достигается это постепенным переносом протонов и электронов от субстратов к молекулярному кислороду. Увеличение числа промежуточных стадий способствует приближению реального процесса к равновесному, весь процесс тканевого дыхания протекает в митохондриях клетки. Митохондрия имеет форму цилиндра с закругленными краями, количество митохондрий в клетках различно: от 100-2 тысяч, они имеют внутреннюю и наружную мембраны, разделенные межмембранным пространством. Внутренние мембраны образуют складки – это так называемые кристы, содержимое пространство, которое ограничено внутренней мембраной, называется матриксом. Внутренние и внешние мембраны отличаются по составу и функциям, так, внешние мембраны проницаемы для молекул с молекулярной массой до 5 тысяч, а проницаемость внутренних мембран ограничена, следовательно, состав матрикса и состав межмембранного пространства отличается. Матрикс на 50 % состоит из белков, а во внутренней мембране митохондрий встроен ферментный ансамбль дыхательной цепи, который называется цепью передачи электронов – ЦПЭ. Ансамбль состоит из трех жесткозакрепленных ферментных комплексов, первый ферментный комплекс состоит из дегидрогеназ с коферментом ФМН, который переносит водород с НАДН на ФМН и далее на кофермент Q (убихинон).
Перенос водорода включает в себя много этапов, участвует ряд промежуточных переносчиков, разделяющих отдельно перенос электронов и протонов, в этом переносе участвуют цитохромы, представляющие собой гемопротеины. Атом железа в геммах цитохрома может менять валентность:
Рис.: Сопряжение дыхания и синтеза АТР (окислительного фосфорилирования). I – NADH – дегидрогеназа; II – сукцинатдегидрогеназа; III – OH2 – дегидрогеназа; IV - цитохромоксидаза; V – АТР – синтаза.
Митохондрий
ATP
Матрикс
АDP
  цис - S S – цис цис - S S – цис
Железосерные белки входят в комплекс дыхательной цепи, выполняя роль простетической группы в процессе переноса электронов. Комплекс III, цитохромов b, c1 действует как QH2 - дегидрогеназа:
Электроны последовательно проходят через атомы железа цитохромов b, c1 функционируют как Q∙H2 - дегидрогеназа, а протоны высвобождаются в раствор. Стехиометрический коэффициент 2 перед цитохромом с означает, что с QH2 передается 2 электрона, а цитохромы за один цикл могут передать только 1 электрон. Комплекс IV, действует как цитохромоксидаза, он помимо гемма содержит ионы меди, которые тоже участвуют в переносе электронов с цитохрома с на кислород, при этом электроны соединяются последовательно к ионам железа а1, а3, затем к меди, затем к кислороду. Кислород, поступающий в митохондрии из крови, связывается с атомом железа в цитохроме а3 в форме молекулы кислорода в молекулярном виде. Затем каждый из атомов молекулы кислорода последовательно присоединяет по два электрона и по два протона, превращаясь в молекулу воды. В дыхательной цепи имеется комплекс II, где осуществляется перенос электронов от сукцината, образующегося в цикле Кребса, направление потока электронов в дыхательной цепи при сопряжении одной окислительно-восстановительной системы с другой определяется их стандартными окислительно-восстановительными Red/Ox потенциалами. Эти величины для компонентов цепи и субстратов приведены в таблице, их величины:
В связи с тем, что Red/Ox потенциалы определяют сродство к электрону, то для любых двух пар система с более положительным потенциалом будет стремиться принимать электроны и, как видно, в дыхательной цепи Red/Ox потенциалы переносчика электронов становятся более положительными. Поэтому, электроны передаются в дыхательной цепи внутри мембраны, а протоны высвобождаются в межмембранное пространство. Протоны необходимы для восстановления той ФМН, которая поступает из матрикса. Таким образом, ЦПЭ работает как протонный насос, перекачивая ионы водорода из матрикса на наружную сторону мембраны, в результате, по разные стороны от внутренней мембраны возникает разность концентраций ионов водорода и одновременно разность потенциалов на поверхности. Следовательно, разность окислительно-восстановительных потенциалов трансформируется в энергию ΔµН+. Электрохимический потенциал заставляет протоны двигаться с наружной поверхности во внутреннюю, однако, мембраны в обратном направлении не проницаема для них, за исключением протонных каналов (V комплекс). В области этих каналов на внутренней поверхности внутренней мембраны располагается фермент Н+ АТФ-синтетаза, катализирующая синтез АТФ. Образующиеся молекулы, которые транспортируются из матрикса на наружную сторону мембраны и попадают в цитозоль. На синтез 1-ой молекулы АТФ, Δ Е0>0,2 В, требуется энергия не менее 31 кДж/моль, то есть в дыхательной цепи имеются 3 участка (I, III, IV), где высвобождение энергии достаточно для синтеза АТФ, следовательно, перенос пары электронов от НАДН в итоге дает нам образование 3-х молекул АТФ, а ФАД – 2-х молекул АТФ. Известно, что человек за сутки из воздуха потребляет приблизительно 67 литров (27 молей) кислорода, подавляющая его часть (90%) восстанавливается до воды при участии дыхательной цепи, за это же время в митохондриях синтезируется 62 кг АТФ, однако, содержание АТФ в организме составляет около 50 грамм, вследствие того, что каждая молекула АТФ расщепляется и регенерируется 2,5 тыс. раз в сутки, средняя продолжительность ее жизни меньше 1-ой минуты.
Биосинтезы
Биосинтез ДНК. Репликация. Синтез новой дочерней цепи ДНК происходит на одной из цепей материнской ДНК как на матрице, поэтому последовательность оснований в цепи-матрице определяет последовательность оснований в новой цепи: против аденина в цепи матрицы в дочернюю цепь всегда пристраивается тимин, а против гуанина − цитозин и наоборот. В результате новая цепь ДНК является копией старой, поэтому этот процесс называется репликацией, то есть копированием. Репликация ДНК начинается с того, что её двойная спираль освобождается от гистонов, и обе цепи молекулы расходятся. После этого каждая из материнских цепей будет служить матрицей, на которой пойдёт синтез новой цепи ДНК. Раскручивание начинается в определенной точке ДНК, называемой точкой инициации. Инициация синтеза у простых организмов происходит в одной точке, а у животных в нескольких точках. Та часть молекулы ДНК, которая уже расплелась и в данный момент служит матрицей для синтеза дочерней цепи, называется репликационной вилкой. Двойная спираль в обычных условиях довольно стабильна. Спаренные основания соединены так прочно, что для разделения двух цепей ДНК в пробирке нужна температура ~90оС, а для того, чтобы спираль раскрутилась, в клетке необходимы специальные ферменты: белки ДНК – геликазы и белки, дестабилизирующие спираль (SSВ-белки). В ходе репликации ферменты перемещаются вдоль молекулы ДНК, при этом расплетаются всё новые участки родительской цепи до тех пор, пока репликационная вилка не дойдёт до точки окончания синтеза – точки терминации. Чтобы расплетённые цепи опять не соединились, каждая цепь связывается с несколькими молекулами дестабилизирующего белка, которые соединяются с одиночными цепями белка, не закрывая нуклеотидных оснований. Мономерами для новой цепи ДНК являются одиночные дизокси нуклиозидтрифосфаты. В ходе реакции от каждого из них отщепляется пирофосфатный остаток, так как включение каждого мономера в молекулу ДНК требует затраты высокоэнергетических связей. Способность азотистых оснований молекул различных нуклеиновых кислот узнавать друг друга путём нековалентного взаимодействия называется спариванием оснований. Спаривание оснований лежит в основе механизмов наследственности. Фермент, катализирующий соединения друг с другом свободных нуклеотидов с образованием новой цепи ДНК, называется ДНК-полимеразой. Она присоединяет дезоксирибонуклеозидтрифосфат к ОН-группе на 31 одной из цепей, при этом две концевые фосфатные группы (пирофосфат) отщепляются, а высвобождаемая энергия используется для связи между нуклеотидами. Так как считывание информации происходит от 31-конца цепи к ее 51-концу, то новая цепь растет в направлении 51→31 и антипараллельна цепи-матрице.
Поскольку две цепи родительской ДНК антипараллельны, то только одна из новых цепей может синтезироваться в направлении 51→31. На второй цепи-матрице синтез новой цепи должен был бы идти в направлении 31→51, однако, поскольку не существует фермента, катализирующего полимеризацию нуклеотидов в этом направлении, то и вторая цепь также синтезируется в напрвлении 51→31, но короткими фрагментами, называемыми фрагментами Оказаки по имени ученого, открывшего их. У бактериальной клетки число этих фрагментов достигае 1-2 тысяч, а у клеток эукариот – всего 100-200. Фрагменты потом сшиваются с помощью фермента ДНК-лигазы путем связывания 51-фосфата одного фрагмента с 31-ОН-группой другого, в результате чего образуется непрерывная вторая цепь ДНК. Цепь ДНК, синтезируется непрерывно и называется лидирующей, а другая, синтезируемая короткими фрагментами − отстающей. Ведущая цепь растёт непрерывно, так как непрерывно работает ДНК-полимераза, а на отстающей цепи этот фермент работает через определенные промежутки времени, когда начинает действоваь РНК-затравка. Она синтезируется из рибонуклеозидтрифосфатов с помощью фермента ДНК-праймазы и состоит у эукариотов из 10 нуклеотидов. РНК-праймазы синтезируются с определенными интервалами на матрице и являются точками инициации синтеза фрагментов Оказаки, предоставляя свою свободную 31-ОН-группу для присоединения первого нуклеотида ДНК. ДНК-полимераза присоединяет один нуклеотид за другим до тех пор, пока не достигнет РНК-затравки, присоединенной к 51-концу предыдущего фрагмента ДНК. Итак, в результате синтеза новой цепи ДНК происходит репликация (копирование), материнской цепи ДНК и ее удвоение, при этом каждая новая молекула состоит из одной «старой» и одной «новой» полинуклеотидной цепи. Т акая репликация называется полуконсервативной. Периодичность репликации ДНК совпадает с периодичностью митоза, то есть процесса деления клеток, при котором каждая из вновь возникающих клеток получает генетический материал, идентичный исходной клетке.
Биосинтез РНК Синтез РНК на ДНК-матрице называется транскрипцией (переписыванием), происходит в ядре клеток с помощью РНК-полимерозы. Рибонуклеиновые кислоты содержатся во всех живых клетках виде одноцепочных молекул, которые, как и ДНК, состоят из нуклеотидов, однако в состав нуклеотидов РНК место дезоксирибозы входит рибоза, а вместо тимина − другое пиримидиновое основание − урацил. Отдельные участки нуклеотидной цепи РНК связываются водородными связями. Синтез белков, информация о строении которых зашифрована в последовательности расположения нуклеотидов в цепи ДНК, происходит на рибосомах, расположенных в цитоплазме. Следовательно, для осуществления этого синтеза необходимо перенести генетическую информацию из ядра в цитоплазму. Таким посредником в синтезе белка является одна из рибонуклеиновых кислот − информационная РНК (иРНК), называемая также матричной РНК (мРНК). В синтезе белка участвуют также транспортные тРНК и рибосомные рРНК.
Нуклеотиды, из которых синтезируются РНК, присоединяются к лидирующей цепи по принципу комплементарности, который имеет место при репликации ДНК, и с помощью РНК-полимеразы соединяются между собой, образуя полинуклеотидную цепь РНК. Количество РНК в каждой клетке зависит от количества синтезируемого белка. Молекулы РНК менее стабильны, чем молекулы ДНК, поэтому именно ДНК используется в качестве хранилища генетической информации. Информационные РНК На долю иРНК приходиться 3-5% всех, они имеет самое простое строение − одноцепочная молекула, состоящая из 70-10000 нуклеотидов. При синтезе иРНК на одной из цепей ДНК происходит спаривание оснований так же, как и при воспроизводжстве самой ДНК: присутствие аденина в матричной цени ДНК определяет присоединение урацила к образующейся цепи РНК, а цитозина − присоединение гистидина.
Поскольку иРНК образуются непосредственно на цепи ДНК и являются её копией, то информация о последовательности аминокислотных остатков, записанная с помощью нуклеотидных оснований в ДНК превращается в последовательность комплиментарных оснований на молекуле РНК. В этом генетическом коде одной аминокислоте белка соответствует набор 3-х оснований – триплет, расположенных в определённой последовательности. Этот триплет оснований называется кодоном. Четыре основания аденин A, урацил U,гуанин G и цитозин С можно комбинировать 64 способами, и, поскольку эти 64 комбинации используются для кодировки 21-ой аминокислоты, то генетический код является вырожденным, то есть одна аминокислота кодируется несколькими различными комбинациями. Генетические коды для различных аминокислот приведены на рисунке… Три триплета (UUA, UAG, UGA) кодируют окончание синтеза – терминацию (стоп-кодоны), о один (AUG) кодирует начало синтеза белковой молекулы с метионина. Длина иРНК зависит от длины полипептидной цепи, которую она кодирует. Поскольку иРНК служит для синтеза белка, то она существует пока идёт синтез (от нескольких минут у бактерий до нескольких дней у млекопитающих).
Рибосомные РНК Рибосомы сами являются белками и содержат 70-80 различных белков. Функции рРНК сводятся к способствованию присоединения иРНК к ферментам, катализирующим процесс образования полипептидной цепи. Количество рибосом в клетках колеблется от нескольких десятков тысяч у бактерий до миллиона и больше у эукариотов. Гены, кодирующие структуру рРНК, находятся в ядрышке. Все рибосомы состоят из двух фрагментов большого и маленького. Маленький состоит из 21-ого белка разной структуры и одной молекулы РНК массой около миллиона, а большой из 35 различных белков и знчительно большей молекулы рРНК (молекулярная масса ~1000 000). Большой и маленький фрагмент могут легко отщепляться друг от друга(диссоциировать) и соединяться во время синтеза белка в одну большую частицу (рекомбинировать). Транспортные РНК Транспортные РНК участвуют в процессе трансляции в качестве промежуточного звена между нуклеиновыми кислотами и белками. Их функция заключается в том, что они переносят аминокислоты на рибосомы, где идёт синтез белка. Так как многие аминокислоты кодируются несколькими триплетами, то число известных тРНК больше 21-ой, их известно около 60-ти. тРНК самые короткие из рибонуклеиновых кислот. Они состоят примерно из 80 нуклеотидов, их молекулярная масса сравнительно низка − 25-30 тысяч. Молекулы всех тРНК имеют сходную форму, их цепь изгибается так, что напоминает лист клевера или клена (рисунок). Эта форма поддерживаются водородными связями, возникающими между комплементарными нуклеотидными основаниями цепи. На 51-конце молекулы всегда находится гуанин, а на 31-конце группа ССА, к которой присоединяется аминокислота. Последовательность нуклеотидов в цепи остальной части молекулы разная. Транспортные РНК должны выбрать из 21-ой аминокислоты свою, перенести ее к рибосоме и расположить в синтезируемой полипептидной цепи в той последовательности, которая закодирована в иРНК. Связывание тРНК со своей аминокислотой происходит с помощью фермента аминоацил-тРНК-лигазы. Этот процесс является активацией аминокислот и происходит в две стадии. Сначала аминокислота реагирует с АТФ, образуя соединение с макроэргической связью − аминоациладенилат. С него аминокислотный остаток переносится на 31-ОН-группу рибозы концевого остатка ССА тРНК, который у всех тРНК одинаков, и при этом отщепляется нуклеотид АМФ и образуется комплекс аминоацил-тРНК (аа-тРНК). Суммарная реакция образования аа-тРНК может быть записана следующим образом: АМК + тРНК +АТФ → аа-тРНК +Н4Р2О7 + АМФ
В вершине листа молекулы тРНК находится участок, состоящий из 3-х нуклеотидов, последовательность которых строго соответствует коду переносимой кислоты. Этот участок является антикодоном кодону в молекуле иРНК, который он узнает за счет спаривания оснований путем образования между ними водородных связей при условии, что полинуклеотидные цепи ТРНК и иРНК антипараллельны: иРНК 51 – U U C – 31 (кодон) тРНК 31 –А А G – 51 (антикодон) За счет этих водородных связей тРНК прикрепляется к иРНК.
Трансляция (биосинтез белка)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 231; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.184.237 (0.036 с.) |
 Н2 + ½ О2 Н2О ΔG0 = -100 кДж/моль
Н2 + ½ О2 Н2О ΔG0 = -100 кДж/моль 2Н – 2е 2Н+
2Н – 2е 2Н+ О0 + 2е О-2
О0 + 2е О-2 НАДН + Н+ + ФМН ФМН*Н2 + НАД+
НАДН + Н+ + ФМН ФМН*Н2 + НАД+ ФМН*Н2 + Q ФМН + Q* Н2
ФМН*Н2 + Q ФМН + Q* Н2
 Fe3+ + e Fe2+
Fe3+ + e Fe2+ Наружная мембрана митохондрий
Наружная мембрана митохондрий

 Межмембранное пространство
Межмембранное пространство





 + + ++ + +
+ + ++ + +



 Внутренняя 2e- Q 2e-
Внутренняя 2e- Q 2e- Мембрана 2e- 2e- 2e-
Мембрана 2e- 2e- 2e-
 NADH NAD+ Фумарат 1/2О2 Н2О
NADH NAD+ Фумарат 1/2О2 Н2О

 Сукцинат V
Сукцинат V


 Оксалоацетат Малат ADP + H3PO4
Оксалоацетат Малат ADP + H3PO4

 H+
H+

 АТР
АТР

 Присоединение электрона в такой структуре и его отдача вызывают изменение лишь электронной конфигурации атома металла, не затрагивая структуру белков. Цитохромы дыхательных путей обозначаются как: b, c1, с, a a3 и располагаются в цепи между убихиноном и кислородом: b c1 с a a3
Присоединение электрона в такой структуре и его отдача вызывают изменение лишь электронной конфигурации атома металла, не затрагивая структуру белков. Цитохромы дыхательных путей обозначаются как: b, c1, с, a a3 и располагаются в цепи между убихиноном и кислородом: b c1 с a a3

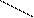


 QH2 + 2с (Fe3+) Q + 2Н+ + 2с (Fe2+)
QH2 + 2с (Fe3+) Q + 2Н+ + 2с (Fe2+)


