
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние температуры на скорость ферментативных реакций
Как известно, скорость химической реакции, согласно эмпирическому правилу Вант-Гоффа, при повышении температуры на 10о увеличивается в 2-4 раза. Однако для ферментативных реакций оно соблюдается лишь до 50-60 оС. При более высоких температурах фермент, представляющий собой белок, денатурирует, изменяется его конформация, и он уже не может выполнять свои каталитические функции. Поэтому зависимость скорости ферментативной реакции от температуры имеет вид кривой с максимумом (рисунок)
Максимум соответствует наивысшей активности фермента, которая обычно измеряется его количеством в мг, которое катализирует 1 мгмоль субстрата за 1 мин. Удельная активность измеряется в расчете на 1 мг фермента (мгмоль/мин). Молярная активность (число оборотов или каталитическая константа) рассчитывается на мгмоль фермента (мгмоль/мгмоль ∙×мин), то есть молярная активность показывает, сколько молекул субстрата превращается за 1 минуту одной молекулой фермента. Кроме температуры на активность ферментов влияют рН среды и присутствие ингибиторов.
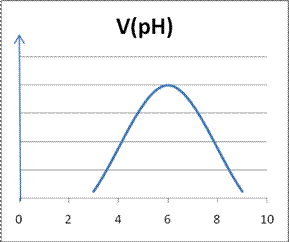
Влияние рН на скорость ферментативной реакции Для большинства ферментативных реакций оптимальное значение рН среды лежит в интервале 5− 9. Кривая зависимости скорости ферментативной реакции от рН является кривой с максимумом (рисунок)
Такой вид кривой обусловлен тем, что существует оптимальное состояние ионизации субстрата и белковой молекулы фермента (её аминокислотных остатков), которое обеспечивает наиболее прочное их соединение в активном центре и, следовательно, наибольшую скорость реакции.
Ингибиторы ферментов Действие ферментов может быть ослаблено или полностьюподавлено с помощью определенных веществ – ингибиторов. Их действие может быть обратимым и необратимым. Обратимые ингибиторы обычно связываются с ферментом нековалентными связями и могут быть легко от них отсоединяться, при этом существуют так называемые конкурентные обратимые ингибиторы, которые имеют сходные структуры с субстратом и стремятся, каждый в первую очередь, связаться с ферментом на субстратсвязывающем участкеактивного центра. Если к ферменту Е добавить конкурентный ингибитор I и субстрат S, то образуются два комплекса по реакциям:
Е + S «ES ® Р + Е
Е + I «Е I ≠
Так как образование комплекса ЕI не приводит к образованию продуктов реакции, то скорость реакции их образования уменьшается, так как уменьшается число активных центров фермента, способных взаимодействовать с субстратом. Поскольку конкурентный ингибитор связывается с ферментом обратимо, то уменьшить его действие можно, увеличивая концентрацию субстрата, так как при этом увеличивается вероятность связывания фермента с субстратом. Ингибитор, мешая образованию фермент-субстратного комплекса, он увеличивает константу Михаэлиса Кm, но не изменяет Vmax. Неконкурентный обратимый ингибитор не сходен поструктуре, с субстратом, поэтому он может связываться с ферментом и в присутствии и в отсутствии субстрата, и обычно связывается с ферментом не в активном центре, а в другом месте, обычно в регуляторном центре. При этом образуется тройной комплекс: фермент-ингибитор-субстрат (ЕSI), который не приводит к образованию продуктов реакции: Е + S + I ® Е I ≠ Р
При данном типе ингибирования влияние ингибитора не может быть преодолено повышением концентрации субстрата. Неконкурентный обратимый ингибиторуменьшает как Vmax, так и Кm. Необратимые ингибиторы ферментов – это соединения, которые образуют прочные связи с ферментом, причем именно в активном его центре. Связывая важные группы на субстрат связывающем участке, они необратимо изменяют его конфигурацию. Так необратимо действуют на ферменты ионы тяжелых металлов Hg+2 и Pb+2, чем объясняется их токсическое действие на организм человека. Регуляция действия ферментов осуществляется гормонами.
ДИНАМИЧЕСКАЯ БИОХИМИЯ Совокупность химических реакций, протекающих в живых клетках, и обеспечивающих организм нужными ему веществами и энергией носят название обмена веществ или метаболизма. Различают катаболизм и анаболизм. Катаболическое превращение – это расщепление сложных молекул, как поступающих с пищей, так и находящихся в клетке, эти процессы называются экзогоническими. Анаболические процессы (процессы биосинтеза) направлены на образование и обновление структурных элементов клеток, то есть на синтез сложных молекул из простых. Процессы биосинтеза – это восстановительные процессы и они сопровождаются затратой свободной энергии, такие процессы называются эндергоническими. Обе стороны процесса взаимосвязаны между собой во времени и пространстве. Катаболические и анаболические процессы протекают в различных органеллах клетки, где локализованы различные внутриклеточные ферменты. Все метаболические пути взаимосвязаны, что показано на интегральной схеме метаболических путей.
КАТАБОЛИЗМ
|
||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 216; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.76.51 (0.007 с.) |

 Р
Р



