Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II. Коферменты переноса групп (трансферазы)
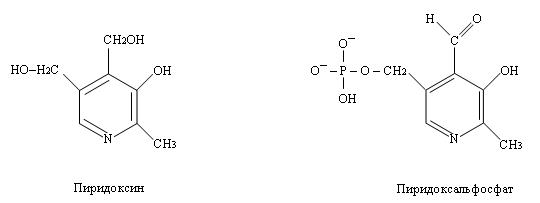
II.1. Аминотрансферазы. В метаболизме азотсодержащих соединений важную роль играют реакции переноса аминогрупп с остатков аминокислот на другие соединения (например, кетогруппы). Это реакции трансаминирования. Они катализируются ферментами, коферментом для которых служит пиридоксальфосфат (производная пиридоксина – витамина B6).
Пиридоксальфосфат ковалентно связан с ферментом за счёт взаимодействия альдегидной группы пиридоксальфосфата и аминогруппы аминокислоты лизина, входящей в состав белковой молекулы фермента (альдиминная связь).
Кроме этой связи пиридоксальфосфат связывается с белковой частью фермента за счёт ионных связей с участком фосфорного остатка и за счёт заряженного атома азота в пиридиновом кольце.
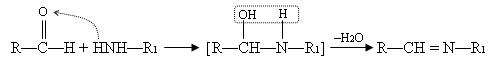
Соединение лизина и пиридоксальфосфата имеет плоское строение, обусловленное пиридиновым кольцом и дополнительной водородной связью между атомом N и атомом H гидроксильной группы. В процессе реакции трансаминирования аминокислоты, конкурируя с лизином, способны разрывать связь остатка лизина с карбонильной группой передоксальфосфата, вытесняя его из комплекса с ферментом. Кофермент в этом случае играет роль посредника, т.е. промежуточного акцептора аминогруппы. Весть процесс переноса аминогруппы (NH2) с α-аминокислоты на α-кетокислоту происходит в несколько стадий: 1) На первой аминогруппа субстрата (например, аланина), конкурируя с лизином, образует альдиминную связь с передоксальфосфатом.
2) Внутримолекулярная перестройка. Под влиянием изомеразы двойная связь переходит от одного углерода к другому.
Образуется кетоиминная группировка – промежуточное соединение, у которого двойная связь находится у того атома углерода, который будет связан с кислородом на следующей стадии. 3) Стадия гидролиза. При этом образуется аминогруппа на коферменте и кетогруппа на бывшей аминокислоте.
4) Четвёртая стадия происходит при наличии второго субстрата, которым является кетокислота, например, 2-оксоглутаровая:
При этом происходит переход пиридоксальфосфата в исходную альдегидную группировку с лизином
Как видно из уравнений, механизм реакции такой же, как при взаимодействии пиридина с аминокислотой, только конкурентами за кетогруппу кислоты становятся лизин и пиридоксальфосфат.
Осуществление рассмотренной последовательности реакций становится возможным благодаря возникающим конкурентным отношениям. По конкурирующим способностям за карбонильной группой пиридоксальфосфата аминокислоты располагаются в следующий ряд: глутамат < остаток лизина в полипептиде < остаток аминокислоты Суммарно весь этот процесс можно изобразить следующим образом:
ПДФ в комплексе с декарбоксилазой может катализировать декарбоксилированные глутаминовые кислоты (образуется γ-аминомасляная кислота), гистодина, триптофана и др. аминокислоты.
Ацилтрансферазы Ацильная группа – это остаток от карбоновых кислот.
Коферментом реакции ацилирования является кофермент А или коэнзим КоА. Он переносит остатки карбоновых кислот. КоА – гетерофункциональное соединение, однако его физиологическая активность обусловлена концевой сульфгидрильной (тиольной) группы «–SH». Все реакции с участием КоА заключаются в образовании тиоэфиров при взаимодействии с кислотами.
Характерной особенностью структуры молекулы КоА является наличие длинного и гибкого рычага между группой SH с одной стороны и остатком аденазина с другой стороны. Молекула КоА построена из 3'-фосфоаденазин-5'-дифосфата, соединённого сложной эфирной связью с пантотеновой кислотой, которая в свою очередь соединена с β-меркатоэтиламином. Пантотеновая кислота – это продукт взаимодействия 2,4-дигидрокси-3,3-диметилбутановой кислоты и β-аланин-3-аминопропановой кислоты.
ОСНОВЫ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
|
|||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 430; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.97.64 (0.004 с.) |