Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аналитический метод оптимизацииСодержание книги
Поиск на нашем сайте
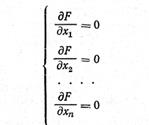
Применяют к задачам, для которых целевая функция выражена аналитически и дифференцируема во всем диапазоне исследования. Экстремум находится из условия равенства нулю производных функции. Пусть целевая функция задана формулой R=f(u1, u2,…un). Классический метод отыскания экстремума заключается в решении системы
Левые части уравнений (24.1) — функции от факторов u1, u2,…un. Поэтому решение системы может дать величины u1опт, u2опт,…unопт, являющиеся оптимальными значениями факторов; их совокупность определяет оптимальное решение задачи. Если оптимизируется технологический процесс, то этому решению соответствует оптимальный режим. Однако в том, что полученные значения действительно оптимальны, нужно убедиться. Необходимо выяснить четыре обстоятельства. 1. Действительно ли решение системы (24.1) определяет экстремум: известно, что условию (24.1) может удовлетворять и седловая точка или точка перегиба. 2. Получен ли экстремум нужного знака (максимум, если нас интересует максимум, или минимум в обратном случае). 3. Если система имеет несколько решений, то какое из них отвечает глобальному оптимуму, а какие — локальным. Так, если зависимость имеет несколько максимумов, то глобальным будет тот из них, который выше всех остальных; остальные будут локальными. 4. Все ли ограничения соблюдаются в точке экстремума.
Оптимизация простой реакции рассмотрим реакцию вида:
Наши рассуждения будут верны практически для любой обратимой (и необратимой) реакции. Если химическая реакция проходит без побочных стадий, то удается найти очень простой критерий оптимальности — скорость реакции. Согласно схеме, данной в предыдущем разделе, теперь нужно установить ограничения и выбрать оптимизирующие факторы. Но часто бывает удобно сначала записать целевую функцию, а уже потом перейти к ограничениям и оптимизирующим факторам. Целевая функция имеет вид
Таким образом, наш критерий зависит от трех параметров: температуры Т и концентраций Cа и Cв. По-видимому, эти три величины можно было бы избрать в качестве оптимизирующих факторов. Но необходимо учесть, что концентрации CA и CB не относятся ко входам рассматриваемой системы. Они сами получаются как результат реакции. Ясно, что для увеличения скорости следовало бы иметь как можно большее значение cа и как можно меньшее cb. Цель же процесса — противоположная: увеличить cb и уменьшить са. Поэтому концентрации нельзя рассматривать как независимые факторы. Итак, есть лишь один независимый фактор, которым можно влиять на R - температура. Рассматриваемая задача обычно называется задачей об оптимальной температуре химической реакции. Но при разных концентрациях влияние температуры может быть различным. Поэтому будем решать задачу в такой постановке. Фиксируем некоторые значения CA и CB и при этих значениях найдем оптимальную температуру. Это означает, что концентрации веществ А и В выступают в нашей задаче как ограничения типа равенства. Кроме того, учтем одно ограничение типа неравенства, которое существует в любой практической задаче: температура не может превысить некоторого максимального значения Т макс
Прежде, чем обращаться к формуле (24.1), рассмотрим два случая, когда оптимум можно найти из физических соображений, без расчета. Если реакция необратима, т. е. k 02 = 0, то в правой части формулы (24.2) остается только первый член, который с ростом температуры растет неограниченно. Максимум в смысле условия (24.1) отсутствует. Тогда оптимум определяется ограничением: следует поддерживать максимально допустимую температуру
Пример 24.1. Оптимальная температура необратимой реакции. Реакция сгорания топлива практически необратима. В тех случаях, когда требуется максимальная интенсивность горения, следует поддерживать максимально достижимую температуру. На увеличение этой температуры направлены усилия при конструировании современных топок. Если реакция обратима, но эндотермична, т. е. E1>E2, то результат рассуждений — тот же, что и в предыдущем случае. Действительно, с ростом температуры и равновесие сдвигается вправо, и скорость прямой реакции растет. Поэтому оптимум определяется формулой (24.4). Пример 24.2. Оптимальная температура эндотермической реакции. К рассматриваемому типу относится реакция
Открытая еще в XV{II веке Г. Кавендишем, она нашла практическое применение лишь в начале нашего века, когда дешевая гидроэлектроэнергия и разработка дуговых печей позволили поднять Тытс до 3000 К. Но в дальнейшем этот метод фиксации азота был вытеснен синтезом аммиака. Ныне прямое окисление азота вновь обретает перспективы, что связано с повышением уровня ограничения: после появления плазмотронов можно рассчитывать на увеличение его конкурентоспособности. Если реакция — обратимая экзотермическая, т. е. E1<E2, то к решению потребуется применить иной подход. В этом случае с ростом температуры вначале более существенным будет возрастание скорости прямой реакции: обратная еще слишком медленна. При дальнейшем повышении температуры обратная реакция, имеющая большую энергию активации, начинает «нагонять» прямую. При данном составе существует температура Травн, при которой смесь находится в равновесии, r = 0; затем ход реакции смещается влево. Где-то посередине имеется температура, при которой суммарная скорость реакции максимальна. Это и есть ТОПТ. Для ее расчета запишем условие (24.1) для формулы (24.2):
Здесь записана частная производная по Т, поскольку она берется при фиксированных СА и CB. Из уравнения (24.5) несложными преобразованиями можно получить формулу оптимальной температуры
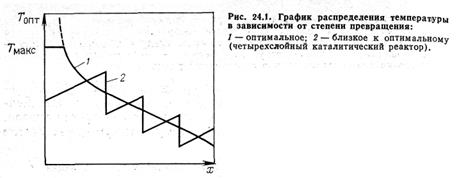
Из уравнения (24.6) следует, что чем выше CA и чем меньше CB, тем выше ТОПТ; по мере роста степени превращения величина ТОПТ, уменьшается. При CB →0 по формуле Реально осуществить такое распределение температуры чрезвычайно трудно, поэтому применяют другие распределения, более или менее приближающиеся к оптимальному. Так, ломаная 2 на рис. 24,1 показывает ход температуры в пятислойном каталитическом реакторе, в каждом слое которого реагирующая смесь адиабатически разогревается за счет тепла реакции, а между слоями охлаждается в теплообменнике. Такое распределение температур приведет к несколько худшим результатам (большему объему катализатора), но его сравнительно легко осуществить. Чем больше ступеней катализа, тем ближе ломаная к оптимальной кривой. Если реакцию проводят в аппарате смешения, то во всем его объеме имеем одну и ту же степень превращения. Ей соответствует одна точка на кривой 1 (рис. 24.1), соответствующая оптимальной температуре для данного аппарата.
|
||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 519; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.161.245 (0.008 с.) |