
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рівняння стану ідеальних газівСодержание книги
Поиск на нашем сайте
Рівняння стану одержано на основі законів Бойля-Маріотта, Гей-Люссака і Авогадро.
Закон Бойля-Маріотта був встановлений експериментально і встановлює зв'язок між об'ємом газу і його тиском при постійній температурі. Він записується таким чином
Р V=const
Або для 1 кг газа
P v=const (1.1)
де р – тиск газу, Па; v – питомий об’єм м3/кг; V – об’єм газу, м3. Закон Гей-Люссака формулюється таким чином: Зміна об'єму постійної кількості ідеального газу при незмінному тиску прямо пропорціонально зміні абсолютної температури, тобто для 1 кг газу
v/T=const (1.2)
З рівнянь (1.1) і (1.2) можна одержати рівняння стану для ідеального газу
де R – питома газова постійна, Дж/(кг К). Це рівняння вперше вивів французький учений Клапейрон. Рівняння стану приймає універсальну форму, якщо для нього використати закон Авогадро. Згідно цьому закону в рівних об'ємах різних ідеальних газів при однакових Р і Т міститься однакове число молекул. Нехай в двох посудинах однакового об'єму V, м3, при однакових Р і Т знаходяться різні гази. За законом Авогадро в них міститься однакова кількість молекул N. Відносні молекулярні маси цих газів рівні μ1 і μ2 кг/моль. Їх маси m1 і m2, кг, прямо пропорційні молекулярним масам, тобто
отже
та
Оскільки v – об'єм 1 кг газу, а μ його молекулярна маса в кг/моль, то добуток Кіломолем (кмоль) називається кількість речовини, маса якої в кілограмах чисельно рівна його відносній молекулярній масі. Тоді 1 кмоль будь-якого ідеального газу при однакових Р і Т однаковий і складає 22,4 м3/кмоль. Значить по відомому значенню μ, кг/моль можна визначити питомий об'єм v, м3/кг, і густина ρ, кг/м3.
Помножимо обидві частини рівняння стану (1.3) на μ і напишемо його для 1 кг газу
тоді
Rμ для будь-якого газу однакова і складає Rμ =8314,3 Дж/(кмоль К). Газову постійну віднесену до 1 кмоль, називають універсальною газовою постійною. Знаючи універсальну газову постійну визначають газову постійну будь-якого газу R, Дж/(кг К).
Помноживши обидві частини рівняння (15) на К – число кіломолів газу одержимо
Оскільки добуток
Характеристики палива
Основним джерелом енергії в даний час є органічне паливо – тверде, рідке і газове. Паливом називають горючі речовини, які спалюють для отримання в промислових цілях необхідної кількості теплоти. Паливо в тому вигляді, в якому воно поступає споживачу, називають робочим паливом. Елементарний склад робочої маси (індекс «р») твердого палива дається на 1 кг маси палива %:
До горючих елементів палива відносяться вуглець С, водень Н і сірка S. Сірка міститься в паливі в трьох видах: органічна Sop, колчеданова Sk і сульфатна Sc. Органічна входить до складу складних органічних сполук палива, колчеданова входить у вигляді з'єднань з металами. Сульфатна сірка входить до складу палива у вигляді сульфатів, тому в процесі горіння подальшому окисленню не піддається, а переходить в золу. Зола палива Зола разом з вологою
Кисень Для характеристики властивостей палива користуються поняттями сухої (індекс «с») і горючої (індекс «г») мас палива. При повній відсутності вологи склад палива характеризується сухою масою %:
Беззольно-безводий склад палива характеризує його горючу масу %:
Перерахунок складу палива з однієї маси на іншу проводиться множенням на коефіцієнти, які приведені в таблиці 14.1
Таблиця 14.1
Найважливішими характеристиками палива є теплота спалювання, вихід летючих речовин і властивості коксу. Теплотою спалювання палива називається кількість теплоти, що виділяється при повному спалюванні 1 кг маси твердого або рідкого палива або 1 м3 газового палива за нормальних фізичних умов. Розрізняють вищу і нижчу теплоти спалювання. Вищою теплотою спалювання, Зв'язок між вищою і нижчою теплотою спалювання палива виражається формулою
де коэффициент 0,025 – теплота пароутворення води, МДж/кг;
Вища теплота спалення твердого і рідкого палива визначається лабораторним шляхом. Точне аналітичне визначення теплоти спалення твердого і рідкого палив по їх елементарному складу неможливе, так як останній не відображає структуру органічних сполук, утворюючих горючу масу. Нижча теплота спалення палива (МДж/кг) може бути розрахована за емпіричними формулами, найточніша з яких належить Д.І. Менделєєву. Для твердих і рідких палив вона має вигляд
У формулі (1.19) коефіцієнти підібрані експериментально і дещо відрізняються від теплот спалення окремих елементів. Нижча теплота спалення сухого газоподібного палива (МДж/м3) може бути визначена за формулою
Для порівняння енергетичної цінності різних видів палива вводиться поняття умовного палива, теплота спалювання якого прийнята рівної Перерахунок витрати даного палива В, в умовне Вумов проводиться за формулою
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 232; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.34.132 (0.008 с.) |

 (1.3)
(1.3) (1.4)
(1.4) (1.5)
(1.5) (1.6)
(1.6) є 1 кмоль газу Vμ.
є 1 кмоль газу Vμ.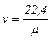 (1.7)
(1.7) (1.8)
(1.8) (1.9)
(1.9) – об'єм 1 кмоль газу, а
– об'єм 1 кмоль газу, а  за значенням є газовою постійною 1 кмоль газу, і цю величину позначають Rμ. Тоді рівняння (1.14) можна записати
за значенням є газовою постійною 1 кмоль газу, і цю величину позначають Rμ. Тоді рівняння (1.14) можна записати (1.10)
(1.10) (1.11)
(1.11) (1.12)
(1.12) є об'ємом К кмоль газу, то
є об'ємом К кмоль газу, то (1.13)
(1.13) . (1.14)
. (1.14) є сумішшю негорючих мінеральних з'єднань, які залишаються після горіння палива.
є сумішшю негорючих мінеральних з'єднань, які залишаються після горіння палива.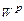 складає негорючу суміш і називається зовнішнім баластом. Зовнішній баласт знижує цінність палива, до того ж частина теплоти витрачається на випаровування вологи і виноситься з димовими газами.
складає негорючу суміш і називається зовнішнім баластом. Зовнішній баласт знижує цінність палива, до того ж частина теплоти витрачається на випаровування вологи і виноситься з димовими газами.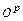 і азот, що не бере участь в горінні,
і азот, що не бере участь в горінні,  називають внутрішнім баластом палива.
називають внутрішнім баластом палива. (1.15)
(1.15)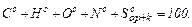 (1.16)
(1.16)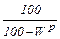


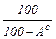


 Дж, називається кількість теплоти, що виділяється при тому, що спалюванні палива з урахуванням теплоти конденсації водяної пари, що утворюється при спалюванні водню
Дж, називається кількість теплоти, що виділяється при тому, що спалюванні палива з урахуванням теплоти конденсації водяної пари, що утворюється при спалюванні водню 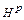 і випаровуванні вологи палива
і випаровуванні вологи палива  називається теплота спалювання палива за умови, що волога, що утворюється при спалюванні водню палива
називається теплота спалювання палива за умови, що волога, що утворюється при спалюванні водню палива  , і волога палива
, і волога палива  , (1.17)
, (1.17)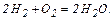 (1.18)
(1.18)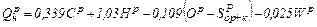 (1.19)
(1.19) (1.20)
(1.20) МДж/кг (7000 ккал/кг).
МДж/кг (7000 ккал/кг). . (1.21)
. (1.21)


