Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закономерности в химических свойствах⇐ ПредыдущаяСтр 14 из 14
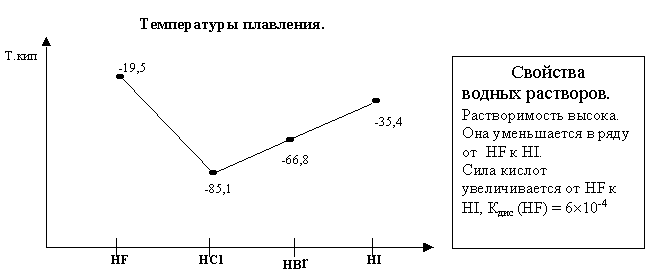
Химическая активность падает от F2 к �/sub>I2 Характер связи Hal–Me – ионный, Hal–Hal – ковалентный Энергия(прочность) связи: наибольшая у элемента – фтора, при взаимодействии со F многие элементы проявляют высшие степени окисления. Высокая реакционная способность: 1) Низкая энергия диссоциации молекул Eсв = 155КДж/моль 2) Высокая энергия связи Э–F Есв = 200 – 600 КДж/моль, следовательно более высокая DH 3) Обычно низкая энергия активации реакции фторирования Особенности химических свойств фтора. S +3F2 = SF6; DH = -1207 кДж 5F2 + 2P = 2PF5; DH = - 3200 кДж 2F2 + 2H2O = 4HF + O2 2F2 + SiO2 Û SiF4 + O2 F2 + 2NaOH Û 2NaF + OF2 + H2O F2 + 2KHSO4 Û 2HF + K2S2O8 (персульфат калия) Химические свойства Cl2, Br2, I2. 2P + 5Cl2 = 2PCl5 (+ PCl3) 2P + 3Br2 = 2PBr3 (+ PBr5) 2P + 3I2 = 2PI3 2Al + 3Br2 = 2AlBr3 2Al + 3I2 = 2AlI3 H2 + Cl2 = 2HCl Пример цепных реакций с неразветвленной цепью 1. Зарождение цепи Сl2 ® Cl* + Cl* (активные центры) 2. Рост(развитие цепи) Сl* + H2 = HCl + H* H* + Cl2 = HCl + Cl* Cl* + H2 = HCl + H* 3. Обрыв цепи (концентрация H2 и Cl2 очень мала, и возрастает вероятность столкновения H* и Cl*) H* + Cl* = HCl H* + H* = H2 Особенности строения. Молекулы линейные, порядок связи равен 1. Молекулы диамагнитны Энергия связи от HF к HI уменьшается (разность между Еат и Еион)
Дипольный момент от HF к HI уменьшается. Восстановительные свойства
HI – лучший восстановитель. KCl + H2SO4(К)= HCl + KHSO4 KBr + H2SO4(К) = Br2 + SO2 + KHSO4 + H2O KI + H2SO4(К) = I2 + H2S + KHSO4 + H2O Взаимодействие галогенов с водой В общем случае можно выделить 3 стадии: 1. Растворение и гидратация Г2 + nH2O ® Г2(р-р)nH2O Из опытных данный следует, что при низких температурах гидраты можно выделить, они представляют собой соединения включения молекул галогенов в пустоты решетки воды. Такие соединения называются клатраты, например: 8Cl2´46H2O. 2. Гидролитическое расщепление молекул галогенов Г2 + H2O ® ½ O2 + 2Г- + H+ Г2 + 2е- ® 2Г- E0 в зависимости от Г(cм выше) H2O – 2e- ® ½ O2 + 2H+ E0=1,23 при pH=7 По этой схеме может идти только процесс со фтором (в случае Cl следует учитывать перенапряжение в выделении O2) Cl2 + H2O = HCl + HOCl Реакция обратимая HCl + Na2CO3 = NaCl + CO2 3. Термическое разложение (например HOCl) Скорость разложения зависит от температуры и как правило увеличивается от Cl к I. Кроме того распад может протекать по разным схемам.
Кислородные соединения галогенов.
Названия кислородсодержащих кислот и солей хлора.
Свойства оксокислот. С увеличением степени окисления устойчивость увеличивается, а окислительная способность уменьшается. Кислоты – наиболее сильные окислители, чем анионы соответствующих солей. Сила кислот. Константы диссоциации
Окислительно-восстановительные свойства галогенов и их соединений.
Межгалоидные соединения. 1. Гомоядерные соединения (одинаковые атомы) Растворимость I2 в воде 0,3 г/л, а в растворе KI I2 хорошо растворим. I2 + I- Û I3-(I5-) Кроме отрицательно заряженных известны и положительно заряженные гомокомплексы иода. 2. Гетероядерные соединения (состоящие из атомов разных элементов)
Все межгалоидные соединения представляют собой либо газы, либо легкокипящие жидкости. Некоторые общие закономерности 1. Чем выше электроотрицательность Hal, тем больше межгалоидных соединений. 2. Устойчивость возрастает при переходе сверху вниз. Химические свойства. Водой разрушаются, полностью гидролизуясь, но как правило с горячей и холодной водой процессы идут по- разному.
Моногалоидные соединения. СlF +H2O Û HF +HClO ClF + NaOH(хол) Û NaClO + NaF + H2O ICl + H2O Û HCl + I2 + HIO3 ClF + NaOH(гор) Û NaCl + NaF + NaClO3 +H2O Тригалоидные соединения СlF3 +H2O(хол) Û HF +HСlO2 ClF3 + H2O(гор) Û HCl + HF+ HClO3 ClF3 + NaOH(гор) Û NaCl + NaF + NaClO3 +H2O Пентагалоидные соединения ClF5 + H2O Û HF + HClO3 ClF5 + NaOH Û NaF + NaClO3 +H2O Гептафторид иода. IF7 + H2O Û HF + H2IO6 IF7 + NaOH Û NaF + Na3H2IO6
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 205; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.20.57 (0.011 с.) |