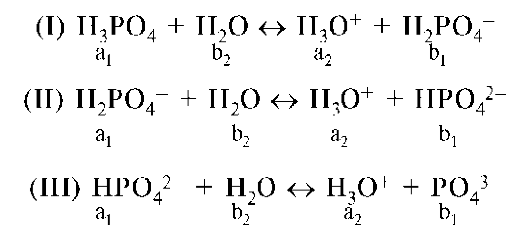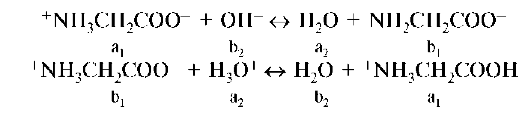Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сила оснований определяется их способностью принимать протон.
Мерой этой способности служит константа основности (Kb). Для произвольного основания в растворе функцию кислоты выполняет вода:
Приложение закона разведения Оствальда к растворам слабых оснований, способных принять только один протон, дает возможность определить в таких растворах концентрацию гидроксид-ионов: c (OH-) =
ния получаем: pOH = 0,5(pKb - lgc(B)), pH = pKw - 0,5(pKb - lgc(B)), где pKb - силовой показатель основания (отрицательный десятичный логарифм). Константы кислотности и основности в сопряженной паре для водного раствора связаны между собой: Ka • Kb = Kw. Чем сильнее кислота, тем слабее сопряженное ей основание, и наоборот. Уксусная кислота (pKa = 4,76) сильнее, чем HCN (pKa = 9). Следовательно, CN- - более сильное основание, чем CH3COO-. При 298 K в водном растворе сумма силовых показателей кислоты и основания в сопряженной протолитической паре равна 14:
В справочных таблицах для кислотно-основных пар приводятся значения только константы кислотности. Для многоосновных кислот Ka определяется для каждой ступени ионизации. На примере ортофос-форной кислоты:
Константа кислотности фосфорной кислоты по второй ступени может трактоваться как константа кислотности дигидрофосфат-иона, а константа кислотности по третьей ступени - как константа кислотности гидрофосфат-иона, т.е. Ka(H3PO4)II = Ka(H2PO4-), Ka(H3PO4)III = = Ka(HPO42-). Константа равновесия процесса (I-III) H3PO4 + 3H2O о 3H3O+ + + PO43- рассчитывается как произведение констант кислотности всех стадий: Ka(H3PO4)I-III = Ka(H3PO4)I • Ka(H3PO4)II • Ka(H3PO4)III = = 7,2 • 10-3 • 6,2-10-8 • 4,6 • 10-13 = 2,1 • 10-22. В рассмотренном выше процессе ступенчатой диссоциации фосфорной кислоты дигидрофосфат-ион в реакции (I) выполняет функцию основания, а в реакции (II) - кислоты. Аналогично гидрофосфат-ион в реакции (II) - основание, а в реакции (III) - кислота. Частицы, способные к взаимодействию как с кислотами, так и с основаниями называются амфолитами. Типичными амфолитами являются аминокислоты. Например, глицин:
Константу равновесия реакции нейтрализации можно выразить не только через равновесные концентрации веществ и ионов, но и через константы кислотности. В общем случае выражение для константы реакции нейтрализации, как и для любого другого прото-литического взаимодействия, можно получить, разделив константу кислотности вещества, стоящего в левой части уравнения, на кон-
станту кислотности вещества, стоящего в правой части уравнения: Кобщ.= Ka (в левой части уравнения)/Ка (в правой части уравнения). Реакция нейтрализации имеет большую роль в жизнедеятельности организма. Постоянная нейтрализация кислого желудочного содержимого с помощью желчи и секретов кишечника обеспечивает оптимальное переваривание пищи, поскольку ферменты, необходимые для этого, имеют значительно различающиеся оптимальные величины pH: pHопт. (пепсин) = 2; pHопт. (гастриксин) = 3,0-3,5; pHопт. (трипсин) = 7,8; pHопт.(панкреатическая липаза) = 9. Реакция нейтрализации обеспечивает оплодотворение яйцеклетки сперматозоидом. Движению сперматозоида способствует слабощелочная среда, в кислой среде они малоподвижны. Поскольку у влагалищных секретов среда в норме кислая, для ее нейтрализации первая капля спермы, в которую добавляется специальный секрет, вырабатываемый придаточными половыми железами, имеет сильнощелочную реакцию среды. Под действием семенной жидкости кислая среда влагалища становится слабощелочной, что обеспечивает оптимальные условия для продвижения сперматозоидов. pH межклеточной жидкости большинства органов составляет в норме 7,4. В целом pH внутриклеточной жидкости варьирует от 4,5. Даже в одном органе клетки, отличающиеся в морфологическом отношении, имеют разные значения pH внутриклеточного содержимого. Определенное значение pH поддерживается и в отдельных структурах внутри клеток. Например, содержимое лизосом всех клеток имеет pH 5. Гидролиз солей. Химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и сопровождающееся изменением рН раствора, называется гидролизом солей. Любую соль можно представить как продукт взаимодействия кислоты и основания. Тип гидролиза соли зависит от природы основания и кислоты, образующих соль. Возможны 3 типа гидролиза солей. Гидролиз по аниону идет, если соль образована катионом сильного основания и анионом слабой кислоты. Например, соль СН3СООNa образована сильным основанием NaOH и слабой одноосновной кислотой СН3СООН. Гидролизу подвергается ион слабого электролита СН3СОО–.
Ионно-молекулярное уравнение гидролиза соли: СН3СОО– + НОН «СН3СООН + ОН– Ионы Н+ воды связываются с анионами СН3СОО– в слабый электролит СН3СООН, ионы ОН– накапливаются в растворе, создавая щелочную среду (рН>7). Молекулярное уравнение гидролиза соли: CH3COONa + H2O «CH3COOH + NaOH Гидролиз солей многоосновных кислот протекает по стадиям, образуя в качестве промежуточных продуктов кислые соли. Например, соль K2S образована сильным основанием КОН и слабой двухосновной кислотой H2S. Гидролиз этой соли протекает в две стадии. 1 стадия: S2– + HOH «HS– + OH– K2S + H2O «KHS + KOH 2 стадия: HS-– + HOH «H2S + OH– KHS + H2O «H2S + KOH Реакция среды щелочная (pH>7), т.к. в растворе накапливаются ОН–-ионы. Гидролиз соли идет тем сильнее, чем меньше константа диссоциации образующейся при гидролизе слабой кислоты (табл.3). Таким образом, водные растворы солей, образованных сильным основанием и слабой кислотой, характеризуются щелочной реакцией среды. Гидролиз по катиону идет, если соль образована катионом слабого основания и анионом сильной кислоты. Например, соль CuSO4 образована слабым двухкислотным основанием Cu(OH)2 и сильной кислотой H2SO4. Гидролиз идет по катиону Cu2+ и протекает в две стадии с образованием в качестве промежуточного продукта основной соли. 1 стадия: Cu2+ + HOH «CuOH+ + H+ 2CuSO4 + 2H2O «(CuOH)2SO4 + H2SO4 2 стадия: CuOH+ + HOH «Cu(OH)2 + H+ (CuOH)2SO4 + 2H2O «2Cu(OH)2 + H2SO4 Ионы водорода Н+ накапливаются в растворе, создавая кислую среду (рН<7). Чем меньше константа диссоциации образующегося при гидролизе основания, тем сильнее идет гидролиз. Таким образом, водные растворы солей, образованных слабым основанием и сильной кислотой, характеризуются кислой реакцией среды. Гидролиз по катиону и аниону идет, если соль образована катионом слабого основания и анионом слабой кислоты. Например, соль CH3COONH4 образована слабым основанием NH4OH и слабой кислотой СН3СООН. Гидролиз идет по катиону NH4+ и аниону СН3СОО–: NH4+ + CH3COO– + HOH «NH4OH + CH3COOH Водные растворы такого типа солей, в зависимости от степени диссоциации образующихся слабых электролитов имеют нейтральную, слабокислую или слабощелочную среду. При смешивании растворов солей, например CrCl3 и Na2S каждая из солей гидролизуется необратимо до конца с образованием слабого основания и слабой кислоты. Гидролиз соли CrCl3 идет по катиону: Cr3+ + HOH «CrOH2+ + H+ Гидролиз соли Na2S идет по аниону: S2– + HOH «HS– + OH– При смешивании растворов солей CrCl3 и Na2S происходит взаимное усиление гидролиза каждой из солей, так как ионы Н+ и ОН– образуют слабый электролит Н2О и ионное равновесие каждой соли смещается в сторону образования конечных продуктов: гидроксида хрома Cr(OH)3 и сероводородной кислоты H2S. Ионно-молекулярное уравнение совместного гидролиза солей: 2Cr3+ + 3S2– + 6H2O = 2Cr(OH)3¯ + 3H2S Молекулярное уравнение: 2CrCl3 + 3Na2S + 6H2O = 2Cr(OH)3 + 3H2S + 6NaCl Соли, образованные катионами сильных оснований и анионами сильных кислот, гидролизу не подвергаются, так как ни один из ионов соли не образует с ионами Н+ и ОН– воды слабых электролитов. Водные растворы таких солей имеют нейтральную среду.
|
||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 300; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.88.130 (0.008 с.) |