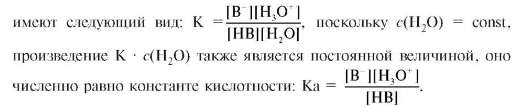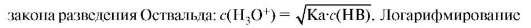Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Водородный показатель и шкала pH
В воде всегда присутствует немного катионов водорода и гидроксид-ионов, которые образуются в результате обратимой диссоциации: H2O H+ + OH- В 1 л чистой воды при комнатной температуре содержится 1.10-7 моль катионов водорода и 1.10-7 моль гидроксид-ионов. Поскольку оперировать числами такого порядка неудобно, для количественной характеристики кислотности среды используют так называемый водородный показатель рН ("пэ аш", от латинского "pundus hydrogenium" - "вес водорода"). Каждое значение рН отвечает определенному содержанию катионов водорода в 1 л раствора. В чистой воде и в нейтральных растворах, где в 1 л содержится 1.10-7 моль катионов водорода, значение рН равно 7. В растворах кислот содержание катионов водорода увеличивается, а содержание гидроксид-ионов уменьшается, в растворах щелочей наблюдается обратная картина. В соответствии с этим меняется и значение водородного показателя (рН). Кислоты, попадая в воду, диссоциируют, и содержание катионов водорода в расчете на 1 л раствора становится больше 1.10-7 моль. Сильные кислоты в водной среде диссоциируют необратимо. Например, хлороводородная кислота полностью превращается в катионы водорода H+ и хлоридные анионы Cl-: HCl = H+ + Cl- Если в 1 л водного раствора содержится 1.10-2 моль HCl, то катионов водорода H+ в этом объеме тоже 1.10-2 моль. Значение водородного показателя (рН) для этого раствора оказывается равным 2. Когда в том же объеме раствора содержится 1.10-3 моль HCl, то катионов H+ становится уже 1.10-3 моль (рН = 3), если хлороводородной кислоты 1.10-4 моль, то содержание H+ - 1.10-4 моль (рН = 4), и т.д. Диссоциация слабых кислот, например угольной, протекает обратимо: H2CO3 H+ + HCO3- Далеко не все присутствующие в растворе молекулы H2CO3 превращаются в катионы H+ и анионы HCO3-. Тем не менее катионов H+ в растворах таких кислот больше, чем в чистой воде (например, 1.10-5 или 1.10-6 моль в каждом литре раствора). Таким образом, в растворах кислот катионов водорода в 1 л раствора содержится всегда больше, чем 1.10-7, а рН оказывается меньше 7. Водородный показатель рН, меньший 7, отвечает кислотной среде раствора. Если рН находится в интервале 5-7, то среда раствора считается слабокислотной, если рН меньше 5, то сильнокислотной: чем сильнее кислота, тем ниже значение рН.
В результате диссоциации оснований в водном растворе появляются гидроксид-ионы, которые связывают катионы водорода, присутствующие в чистой воде, и уменьшают их количество в щелочном растворе: NaOH = Na+ + OH- H+ + OH- = H2O Растворение в 1 л воды 1.10-2 моль сильного основания - гидроксида натрия NaOH - приводит к появлению 1.10-2 моль гидроксид-ионов. Содержание катионов водорода в полученном растворе оказывается равным 1.10-12 моль, а рН принимает значение 12. Если в 1 л воды растворить 1.10-3 моль NaOH, то гидроксид-ионов получится 1.10-3 моль (1.10-11 моль катионов H+, рН = 11). Растворение в том же объеме 1.10-4 моль NaOH даст 1.10-4 моль OH- (1.10-10 моль катионов H+, рН = 10), и т.д. Таким образом, в растворах оснований содержание катионов водорода всегда меньше 1.10-7 моль в 1 л, а водородный показатель (рН) - больше 7. Среда в таких растворах щелочная. Для растворов сильных оснований, диссоциация которых идет необратимо, значение рН будет существенно выше 7. Диссоциация слабых оснований, например, гидрата аммиака, протекает лишь частично, гидроксид-ионов в этом случае образуется меньше, и рН не столь заметно превышает значение, характерное для нейтральной среды. Раствор считается слабощелочным при рН от 7 до 9 и сильнощелочным при рН выше 9. Значения водородного показателя (рН) водных растворов распространенных веществ обычно находятся в интервале от 1 до 13. Приближенно оценить рН растворов можно с помощью кислотно-основных индикаторов. Для более точного измерения водородного показателя используют приборы - рН-метры. Сила кислот и оснований. Сила кислот определяется их способностью отдавать протон. Мерой этой способности служит константа кислотности (Ka). В водном растворе для произвольной кислоты HB функцию основания выполняет вода:
В дальнейшем любую кислоту будем обозначать «а», а основание - «b». В обозначении иногда приписывают индекс «1» или «2», при этом у основания и кислоты одной сопряженной пары индекс одинаковый. Если одну из протолитических пар образует вода, то ей приписывают индекс «2». Важно отметить, что действующие концентрации значительно выше, чем концентрации H+ и OH-. Константа равновесия в соответствии с законом действующих масс
Чем больше константа кислотности, тем сильнее кислота. Например, уксусная кислота сильнее, чем циановодородная кислота, так как Ka(CH3COOH) = 1,74•10-5, Ka(HCN) = 1•10-9. Для удобства расчетов и записи часто пользуются не самими константами, а их отрицательными десятичными логарифмами: pKa = -lgKa. Величину pKa называют силовым показателем кислоты. Например, pKa(CH3COOH) = = -lgKa(CH3COOH) = -lg1,74•10-5 = 4,76; pKa(HCN) = 9. Чем больше величина pKa, тем слабее кислота. Сильные кислоты практически полностью отдают свой протон молекулам воды, поэтому кислотой, присутствующей в растворе, является фактически ион гидроксония. В связи с этим при расчете pH раствора сильной одноосновной кислоты концентрацию протонов приравнивают к концентрации кислоты c (H3O+) = c (HB). В растворах слабых кислот концентрация ионов гидроксония значительно ниже концентрации кислоты. Она рассчитывается на основании
обеих частей этого уравнения дает формулу для расчета pH растворов слабых кислот: pH = 0,5(pKa - lg c (HB)).
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 477; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.64.226 (0.007 с.) |