
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции, происходящие в верхних слоях атмосферыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Необходимо обратить внимание на то, что все данные реакции экзотермические.
Реакции атмосферных ионов
Образующиеся молекулярные ионы обладают очень большой реакционной способностью, быстро реагируют с любыми другими частицами при столкновении, эти реакции также носят экзотермический характер. Но так как при высоком разряжении отдача избыточной энергии маловероятна, то более вероятна рекомбинация иона с электроном, сопровождающаяся диссоциацией: N2+ + O2+ + NO+ + Такие реакции называются реакциями диссоциативной рекомбинации. Атомарный азот в верхних слоях атмосферы образуется исключительно в результате такой реакции. Перенос заряда. Когда молекулярный ион сталкивается с какой-либо нейтральной частицей, между ними может произойти перенос электрона: N2+ (г) + О2 (г) ® N2 (г) + О2+ (г). Это возможно, если Е1(O2) < E2(N2), то есть энергия ионизации молекулы, теряющей электрон, должна быть меньше энергии молекулы, приобретающей электрон (реакция должна быть экзотермическая).
О+(г) + О2(г) ® О (г) + О2+ (г);
Реакции переноса заряда играют большую роль во многих областях химии, особенно в биохимии. Реакции переноса заряда не сопровождаются разрывом химических связей, осуществляется только перенос электрона от одной частицы к другой. Но существует класс реакций в атмосфере, в ходе которых частицы обмениваются атомами: O+ (г) + N2 (г) ® N (г) + NО+ (г); N2+ (г) + О (г) ® N (г) + NО+ (г). Эти реакции являются экзотермическими и протекают очень легко, при этом образуется молекулярный ион NО+ (г). Поскольку энергия ионизации NО самая низкая из всех частиц, находящихся в верхних слоях атмосферы, то NО+ (г) не может ничем нейтрализоваться и этот ион является преобладающим в данной области. Таким образом, молекулы N2, О2 и NО отфильтровывают большую часть опасного (жесткого) ультрафиолетового излучения на высоте около 100 км. На высоте более 30 км фотодиссоциация кислорода остается (реакция 1). В мезосфере и стратосфере концентрация молекулярного кислорода превышает концентрацию атомарного кислорода, поэтому образующиеся атомы часто сталкиваются с молекулами О2, что приводит к образованию озона: О (г) + О2(г) «О3* + 105 кДж/моль. Эта реакция обратима и если частица О3* не отдает избыточную энергию при столкновении с другой (N2 и О2), то молекула распадется. Чем ниже к Земле, тем больше концентрация газов N2 и О2, тем чаще столкновение и стабилизация озона. Но опять же, чем ниже, тем меньше диссоциация О2 на атомы, так как отфильтровано излучение с длиной волны 242 нм. Максимальная скорость образования озона на высоте 50 км, так как мало атомов кислорода и, следовательно, мало озона. Молекулы озона сами могут поглощать излучение, и сильнее всего озоном поглощаются фотоны с длиной волны 200 - 310 нм, что очень важно для нас. Это излучение другими частицами не поглощается в той мере, как озоном. При таком излучении все живое не может существовать. «Озоновый щит» играет важную роль в сохранении жизни на Земле. Обобщенный процесс циклического образования и разложения озона:
О2 (г) + hn ® О (г) + О (г); О2 (г) +О (г) + М (г) ® О3 (г) + М* (г) + выделение тепла; О3 (г) + hn ® О2 (г) + О (г); О (г) + О (г) + М (г) ® О2 (г) + М* (г) + выделение тепла. М* - любая частица в столкновении. Результатом данного процесса является превращение ультрафиолетового излучения Солнца в тепловую энергию. Озоновый цикл обеспечивает повышение температуры в стратосфере (рис. 7.1). В этот цикл вовлекаются многие химические реакции; общим результатом является разложение озона, например: О3(г) + NO(г) ® NО2(г) + О2(г) NО2(г) + O(г) ® NО(г) + О2(г) ------------------------------------------ О3(г) + О(г) ® 2 О2(г) NO является катализатором процесса. Когда в этот цикл вторгаются дополнительные порции оксида азота, значительно уменьшается концентрация озона. Так, при полете сверхзвуковых самолетов в двигателях достигается такая высокая температура, что становится возможной реакция: N2 (г) +O2 (г) ® 2 NО (г), в результате которой оксид азота выбрасывается в стратосферу, существенно снижая концентрацию озона. Разрушение озона обусловлено также влиянием фторхлорметанов: CFxCl4-–x (г)+ hn ® CFxCl3–x (г)+ Cl(г), l = 190 – 225 нм. За этим следует разложение CFxCl3–x и т.д. Расчеты показывают, что скорость образования атомарного хлора максимальна на высоте 30 км. Cl(г) + О3 (г)® ClО(г) + О2 (г) (разрушение озона) Оксид хлора, реагируя с атомарным кислородом, вновь дает атомарный хлор: ClО (г) + О (г) ® Cl (г)+ О2(г); снова Cl(г) + О3 (г)® ClО(г) + О2 (г)... обрыв цепи может происходить при взаимодействии хлора с молекулами водорода, метана, воды, пероксида водорода. В итоге имеем суммарную реакцию: О (г) + О3 (г) ® 2 О2(г). Фреоны очень хорошо сохраняются в атмосфере, плохо растворимы в воде, не горят, имеют низкие температуры кипения, поэтому хорошо испаряются на воздухе. Из тропосферы часть фреонов может уходить с водой и, не гидролизуясь, скапливаться в океане, который становится своеобразным резервуаром фреонов. Постоянно возникающий и разрушающийся слой озона вызывает явление, названное «озонным дождем». Концентрация озона должна быть максимальной на высоте 25 – 30 км. В атмосфере с увеличением высоты концентрация озона убывает из-за концентрации третьих частиц и кислорода. Разрушение озона в основном обусловливает азотный цикл, антропогенное загрязнение атмосферы: * Ядерные взрывы. Разогрев до 6000 К и быстрое охлаждение (замораживание NO). 1 Мт при взрыве дает от 1000 до 12000 тонн оксидов азота (2,5·1032 молекул). * Сверхзвуковые самолеты (18 г NO на 1 кг топлива). 1 млн тонн оксидов азота в год выбрасывают двигатели сверхзвуковых самолетов. * Использование минеральных азотных удобрений. * Сжигание топлива дает до 3 млн тонн оксидов азота в год. В химии и фотохимии атмосферы участвуют пять основных азотсодержащих газов: N2, NH3, NO, NO2, N2O. В конденсированной фазе азот присутствует в форме иона аммония (NH4+) и нитратного иона (NO3–). Возможные взаимодействия можно описать следующей схемой:
2 NO + O2 ® 2 NO2; NO2 + hn® NO + O; O + O2 + M ® O3 + M; O3 + NO ® NO2 + O2; O + NO2 ® NO + O2; O + NO2 + M ® NO3 + M; NO3 + NO ® 2 NO2; NO2 + O3 ® NO3 + O2; O + NO + M ® NO2 + M; NO3 + NO2 + M ® N2O5 + M, где М - третье вещество, принимающее избыток энергии. Цикл взаимодействий на основе соединений азота в тропосфере дополняется образованием азотной кислоты: 4 NO2 + 2 H2O + O2 ® 4 HNO3 или по реакции диспропорционирования 3 NO2 + H2O «2 HNO3 + NO. Атомарный кислород и озон способны вступать в реакции с различными органическими веществами, в результате чего получаются свободные радикалы. Так, для олефинов возможна следующая реакция: O3 + R–CH=CH–R ® RCHO + RO* + HCO*, где RO* и HCO* - свободные радикалы. Образующийся альдегид RCHO может подвергаться фотодиссоциации по реакции: RCHO + hn ® R + HCO*. Кроме альдегидов фотохимически активны также кетоны, пероксиды и ацилнитраты, которые под воздействием солнечной радиации также образуют свободные радикалы. Последующая цепь взаимодействий может быть представлена схемой, где ROO* - пероксидный радикал: ROO* + NO ® NO2 + RO*; ROO* + O2 ® O3 + RO*; RCO*2 + NO ® NO2 + RCO*; RCO* + O2 ® RCO*3; RCO*2 + O2 ® CO2 + RO*2; RCO*3 + NO2 ® RCO3NO2; RO* + NO ® RONO; RH + RO* ® ROH + R*; RH* + O ® OH– + R*. Эта цепь превращений с участием свободных радикалов является основой для образования смога, содержащего ассоциации молекул альдегидов, кетонов, оксидантов и соединений типа пероксиацетилнитратов (ПАН). Пероксиацетилнитрат: О || CH3 – C – O – O – NO2 - это газ, сильно раздражающий слизистую оболочку глаз и отрицательно действующий на ассимиляционный аппарат растений. Другим веществом, также сильнодействующим на слизистую оболочку глаз, присутствующим в смоге, является пероксибензолнитрат (ПБН), имеющий следующую структуру: О || C6H5 – C – O – O – NO2. Антропогенная деятельность и вулканические извержения приводят к накоплению в атмосфере SO2. Фотодиссоциация диоксида серы невозможна, так как длина волн, которые достигают нижних слоев атмосферы, где происходит накопление SO2, слишком велика, жесткое коротковолновое излучение уже отфильтровано. Однако фотодиссоциация NO2 и кислорода дает на данной высоте достаточное количество атомарного кислорода и озона (см. выше) и тогда возможен процесс: SO2 + О + М ® SO3 + М. Эффективность этой реакции возрастает по мере увеличения отношения концентрации SO2 к концентрации NO2. Окислению SO2 до SO3 могут способствовать следы металлов, проявляющих каталитическое действие на данную реакцию (например, марганец). Соединяясь с водой, оксид серы (VI) образует серную кислоту, которая с металлами или аммонием (NH4+) дает сульфаты. Имеется мнение, что диоксид серы существует в атмосфере от нескольких часов до нескольких дней в зависимости от влажности и других условий. Однако установлено, что сернистый газ, поступающий в атмосферу с извержением вулканов, дает серную кислоту, циркулирующую вокруг Земли в стратосфере сроком до года и более. Так, вследствие извержения вулкана Эль-Чичон на юге Мексики 28 марта 1982 года, земной шар опоясал «язык» стратосферного аэрозольного облака, содержащий капельки серной кислоты размером от 0,04 мкм до 1,4 мкм, готовых выпасть в виде сернокислого дождя. Через месяц после извержения в стратосфере путешествовало почти 20 млн. тонн аэрозоля серной кислоты. Даже через год после извержения в апреле 1983 года около 8 млн. тонн серной кислоты еще находилось на околоземной орбите. Переносу диоксида серы на дальние расстояния способствует строительство высоких дымовых труб. Это возможно и снижает степень локального загрязнения, но увеличивает время пребывания SO2 в воздушной среде и степень его превращения в серную кислоту и сульфаты. Таким образом, сернистый газ в сочетании с парами воды (туман) является главным компонентом так называемого сернистого смога (смог лондонского типа). Кислотные дожди. В результате антропогенного загрязнения атмосферы сернистым газом и оксидами азота происходит, как показано выше, образование серной и азотной кислот, выпадающих на Землю вместе с осадками. Кислотность обычной дождевой воды за счет частичного растворения во влаге углекислого газа равна 5,6: рН = 5,6. Но известны случаи выпадения кислых дождей с рН = 2,3 (кислотность лимонного сока!). Такие осадки наносят существенный ущерб качеству воды в природных водоемах, качеству почвы, приводят к разрушению изделий из металлов, архитектурных сооружений, мрамора и бетона. Ежегодно с осадками выпадают миллионы тонн кислот, что ведет к радикальному изменению химии природной среды. Частицы сульфатов размером 0,1 - 1 мкм, присутствующие в атмосфере, рассеивают свет, ухудшая видимость, что отрицательно воздействует на организм человека. В условиях повышенной влажности и гигроскопичности некоторых сульфатов: (NH4)2SO4, NH4HSO4 – рассеивание света возрастает.
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 498; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.33.239 (0.013 с.) |

 ® N (г) + N (г);
® N (г) + N (г);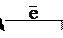
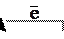
 О2+(г) + NО (г) ® О2 (г) + NО+ (г);
О2+(г) + NО (г) ® О2 (г) + NО+ (г);
 N2+(г) + NО (г) ® N2 (г) + NО+ (г).
N2+(г) + NО (г) ® N2 (г) + NО+ (г).


