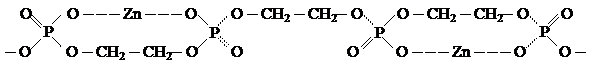Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические основы экологическихСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
КАЛИНИНГРАДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Н.В. Чибисова, Е.К. Долгань ЭКОЛОГИЧЕСКАЯ ХИМИЯ
Калининград КАЛИНИНГРАДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Н.В. Чибисова, Е.К. Долгань
ЭКОЛОГИЧЕСКАЯ ХИМИЯ
Учебное пособие
Калининград УДК 574:54
Чибисова Н.В., Долгань Е.К. Экологическая химия: Учебное пособие / Калинингр. ун-т. - Калининград, 1998. - 113 с. - ISBN 5-88874-108-6.
В учебном пособии объединены основные положения экологической химии. Актуальный материал, посвященный экологии и охране природы, ориентирован на интеграцию химических знаний со знаниями смежных естественнонаучных дисциплин. Рассмотрены вопросы химической экологии, химии окружающей среды и промышленной токсикологии. Уделено внимание проблемам мониторинга и управления качеством природной среды, основным направлениям охраны природы. Предназначено для студентов химических специальностей вузов; будет полезно также преподавателям и учащимся средних учебных заведений.
Рецензент: зав. каф. ихтиологии и экологии КГТУ, д-р биол. наук, профессор В.А. Шкицкий.
Печатается по решению редакционно-издательского Совета Калининградского государственного университета.
ISBN 5-88874-108-6 © Калининградский государственный университет, 1998 ВВЕДЕНИЕ
В настоящее время экология представляет собой сложный интегрированный комплекс наук. Специалисты-химики должны иметь достаточно ясное понимание вопросов взаимоотношения современного технизированного общества и окружающей среды, функционирования биосферы в условиях все усиливающегося антропогенного давления, методов анализа природных объектов, контроля качества окружающей среды и места химии в экологической науке. Экологические проблемы всегда необычайно трудны тем, что они многосвязные, охватывают целую систему отношений живых организмов и неживой природы. Для современной экологии характерно как изучение существующих процессов равновесия, так и поиск новых условий. Экология как наука, охватывающая круг явлений в биосфере, тесно связана с вопросами биологии, химии, химической технологии, сельского хозяйства и др. Так как в основе жизни, как и в основе изменения химического состава биосферы, лежат химические процессы, для описания и управления динамическим равновесием в биосфере необходимо знание химических механизмов взаимодействия между отдельными подсистемами. Эта область экологии оформилась в отдельную научную дисциплину - химическую экологию, под которой понимается наука о химических взаимодействиях между живыми организмами и неживой природой. В задачи химической экологии входят вопросы о степени влияния отдельных видов антропогенных воздействий на живую природу, предсказания возможных экологических последствий химических загрязнений. Доминирующим аспектом здесь является биологический. Существует и другой аспект взаимоотношения химии и экологии, который изучает качественный и количественный состав антропогенных загрязнений биосферы в результате производственной и сельскохозяйственной деятельности человека и механизмы химических превращений веществ в окружающей среде. В решении этих проблем доминирующим является химический аспект, который больше входит в компетенцию специалистов в области химии, чем биологии. Эта область знаний получила название экологической химии, под которой понимается наука об антропогенных химических загрязнениях и о механизмах их превращений в биосфере. Задача экологической химии - максимальное уменьшение уровня нагрузки антропогенных воздействий за счет разработки новых или модификации существующих технологических процессов, разработки способов эффективной очистки отходов производств, разработки способов прогнозирования и регуляции уровня химического загрязнения в объектах окружающей среды. Сюда же относят: рекомендации по разработке новых препаратов, употребляемых в сельском хозяйстве и бытовой химии; рекомендации по профилактике других процессов, приводящих к загрязнению окружающей среды; решение вопросов, связанных с порчей пищевых продуктов, деструкцией конструкционных материалов и др. Для решения проблем охраны окружающей среды необходимы исследования того, как ведут себя в ней, к каким последствиям приводят новые виды химических соединений, попадающих в круговорот веществ в биосфере в результате человеческой деятельности, то есть требуется качественно новый подход к оценке взаимодействия человека с окружающей средой и его влиянию на скорость и направление антропогенных и природных факторов. Наряду с констатацией происходящих в природе часто негативных изменений нужно переходить к прогнозированию и управлению качеством среды обитания.
ВЗАИМОДЕЙСТВИЙ
Экологические факторы среды
Окружающая организм среда - это природные тела и явления, с которыми она находится в прямых или косвенных отношениях. Условия среды, способные оказывать прямое или косвенное влияние на живые организмы, называются экологическими факторами. Существует несколько классификаций экологических факторов среды. Наиболее простой и ставшей классической является классификация, по которой экологические факторы среды делятся на две категории: абиотические факторы (факторы неживой природы) и биотические факторы (факторы живой природы). К абиотическим факторам относятся климатические - свет, температура, влага, движение воздуха, давление; эдафогенные (почвенные) - механический состав, влагоемкость, воздухопроницаемость, плотность; орографические - рельеф, высота над уровнем моря, экспозиция склона; химические - газовый состав воздуха, солевой состав среды, концентрация, кислотность и состав почвенных растворов. К биотическим факторам относятся фитогенные (растительные организмы), зоогенные (животные), микробиогенные (вирусы, простейшие, бактерии, риккетсии) и антропогенные (деятельность человека). Оригинальную классификацию экологических факторов предложил А.С. Мончадский (1962), исходя из того, что приспособительные реакции организмов к тем или иным факторам среды определяются степенью постоянства этих факторов. Это: - первичные периодические факторы (температура, свет), зависящие от периодичности вращения Земли и смены времен года; - вторичные периодические факторы (влажность, осадки, динамика растительной пищи, содержание растворенных газов в воде, внутривидовые взаимодействия) как следствие первичных периодических; - непериодические факторы (эдафические факторы, взаимодействие между разными видами, антропогенные воздействия, почвенно-грунтовые факторы), не имеющие правильной периодичности. Воздействие химического компонента абиотического фактора на живые организмы выражается в существовании некоторых верхних и нижних границ амплитуды допустимых колебаний отдельных факторов (температура, соленость, рН, газовый состав и др.), то есть определенный режим существования. Чем шире пределы какого-либо фактора, тем выше устойчивость, или, как ее называют, толерантность, данного организма. Лимитирующим фактором развития растений является элемент, концентрация которого лежит в минимуме. Это определяется законом, называемым законом минимума Ю.Либиха (1840). Либих, химик-органик, один из основоположников агрохимии, выдвинул теорию минерального питания растений. Урожай культур часто лимитируется элементами питания, присутствующими не в избытке, такими как СО2 и Н2О, а теми, которые требуются в ничтожных количествах. Например: бор - необходимый элемент питания растений, но его мало содержится в почве. Когда его запасы исчерпываются в результате возделывания одной культуры, то рост растений прекращается, если даже другие элементы находятся в изобилии. Закон Либиха строго применим только в условиях стационарного состояния. Необходимо учитывать и взаимодействие факторов. Так, высокая концентрация или доступность одного вещества или действие другого (не минимального) фактора может изменять скорость потребления элемента питания, содержащегося в минимальном количестве. Иногда организм способен заменять (частично) дефицитный элемент другим, более доступным и химически близким ему. Так, некоторым растениям нужно меньше цинка, если они растут на свету, а моллюски, обитающие в местах, где есть много стронция, заменяют им частично кальций при построении раковины. Экологические факторы среды могут оказывать на живые организмы воздействия разного рода: 1) раздражители, вызывающие приспособительные изменения физиологических и биохимических функций (например, повышение температуры воздуха ведет к увеличению потоотделения у млекопитающих и к охлаждению тела); 2) ограничители, обусловливающие невозможность существования в данных условиях (например, недостаток влаги в засушливых районах препятствует проникновению туда многих организмов); 3) модификаторы, вызывающие анатомические и морфологические изменения организмов (например, запыленность окружающей среды в индустриальных районах некоторых стран привела к образованию черных бабочек березовых пядениц, сохранивших свою светлую окраску в сельских местностях); 4) сигналы, свидетельствующие об изменении других факторов среды. В характере воздействия экологических факторов на организм выявлен ряд общих закономерностей. Закон оптимума - положительное или отрицательное влияние фактора на организмы - зависит от силы его воздействия. Недостаточное или избыточное действие фактора одинаково отрицательно сказывается на жизнедеятельности особей. Благоприятная сила воздействия экологического фактора называется зоной оптимума. Одни виды выносят колебания в широких пределах, другие - в узких. Широкая пластичность к какому-либо фактору обозначается прибавлением частицы «эври», узкая - «стено» (эвритермные, стенотермные - по отношению к температуре, эвриотопные и стенотопные - по отношению к местам обитания). Неоднозначность действия фактора на разные функции. Каждый фактор неоднозначно влияет на разные функции организма. Оптимум для одних процессов может быть неблагоприятным для других. Например, температура воздуха более 40°С у холоднокровных животных увеличивает интенсивность обменных процессов в организме, но тормозит двигательную активность, что приводит к тепловому оцепенению. Взаимодействие факторов. Оптимальная зона и пределы выносливости организмов по отношению к какому-либо из факторов среды могут смещаться в зависимости от того, с какой силой и в каком сочетании действуют одновременно другие факторы. Так, жару легче переносить в сухом, а не во влажном воздухе. Угроза замерзания выше при морозе с сильным ветром, нежели в безветренную погоду. Вместе с тем взаимная компенсация действия факторов среды имеет определенные пределы и полностью заменить один из них другим нельзя. Дефицит тепла в полярных областях нельзя восполнить ни обилием влаги, ни круглосуточной освещенностью в летнее время. Для каждого вида животных необходим свой набор экологических факторов. Воздействие химического компонента абиотического фактора на живые организмы. Абиотические факторы создают условия обитания растительных и животных организмов и оказывают прямое или косвенное влияние на жизнедеятельность последних. К абиотическим факторам относят элементы неорганической природы: материнская порода почвы, химический состав и влажность последней, солнечный свет, теплота, вода и ее химический состав, воздух, его состав и влажность, барометрическое и водное давление, естественный радиационный фон и др. Химическими компонентами абиотических факторов являются питательные вещества, следы элементов, концентрация углекислого газа и кислорода, ядовитые вещества, кислотность (рН) среды. Влияние рН на выживаемость организмов-гидробионтов. Большинство организмов не выносят колебаний величины рН. Обмен веществ у них функционирует лишь в среде со строго определенным режимом кислотности-щелочности. Концентрация водородных ионов во многом зависит от карбонатной системы, которая является важной для всей гидросферы и описывается сложной системой равновесий, устанавливающихся при растворении в природных пресных водах свободного СО2, по реакции: СО2 + Н2О Ы Н2СО3 Ы Н+ + НС Именно эта реакция является причиной того, что рН пресных природных вод редко бывает теоретически нейтральной, то есть равной 7. Чаще всего рН чистой воды колеблется от 6,9 до 5,6. В природе приведенное выше равновесие в чистом виде не существует, так как на природные воды оказывает действие многочисленные факторы: температура, давление, содержание в атмосфере кислорода, аммиака, диоксида и триоксида серы, азота, состав пород по которым протекает река или расположено озеро. рН сравнительно легко измерить, поэтому его изучили во многих водных местообитаниях. Если рН не приближается к крайнему значению (от 6,5 до 8,5), то сообщества способны компенсировать изменения этого фактора и толерантность сообщества к диапазону рН, встречающемуся в природе, весьма значительна. Так как изменение рН пропорционально изменению количества СО2, рН может служить индикатором скорости общего метаболизма сообщества (фотосинтеза и дыхания). В воде с низким рН содержится мало биогенных элементов, в связи с чем продуктивность здесь мала. рН сказывается и на распределении водных организмов. Растения растут в воде с рН ниже 7,5 (Isoetes и Sparganium), от 7,7 до 8,8 (Potamogeton и Elodea canadensis), от 8,4 до 9,0 (Typha angustifolia). Развитие сфагновых мхов стимулируют кислые воды торфяников, в которых очень редки моллюски, ввиду отсутствия извести, зато часто встречаются личинки двукрылых из рода Chaoborus. Рыбы выносят рН в пределах от 5,0 до 9,0, но некоторые виды способны приспосабливаться к значению рН до 3,7. При рН > 10 вода гибельна для всех рыб. Максимальная продуктивность вод приходится на рН между 6,5 и 8,5. В таблице 1.1 указаны основные величины рН для пресноводных рыб Европы. Аэробные и анаэробные организмы. Аэробными организмами называются такие организмы, которые способны жить и развиваться только при наличии в среде свободного кислорода, используемого ими в качестве окислителя. К аэробным организмам принадлежат все растения, большинство простейших и многоклеточных животных, почти все грибы, то есть подавляющее большинство известных видов живых существ. У животных жизнь в отсутствие кислорода (анаэробиоз) встречается как вторичное приспособление. Аэробные организмы осуществляют биологическое окисление главным образом посредством клеточного дыхания. В связи с образованием при окислении токсичных продуктов неполного восстановления кислорода, аэробные организмы обладают рядом ферментов (каталаза, супероксиддисмутаза), обеспечивающих их разложение и отсутствующих или слабо функционирующих у облигатных анаэробов, для которых кислород оказывается вследствие этого токсичным. Наиболее разнообразна дыхательная цепь у бактерий, обладающих не только цитохромоксидазой, но и другими терминальными оксидазами. Особое место среди аэробных организмов занимают организмы, способные к фотосинтезу, - цианобактерии, водоросли, сосудистые растения. Выделяемый этими организмами кислород обеспечивает развитие всех остальных аэробных организмов. Организмы, способные развиваться при низкой концентрации кислорода (Ј 1 мг/л), называются микроаэрофилами. Анаэробные организмы способны жить и развиваться при отсутствии в среде свободного кислорода. Термин «анаэробы» ввел Луи Пастер, открывший в 1861 году бактерии маслянокислого брожения. Распространены они главным образом среди прокариот. Метаболизм их обусловлен необходимостью использовать иные окислители, чем кислород. Многие анаэробные организмы, использующие органические вещества (все эукариоты, получающие энергию в результате гликолиза), осуществляют различные типы брожения, при которых образуются восстановленные соединения - спирты, жирные кислоты. Другие анаэробные организмы - денитрифицирующие (часть из них восстанавливает окисное железо), сульфатвоссстанавливающие, метанообразующие бактерии - используют неорганические окислители: нитрат, соединения серы, СО2. Анаэробные бактерии разделяются на группы маслянокислых и т.д. в соответствии с основным продуктом обмена. Особую группу анаэробов составляют фототрофные бактерии. По отношению к О2 анаэробные бактерии делятся на облигатных, которые неспособны использовать его в обмене, и факультативных (например, денитрифицирующие), которые могут переходить от анаэробиоза к росту в среде с О2. На единицу биомассы анаэробные организмы образуют много восстановленных соединений, основными продуцентами которых в биосфере они и являются. Последовательность образования восстановленных продуктов (N2, Fe2+, H2S, CH4), наблюдаемая при переходе к анаэробиозу, например в донных отложениях, определяется энергетическим выходом соответствующих реакций. Анаэробные организмы развиваются в условиях, когда О2 полностью используется аэробными организмами, например в сточных водах, илах.
Таблица 1.1 Химические экорегуляторы
Живые организмы, принадлежащие к растительному или животному царству, влияют на свое окружение путем взаимно перекрещивающего действия различных молекул. Эти взаимодействия могут происходить между животными, растениями, между животными и растениями. Кроме того, неживая природа также воздействует на животных и растения. Изучением таких взаимодействий и химических веществ, служащих посредниками при этом, занимается химическая экология. Успехи химической экологии во многом обязаны появлению новых физико-химических методов исследования, позволяющих установить структуру вещества в субмиллиграммовом количестве. Основы химической экологии изложены Флоркиным (1966), разработавшим терминологию и сформулировавшим основные идеи и направления новой науки. Химические взаимодействия осуществляются при передаче закодированных сообщений при помощи специфических молекул, а также используются для защиты или нападения на всех уровнях эволюционного развития. Сложность взаимоотношений между организмами выражается в характере действия данного организма на среду (межвидовое или внутривидовое) - являются ли они благоприятными или вредными для оказывающего их вида. Ниже приведена классификация различных типов химических воздействий организма на среду.
Классификация типов химических воздействий организма на среду (по М. Барбье, 1978) Классификация экосистем
В общем виде экосистемы подразделяются на естественные (луг, тундра, пустыня, лес, озеро, море, океан) и искусственные (город, агроэкосистема, аквариум, космический корабль). По структурным признакам:
По источникам энергии - четыре типа функциональных систем: 1. Природные, движимые солнцем, несубсидируемые (открытые океаны и высокогорные леса: Е=1000-10000 ккал/м2). 2. Природные, движимые солнцем и субсидируемые другими естественными источниками (воды континентального шельфа, некоторые дождевые леса: Е=10000-40000 ккал/м2). 3. Движимые солнцем и субсидируемые человеком (агроэкосистемы, аквариумы: Е=10000-40000 ккал/м2). 4. Города, пригороды, индустриальные зоны, движимые топливом (ископаемым, ядерным и т.д.). Глобальный источник не солнце, а топливо, хотя эти экосистемы зависят от первых трех. В своем развитии человеческое общество прошло через все отмеченные четыре типа экосистем. Но сейчас - резкая поляризация развития: высокоразвитые страны потребляют в крупных масштабах нефть, уголь, газ. «Третий мир» зависит от биомассы (древесины) как основного источника энергии (т.е. движима солнцем). Подобно тому, как природные силы сменила эра горючих ископаемых, на смену им придет эра атомной энергии.
Круговорот углерода
Большой (геологический) круговорот углерода можно представить в виде схемы (рис. 4.1). Биотический круговорот углерода является составной частью большого круговорота в связи с жизнедеятельностью организмов. Углекислота, или СО2, находящаяся в атмосфере (23,5·1011 т) или в растворенном состоянии в воде, служит сырьем для фотосинтеза растений и переработки углерода в органическое вещество живых существ, т.е. в процессе фотосинтеза превращается в сахара, затем преобразуется в протеины, липиды и т.д. Эти вещества служат углеводным питанием животным и наземным растениям, т.е. поступают в распоряжение консументов разных уровней, а далее - редуцентов. При дыхании организмов СО2 возвращается в атмосферу. Определенная часть углерода накапливается в виде мертвой органики и переходит в ископаемое состояние. Когда наступает смерть, то сапрофаги и биоредуценты двух типов разлагают и минерализуют трупы, образуя цепи питания, в конце которых углерод нередко поступает в круговорот в форме углекислоты («почвенное дыхание»). Животные-сапрофаги и сапрофатические микроорганизмы, обитающие в почве, превращают накопившиеся в ней остатки в новое образование органической материи, более или менее мощный слой коричневой или черной массы - гумус. Иногда из-за недостатка воздуха или высокой кислотности цепь бывает неполной или короткой, т.е. органические остатки накапливаются в виде торфа, образуя торфяные болота. В некоторых болотах слой торфа достигает мощности 20 м и более. Здесь и приостанавливается природный (биологический) круговорот. Залежи каменного угля или торфа - продукт процессов фотосинтеза растений прошлых геологических эпох. Однако солнечную энергию, аккумулированную в ископаемом топливе, человек интенсивно высвобождает при сжигании топлива, при этом СО2 поступает в атмосферу. Основная масса углерода биосферы аккумулирована в карбонатных отложениях дна океана (известняки и кораллы): 1,3·1016 т, кристаллических породах - 1,0·1016 т. В каменном угле и нефти - 3,4·1015 т. Именно этот углерод принимает участие в медленном геологическом круговороте. Жизнь на Земле и газовый баланс атмосферы поддерживается количеством углерода, содержащегося в растительных (5·1011 т) и животных (5·109 т) тканях. Однако в настоящее время человек интенсивно замыкает на себя круговорот веществ, в том числе и углерода. Так, например, подсчитано, что суммарная биомасса всех домашних животных уже превышает биомассу всех диких наземных животных. Площади культурных растений приближаются к площади естественных биогеоценозов, и многие культурные растения экосистемы по своей продуктивности значительно превосходят природные. С другой стороны, поступление диоксида углерода в атмосферу в результате сжигания энергоносителей ведет к глобальным нарушениям в биосфере - нарушению теплового баланса. За последнее столетие содержание СО2 увеличилось на 10%, причем основной прирост произошел в последние десятилетия. В атмосфере задерживается около половины всего «антропогенного» СО2, остальное поглощается Мировым океаном. Считается, что экосистемы (наземные) ассимилируют около 12% СО2, общее время его переноса - 8 лет. В пособии Н.М. Кузьменко, Е.А. Стрельцова и А.И. Кумачева «Экология на уроках химии» отмечается, что еще в 1962 году климатолог и метеоролог М.И. Будыко предостерегал, что сжигание огромного количества топлива неизбежно приведет к возрастанию в атмосфере СО2. Так, в 1956 г. содержание СО2 было 0,028%, в 1985 г. - 0,034%, а в 1989 г. составило 0,035%. Следовательно, за 33 года содержание СО2 возросло на 25% от первоначальной величины. По прогнозам, к середине XXI века содержание СО2 в атмосфере удвоится. Накопление СО2 в атмосфере во всем мире связывается сейчас с так называемым «парниковым эффектом» (этому способствует также накопление СН4, СFCl2, N2О). Диоксид углерода не поглощает видимую и ближнюю УФ-области солнечной радиации, а с другой стороны, ИК-излучение Земли поглощается СО2 в атмосфере, не пропускается в космос. Задерживание тепла вблизи поверхности Земли - процесс очень важный для поддержания жизни на Земле, иначе средняя температура была бы на 33оС ниже существующей. Но перспективы быстрого повышения tоС Земли очень опасны, так как приведут к повышению уровня Мирового океана. Многие климатологии рассматривают длительную жару 1988 г. в Северном полушарии последствиями «парникового эффекта».
Круговорот азота
Несмотря на величайшую сложность, этот круговорот осуществляется быстро и беспрепятственно. Воздух, содержащий 78% азота, одновременно служит и огромным вместилищем и предохранительным клапаном системы. Он беспрерывно и в разных формах питает круговорот азота. Цикл азота состоит в следующем. Его главная роль заключается в том, что он входит в состав жизненно важных структур организма - аминокислот белка, а также нуклеиновых кислот. В живых организмах содержится примерно 3% всего активного фонда азота. Растения потребляют примерно 1% азота; время его круговорота составляет 100 лет. От растений-продуцентов азотосодержащие соединения переходят к консументам, от которых после отщепления аминов от органических соединений азот выделяется в виде аммиака или мочевины, а мочевина затем также превращается в аммиак (вследствие гидролиза).
Рис. 4.1. Трансформация и использование СО2 в природе
В дальнейшем в процессах окисления азота аммиака (нитрификации) образуются нитраты, способные ассимилироваться корнями растений. Часть нитритов и нитратов в процессе денитрификации восстанавливается до молекулярного азота, поступающего в атмосферу. Все эти химические превращения возможны в результате жизнедеятельности почвенных микроорганизмов. Эти удивительные бактерии - фиксаторы азота - способны использовать энергию своего дыхания для прямого усвоения атмосферного азота и синтезирования протеидов. Таким путем в почву ежегодно вносится около 25 кг азота на 1 га. Но самые эффективные бактерии живут в симбиозе с бобовыми растениями в клубеньках, развивающихся на корнях растений. В присутствии молибдена, который служит катализатором, и особой формы гемоглобина (уникальный случай у растений) эти бактерии (Rhizobium) ассимилируют громадные количества азота. Образующийся (связанный) азот постоянно диффундирует в ризосфере (часть почвы), когда клубеньки распадаются. Но еще азот поступает в наземную часть растений. Благодаря этому бобовые исключительно богаты протеинами и очень питательны для травоядных. Годовой запас, таким образом накапливаемый в культурах клевера и люцерны, составляет 150-140 кг/га. Помимо бобовых такие бактерии живут на листьях растений (в тропиках) из семейства Rublaceae, а также актиномицеты - на корнях ольхи, фиксирующие азот. В водной среде - это синие водоросли. Итак, азот из разнообразных источников поступает к корням в виде нитратов, абсорбируется корнями и трансформируется в листья для синтеза протеинов. Протеины служат основой азотного питания животных, а также пищей некоторых бактерий (паразитов). Организмы, разлагающие органическое вещество после смерти, переводят азот из органических соединений в минеральные. Каждая группа биоредуцентов специализируется на каком-либо одном звене этого процесса. Цепь заканчивается деятельностью аминообразующих организмов, образующих аммиак (NН3), который далее входит в цикл нитрификации: Nitrosomonas окисляет его до нитритов, а Nitrobarter окисляет нитриты в нитраты. С другой стороны, бактерии-денитрификаторы разлагают нитраты, освобождают N2, который улетучивается в атмосферу. Но этот процесс не очень опасен, так как разлагает примерно 20% общего азота, и то лишь на почвах, очень удобренных навозом (примерно 50-60 кг азота 1 га). Круговорот азота в настоящее время подвергается сильному воздействию со стороны человека. С одной стороны, массовое производство азотных удобрений и их использование приводит к избыточному накоплению нитратов. Азот, поступающий на поля в виде удобрений, теряется из-за отчуждения урожая, выщелачивания и денитрификации. С другой стороны, при снижении скорости превращения аммиака в нитраты аммонийные удобрения накапливаются в почве. Возможно подавление деятельности микроорганизмов в результате загрязнения почвы отходами промышленности. Однако эти процессы носят локальный характер. Гораздо большее значение имеет поступление оксидов азота в атмосферу при сжигании топлива на ТЭЦ, транспорте, заводах («лисий хвост»). В промышленных районах их концентрация в воздухе становится очень опасной. Под воздействием излучения происходят реакции органики (углеводородов) с оксидами азота с образованием высокотоксичных и канцерогенных соединений.
Круговорот фосфора
Фосфор совершает круговорот в наземных экосистемах в качестве важной и необходимой составной части цитоплазмы: биоредуценты минерализуют органические соединения фосфора из отмерших организмов в фосфаты, которые вновь потребляют корни растений. Громадные запасы фосфора, накопившиеся за прошлые геологические эпохи, содержат горные породы; в процессе разрушения эти породы отдают фосфаты наземным экосистемам; однако значительные количества фосфатов оказываются вовлеченными в круговорот воды, когда происходит их выщелачивание водой и вынос в моря и океаны. Здесь они обогащают соленые воды, питают фитопланктоны и связанные с ним пищевые цепи. Затем вместе с отмершими остатками фосфаты погружаются в океанические глубины, часть теряется в глубинных отложениях, часть возвращается на землю с помощью морских птиц. Здесь имеется в виду гуано, огромные залежи которого на побережье Перу указывают на то, что некогда морские птицы играли бульшую роль в его накоплении, чем теперь. Возврат фосфора возможен еще и благодаря рыболовству. Рыбу во всем мире используют в качестве удобрения (рыбная мука), в том числе под посевы риса. Считают, что каждый год таким образом возвращается в круговорот 60 тыс. тонн фосфора, что далеко не компенсирует расход тех 2 млн. тонн фосфатов, которые ежегодно добываются из залежей и быстро выщелачиваются при использовании в качестве удобрений. Рано или поздно, это становится тревожным и опасным. Фосфор - это слабое звено в жизненной цепи, обеспечивающей существование человека.
Рис. 4.2. Круговорот азота ТОКСИКАНТЫ ОКРУЖАЮЩЕЙ СРЕДЫ
Химическое загрязнение является нарастающей угрозой среде обитания. Охрана природы от нависшей над ней химической опасности стала глобальной проблемой. Она связана с производительными силами общества: с развитием промышленного и сельскохозяйственного производства, энергетики, транспорта, добычей полезных ископаемых. Все это ведет к поступлению в воздух, воду, почву сотен тысяч токсичных соединений, проникновению их в организм растений, животных и человека. Повсеместное применение различных химических веществ в быту, в сфере научных исследований также способствует нарастанию химико-экологической опасности. В продаже сейчас около 40000 различных химикатов и ежегодно к ним добавляется сотня других. Масштабы техногенного химического загрязнения природной среды не поддаются точной оценке, однако приводимые в литературе данные свидетельствуют о дорогой цене, которую приходится платить человеку за успехи, достигнутые в ходе научно-технического прогресса. Так, за один год на Земле сжигается 7 миллиардов тонн условного топлива и выплавляется более 800 миллионов тонн различных металлов, что сопровождается выделением в окружающую среду сотен миллионов тонн вредных веществ. По данным В.А. Ковды, в биосферу уже с середины семидесятых годов ежегодно поступало 600 миллионов тонн токсичных газообразных веществ, в том числе оксида углерода (II) - 200 миллионов тонн, сернистого газа - 150 миллионов тонн, несколько миллиардов тонн различных аэрозолей, 5500 миллиардов кубических метров сточных вод. В настоящее время под токсикантами окружающей среды понимают такие вредные вещества, которые распространяются в окружающей нас среде далеко за пределы своего первоначального местонахождения и оказывают скрытое вредное воздействие на животных, растения и впоследствии на человека. Подлинные токсиканты - это те ядовитые вещества, которые сам человек неосмотрительно включает в круговорот природы. Основное ядро токсикантов окружающей среды составляют пестициды: это собирательное название охватывает все средства борьбы с вредными организмами. Понятие «биоцид» часто распространяется на те биологически активные вещества, которые попадают из промышленных сточных вод в биологический круговорот веществ. Например, HCN - синильная кислота является инсектицидом, а потому также и биоцидом, но она быстро улетучивается и не может быть включена в разряд токсикантов окружающей среды.
Неорганические токсиканты
Проблема деградации окружающей среды в значительной мере связана с отрицательным воздействием неорганических веществ, среди которых наибольшую экологическую опасность создают металлы и их соединения, а также диоксид серы и оксиды азота. Влияние последних показано в разделе «Экологическая химия атмосферы». Попав в живую клетку, соединение металла первоначально осуществляет некоторую простейшую химическую реакцию, за которой затем следует каскадный отклик все более сложных взаимодействий биологических молекул и ансамблей. Целый ряд металлов включен в различные процессы метаболизма. Эти металлы являются жизненно важными для живых организмов. Так, например, железо и медь - переносчики кислорода в организме, натрий и калий регулируют клеточное осмотическое давление, магний и кальций (и некоторые другие металлы) активизируют энзимы - биологические катализаторы. Многие металлы в виде конкретных соединений нашли применение в медицине в качестве лекарственных и диагностических средств. Другие же оказались крайне нежелательными для живых организмов и небольшие избыточные дозы их оказывают фатальное воздействие. Активность металлов как ядов в значительной мере зависит от формы, в которой они попадают в организм. Так, известный всем мышьяк ядовит в трехвалентном состоянии и практически неядовит в пятивалентном состоянии. А соединение мышьяка (CH3)3As+CH2COO– вообще неядовито и содержится в тканях некоторых морских ракообразных и рыб, откуда он поступает в организм человека. Дневная потребность цинка составляет 10 - 15 мг, но бульшие дозы уже отрицательно сказываются на организме. Однако ион Zn2+ хорошо комплексуется фосфатными группами, отщепляемыми от нуклеиновых кислот и липидов. В результате ион Zn2+ переходит в малоядовитую форму и легко выводится из организма:
Барий - нежелательный металл для живой клетки, но сульфат бария практически нерастворим в воде и выводится из организма без какого-либо воздействия, что позволило применять его при рентгеновских исследованиях желудочно-кишечного тракта. Ртуть не оказывает отрицательно
|
|||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 726; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.78.249 (0.015 с.) |


 .
.